初中科学专题复习——物质的分离和提纯
图片预览





文档简介
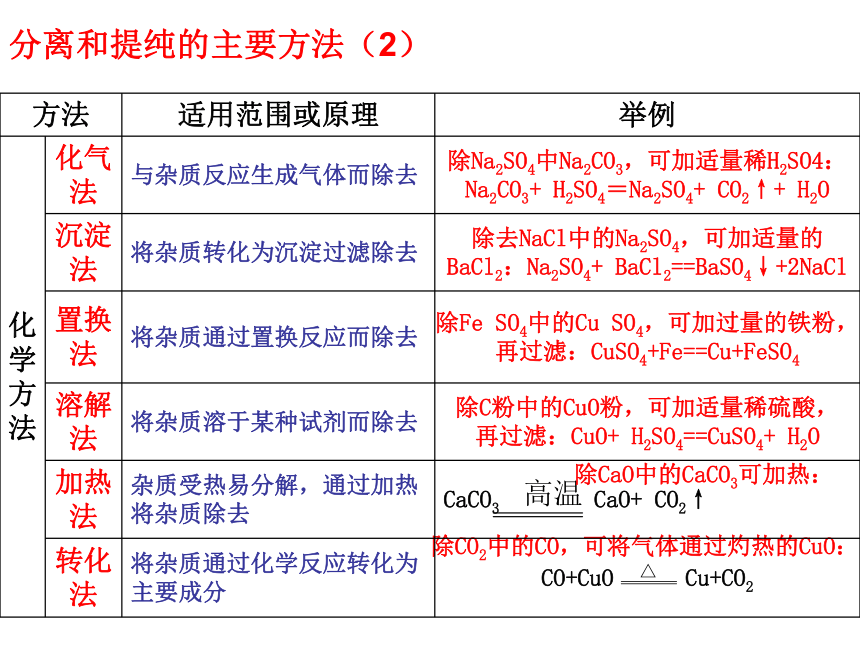
课件17张PPT。初中科学专题复习 ——物质的分离、除杂和提纯分离:就是用物理或化学的方法将混合物中的各组分一一分开。 注意:分离完成后各组分要保持(经过化学反应使混合物的组分经过转化而分离还要恢复为)原有的物质组成和状态。 除杂和提纯:是将混合物中的某组分用物理或化学的方法除去而得到纯物质。 注意:在提纯物质的过程中除了选择合适的试剂外,还应选择适宜的杂质(或产物),以便于同被提纯物进行分离。 分离和提纯的主要方法(1) 分离和提纯的主要方法(2) 除CaO中的CaCO3可加热:除CO2中的CO,可将气体通过灼热的CuO:例题2:除去NaCl溶液中的杂质Ba(OH)2,若只准加入一种试剂,则这种试剂是_______。【答案】 CuSO4或Fe2(SO4)3或H2SO4例题1:除掉氯化钠溶液中混有的少量碳酸钠,应选用适量的试剂是 [ ]
A.稀硫酸 B.硝酸银 C.澄清石灰水 D.稀盐酸 【答案】 D练一练:1.下列括号中的物质是除去杂质所用的试剂,其中错误的是( )
A.CaO中有少量CaCO3(盐酸) B.H2中有少量HCl(苛性钠溶液)
C.FeSO4溶液中有少量CuSO4(铁粉)
D.CO2中有少量CO(灼热的氧化铜粉末)
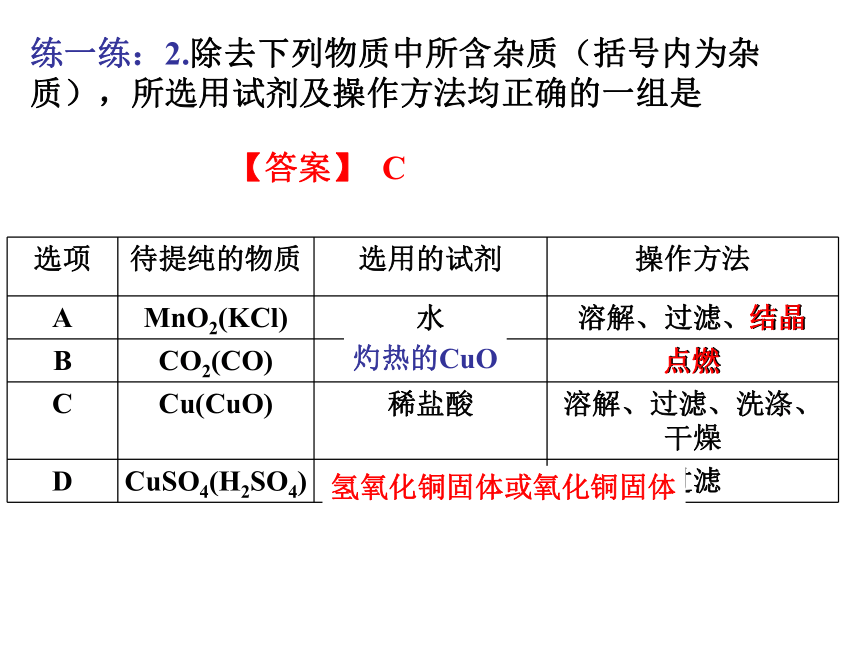
【答案】 A练一练:2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是【答案】 C结晶点燃氧气灼热的CuO氢氧化钠溶液氢氧化铜固体或氧化铜固体(2)NaOH溶液(Na2CO3)(3)Na2CO3 溶液(NaOH)(1)Na2SO4 溶液(H2SO4)练一练3:除去下列物质种的杂质(括号中的为杂质)
并写出化学方程式。(4)CaCl2 溶液(NaCl)向溶液中滴加适量的NaOH或Na2CO3溶液向溶液中滴加适量的Ca(OH)2或Ba(OH) 2溶液后过滤掉沉淀向溶液中通入适量的CO2向溶液中滴加足量的Na2CO3或K2 CO3溶液后过滤得到沉淀,在沉淀中加入适量的稀盐酸使之转化为CaCl2溶液练一练:硝酸钠溶液中含有Cu(NO3)2、AgNO3、Ba(NO3)2三种杂质,为使三种物质转化为沉淀分离出来,提供的试剂是Na2CO3溶液、NaCl溶液、NaOH溶液.若要求每次只加一种试剂,滤出一种沉淀,那么所加试剂顺序是①________②________③________ 例题3:为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是( )
A. ①④②⑤③ B. ④①②⑤③
C. ②⑤④①③ D. ⑤②④③①【答案】C 答案:① NaCl溶液 ② NaOH溶液③ Na2CO3溶液例题5:分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是( )
H2O、AgNO3、HNO3 B. H2O、NaOH、HNO3 C. H2O、NaOH、HCl D. H2O、KOH、HNO3 【答案】C例题4:分离下列各组物质的方法不正确的是 ( )
A.用过滤法分离氧化铜和硫酸铜的混合物
B.用结晶法分离氯化钠和硝酸钾的混合物
C.用蒸馏法(依据物质沸点的不同)分离煤油和水的混合物
D.通过灼热的氧化铜除去CO中的CO2,得纯净的CO【答案】D【答案】D练一练:1.实验操作方法:①称量,②过滤,③蒸发,④结晶;其中可用于混合物分离的是 ( )
A. ①② B. ③④ C. ①②③ D.②③④练一练:2.按照加水溶解、过滤、蒸发的顺序进行操作,可以分离的一组混合物是 ( )
A.木炭粉和二氧化锰 B.铁粉和硫酸铜晶体
C.氯化钡和硫酸钾 D.二氧化锰和氯化钠【答案】D练一练:3.现有一包固体混合物,内有CaCl2和NaCl,请设计一个实验方案(试剂任选),将它们分离出来,分别得到纯净的CaCl2固体和NaCl固体。将混合物溶于水,向溶液中滴加适量的Na2CO3溶液后过滤,将得到的滤液进行蒸发结晶即可得到NaCl固体,在沉淀中加入适量的稀盐酸使之转化为CaCl2溶液,再蒸发结晶,即可得到CaCl2固体。现将有关要点归纳如下:1、应注意几个“不”
⑴不能“玉石俱焚”。即试剂一般与杂质反应,不与要保留的物质反应。但特殊情况下,所加试剂需要和保留物质反应,但最终要转化成需要保留的物质。如除去FeCl3溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
⑵“不增”、“不减”。即不增加新的杂质,不减少要保留的物质。
⑶不污染环境。即要求所选用的除杂方法,不能产生可污染环境的物质。
⑷不能“旧貌变新颜”。即除杂结束前,要恢复保留物质的原有状态。
2、除杂方法的几个优化原则
⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
⑶先考虑物理方法,再用化学方法。 拓展延伸 :气体的净化与干燥 1、气体净化的几种方法⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。常见气体吸收剂见下表:⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。如,除去CO2中的少量CO,可将混合气体通过足量的灼热CuO,CO + CuO Cu + CO2。2、气体的干燥气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。⑴常见的干燥剂⑵常用干燥装置如下:浓H2SO4固体NaOH
或生石灰
或无水CaCl2注意:选择吸收装置时,要注意进、出气体导管的连接方法,若用“洗气瓶”,要注意“长进短出”,若用干燥管要注意“大进小出”。先除去气体中含有的其他杂质,干燥除去水蒸气的操作放在最后。练一练:下图所示的装置有多种用途。根据实验需要,气体既可从a导入也可以从b口导入。瓶中既可加入其他物质,也可以加入不同的液体或固体颗粒等。请根据要求将相关内容填入下表,然后结合物理知识回答问题:bab空气或水abaa水或氢氧化钠溶液或硝酸银溶液a浓硫酸a澄清石灰水或
氢氧化钡溶液为除去Na2SO4溶液中含有的杂质Na2CO3,甲、乙、丙三位同学分别选用一种试剂(适量)进行实验。请你对他们所选用的试剂进行评价:答案 :甲:不行,除去Na2CO3的同时又引入了新杂质NaCl。乙: 行,除去Na2CO3的同时增加了Na2SO4,而且没引入新杂质。丙:不行,除去Na2CO3的同时了也除去了Na2SO4,并引入了新杂质NaOH 。 巩固练习:
A.稀硫酸 B.硝酸银 C.澄清石灰水 D.稀盐酸 【答案】 D练一练:1.下列括号中的物质是除去杂质所用的试剂,其中错误的是( )
A.CaO中有少量CaCO3(盐酸) B.H2中有少量HCl(苛性钠溶液)
C.FeSO4溶液中有少量CuSO4(铁粉)
D.CO2中有少量CO(灼热的氧化铜粉末)
【答案】 A练一练:2.除去下列物质中所含杂质(括号内为杂质),所选用试剂及操作方法均正确的一组是【答案】 C结晶点燃氧气灼热的CuO氢氧化钠溶液氢氧化铜固体或氧化铜固体(2)NaOH溶液(Na2CO3)(3)Na2CO3 溶液(NaOH)(1)Na2SO4 溶液(H2SO4)练一练3:除去下列物质种的杂质(括号中的为杂质)
并写出化学方程式。(4)CaCl2 溶液(NaCl)向溶液中滴加适量的NaOH或Na2CO3溶液向溶液中滴加适量的Ca(OH)2或Ba(OH) 2溶液后过滤掉沉淀向溶液中通入适量的CO2向溶液中滴加足量的Na2CO3或K2 CO3溶液后过滤得到沉淀,在沉淀中加入适量的稀盐酸使之转化为CaCl2溶液练一练:硝酸钠溶液中含有Cu(NO3)2、AgNO3、Ba(NO3)2三种杂质,为使三种物质转化为沉淀分离出来,提供的试剂是Na2CO3溶液、NaCl溶液、NaOH溶液.若要求每次只加一种试剂,滤出一种沉淀,那么所加试剂顺序是①________②________③________ 例题3:为了除去粗盐中的CaCl2、MgSO4及泥沙,可将粗盐溶于水,然后进行下列5项操作:①过滤;②加过量的NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量的BaCl2溶液。正确的操作顺序是( )
A. ①④②⑤③ B. ④①②⑤③
C. ②⑤④①③ D. ⑤②④③①【答案】C 答案:① NaCl溶液 ② NaOH溶液③ Na2CO3溶液例题5:分离NaCl、FeCl3和BaSO4的混合物,应选用的一组试剂是( )
H2O、AgNO3、HNO3 B. H2O、NaOH、HNO3 C. H2O、NaOH、HCl D. H2O、KOH、HNO3 【答案】C例题4:分离下列各组物质的方法不正确的是 ( )
A.用过滤法分离氧化铜和硫酸铜的混合物
B.用结晶法分离氯化钠和硝酸钾的混合物
C.用蒸馏法(依据物质沸点的不同)分离煤油和水的混合物
D.通过灼热的氧化铜除去CO中的CO2,得纯净的CO【答案】D【答案】D练一练:1.实验操作方法:①称量,②过滤,③蒸发,④结晶;其中可用于混合物分离的是 ( )
A. ①② B. ③④ C. ①②③ D.②③④练一练:2.按照加水溶解、过滤、蒸发的顺序进行操作,可以分离的一组混合物是 ( )
A.木炭粉和二氧化锰 B.铁粉和硫酸铜晶体
C.氯化钡和硫酸钾 D.二氧化锰和氯化钠【答案】D练一练:3.现有一包固体混合物,内有CaCl2和NaCl,请设计一个实验方案(试剂任选),将它们分离出来,分别得到纯净的CaCl2固体和NaCl固体。将混合物溶于水,向溶液中滴加适量的Na2CO3溶液后过滤,将得到的滤液进行蒸发结晶即可得到NaCl固体,在沉淀中加入适量的稀盐酸使之转化为CaCl2溶液,再蒸发结晶,即可得到CaCl2固体。现将有关要点归纳如下:1、应注意几个“不”
⑴不能“玉石俱焚”。即试剂一般与杂质反应,不与要保留的物质反应。但特殊情况下,所加试剂需要和保留物质反应,但最终要转化成需要保留的物质。如除去FeCl3溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
⑵“不增”、“不减”。即不增加新的杂质,不减少要保留的物质。
⑶不污染环境。即要求所选用的除杂方法,不能产生可污染环境的物质。
⑷不能“旧貌变新颜”。即除杂结束前,要恢复保留物质的原有状态。
2、除杂方法的几个优化原则
⑴若同时有多种方法能除去杂质,要选择那些简单易行、除杂彻底的方法。
⑵应尽量选择既可除去杂质,又可增加保留物质的方法,即“一举两得”。
⑶先考虑物理方法,再用化学方法。 拓展延伸 :气体的净化与干燥 1、气体净化的几种方法⑴吸收法:用吸收剂将杂质气体吸收除去。如,除去CO中混有的少量CO2,可先用浓NaOH溶液吸收CO2,再用浓硫酸等干燥剂除去水蒸气。常见气体吸收剂见下表:⑵转化法:通过化学反应,将杂质气体转化为所要得到的气体。如,除去CO2中的少量CO,可将混合气体通过足量的灼热CuO,CO + CuO Cu + CO2。2、气体的干燥气体的干燥是通过干燥剂来实现的,选择干燥要根据气体的性质,一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂状态决定。⑴常见的干燥剂⑵常用干燥装置如下:浓H2SO4固体NaOH
或生石灰
或无水CaCl2注意:选择吸收装置时,要注意进、出气体导管的连接方法,若用“洗气瓶”,要注意“长进短出”,若用干燥管要注意“大进小出”。先除去气体中含有的其他杂质,干燥除去水蒸气的操作放在最后。练一练:下图所示的装置有多种用途。根据实验需要,气体既可从a导入也可以从b口导入。瓶中既可加入其他物质,也可以加入不同的液体或固体颗粒等。请根据要求将相关内容填入下表,然后结合物理知识回答问题:bab空气或水abaa水或氢氧化钠溶液或硝酸银溶液a浓硫酸a澄清石灰水或
氢氧化钡溶液为除去Na2SO4溶液中含有的杂质Na2CO3,甲、乙、丙三位同学分别选用一种试剂(适量)进行实验。请你对他们所选用的试剂进行评价:答案 :甲:不行,除去Na2CO3的同时又引入了新杂质NaCl。乙: 行,除去Na2CO3的同时增加了Na2SO4,而且没引入新杂质。丙:不行,除去Na2CO3的同时了也除去了Na2SO4,并引入了新杂质NaOH 。 巩固练习:
