7.3.1 溶质质量分数及其简单计算 教案
文档属性
| 名称 | 7.3.1 溶质质量分数及其简单计算 教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 197.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-26 14:33:36 | ||
图片预览

文档简介
7.3.1
溶质质量分数及其简单计算
教案
课题分析
本课题分三部分内容。第一部分从配制三种组成不同的CuS04溶液实验入手,导出一种表示溶液组成的方法──溶质的质量分数。
第二部分在溶质的质量分数基础上,利用质量分数解决一些实际问题:①溶液的稀释与配制;②溶质的质量分
数与化学方程式的综合计算。
第三部分溶解度与溶质质量分数的关系。
第1课时
溶质质量分数
课标要求
【教学目标】
1.知识与技能
(1)掌握一种溶液组成的表示方法──溶质的质量分数,并能进行溶质质量分数的简单计算。
(2)正确理解溶解度与溶质质量分数的关系。
2.过程与方法
(1)掌握分析问题,解决问题的方法。
(2)能找准各量的关系。
3.情感态度与价值观
(1)发展严谨求实的科学精神。
(2)培养具体问题具体分析的意识。
【教学重点】
溶质的质量分数的有关计算。
【教学难点】
1.溶质的质量分数的有关计算。
2.溶质的质量分数与溶解度的关系。
【教具准备】
试管(若干)、水、无水硫酸铜固体、烧杯、药匙、玻璃棒、量筒、食盐、鸡蛋、多媒体课件等。
教学过程
【导入新课】
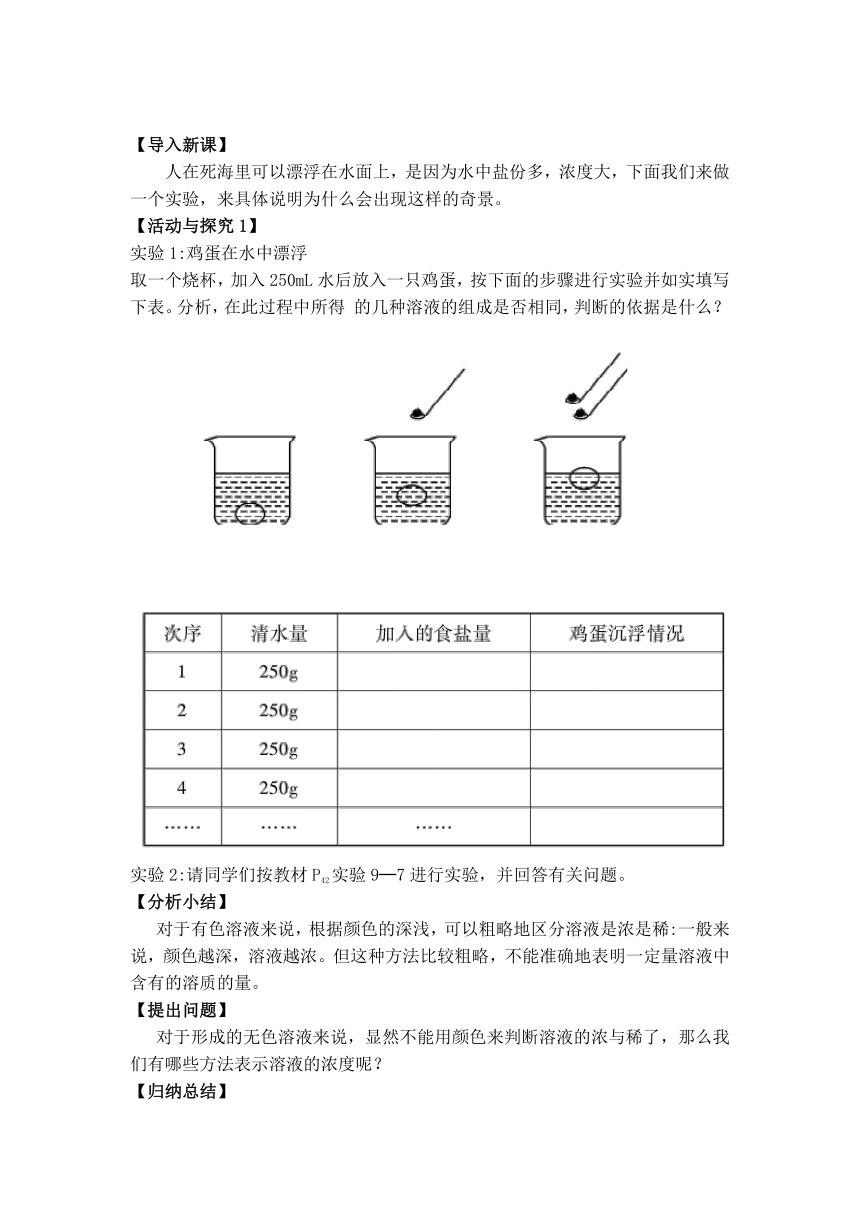
人在死海里可以漂浮在水面上,是因为水中盐份多,浓度大,下面我们来做一个实验,来具体说明为什么会出现这样的奇景。
【活动与探究1】
实验1:鸡蛋在水中漂浮
取一个烧杯,加入250mL水后放入一只鸡蛋,按下面的步骤进行实验并如实填写下表。分析,在此过程中所得
的几种溶液的组成是否相同,判断的依据是什么?
实验2:请同学们按教材P42实验9─7进行实验,并回答有关问题。
【分析小结】
对于有色溶液来说,根据颜色的深浅,可以粗略地区分溶液是浓是稀:一般来说,颜色越深,溶液越浓。但这种方法比较粗略,不能准确地表明一定量溶液中含有的溶质的量。
【提出问题】
对于形成的无色溶液来说,显然不能用颜色来判断溶液的浓与稀了,那么我们有哪些方法表示溶液的浓度呢?
【归纳总结】
表示溶液的组成方法很多,这里主要介绍溶质的质量分数。
【提出问题】
请同学们完成教材P43练一练。
【学生活动】
按所学的计算,完成表格并进行讨论。
【活动与探究2】
请同学们按教材P43实验9-8进行实验,并填好表格中的空栏。
【过渡】
在上面的活动中我们学会了溶质的质量分数的计算及配制一定质量分数的溶液,那么我们能否利用质量分数解决实际中的一些问题呢?
【课件展示】
例1
展示敎材P43例1
【分析】
溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量-溶质的质量
【答案】溶质的质量=150kg×16%
=
24kg
溶剂的质量=150kg
-
24kg
=
126kg
答:配制150kg质量分数为16%的氯化钠溶液,需24kg氯化钠和126kg水。
【分析小结】
上述计算要归纳为:已知溶液的质量和溶质的质量分数,求溶质和溶剂的质量。
【课件展示】
例2
已知20°C时氯化钠的溶解度为36.
0g,在该温度下把40g氯化钠放入100g水中,充分搅拌,则所得溶液中
溶质的质量分数约为多少?
【分析】由溶解度的定义可知,20°C时100g水最多溶解36.
0g氯化钠,则所加40g的氯化钠不能全部溶解
答:所得溶液中溶质的质量分数约为26.
5%。
【提出问题】
在实际生产生活中,往往要将溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
【交流回答】
1.增加溶质的质量,可使溶质的质量分数增大。
2.增大溶剂的质量,可使溶质的质量分数减小。
3.蒸发溶剂可使溶质的质量分数增大。
【课件展示】
例3
展示敎材P44例2
【分析】抓住关键,溶液稀释前后溶质的质量不变。
【答案】解:设稀释后溶液的质量为x
需要水的质量=25g
-50g
=
195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸,需要195g的水。
【课堂小结】
本节课我们学习了溶液组成的表示方法──溶质的质量分数,并进行了两种简单计算。以及溶液稀释混合的计算。
【布置作业】
完成本课时对应练习,并提醒学生预习下一节的内容。
板书设计
课题3
溶液的浓度
第1课时
溶质质量分数
一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.公式:溶质的质量分数=溶液的质量×l00%
二、溶质的质量分数的计算
1.已知溶质、溶剂的质量,求溶质的质量分数。
2.已知溶液的质量分数和溶液的质量,求溶质、溶剂的质量。
三、溶液稀释混合的计算
教学反思
教师从配制三种组成不同的硫酸铜溶液的实验入手,引导学生观察和思考,并根据溶液的颜色深浅区分有色溶液是浓还是稀,在这个基础上来阐明溶液组成的含义,学生容易接受。溶液稀释和配制问题的计算比较复杂,教师要引导学生从另一角度去思考这类问题,要让学生理解,加水稀释和配制溶液时,溶质的质量总是不变的,要教会学生建立等式关系来解决这类问题。教师在进行实验时,要充分发挥学生的主体作用,让学生的思维能力、创新能力得到磨练、升华。
溶质质量分数及其简单计算
教案
课题分析
本课题分三部分内容。第一部分从配制三种组成不同的CuS04溶液实验入手,导出一种表示溶液组成的方法──溶质的质量分数。
第二部分在溶质的质量分数基础上,利用质量分数解决一些实际问题:①溶液的稀释与配制;②溶质的质量分
数与化学方程式的综合计算。
第三部分溶解度与溶质质量分数的关系。
第1课时
溶质质量分数
课标要求
【教学目标】
1.知识与技能
(1)掌握一种溶液组成的表示方法──溶质的质量分数,并能进行溶质质量分数的简单计算。
(2)正确理解溶解度与溶质质量分数的关系。
2.过程与方法
(1)掌握分析问题,解决问题的方法。
(2)能找准各量的关系。
3.情感态度与价值观
(1)发展严谨求实的科学精神。
(2)培养具体问题具体分析的意识。
【教学重点】
溶质的质量分数的有关计算。
【教学难点】
1.溶质的质量分数的有关计算。
2.溶质的质量分数与溶解度的关系。
【教具准备】
试管(若干)、水、无水硫酸铜固体、烧杯、药匙、玻璃棒、量筒、食盐、鸡蛋、多媒体课件等。
教学过程
【导入新课】
人在死海里可以漂浮在水面上,是因为水中盐份多,浓度大,下面我们来做一个实验,来具体说明为什么会出现这样的奇景。
【活动与探究1】
实验1:鸡蛋在水中漂浮
取一个烧杯,加入250mL水后放入一只鸡蛋,按下面的步骤进行实验并如实填写下表。分析,在此过程中所得
的几种溶液的组成是否相同,判断的依据是什么?
实验2:请同学们按教材P42实验9─7进行实验,并回答有关问题。
【分析小结】
对于有色溶液来说,根据颜色的深浅,可以粗略地区分溶液是浓是稀:一般来说,颜色越深,溶液越浓。但这种方法比较粗略,不能准确地表明一定量溶液中含有的溶质的量。
【提出问题】
对于形成的无色溶液来说,显然不能用颜色来判断溶液的浓与稀了,那么我们有哪些方法表示溶液的浓度呢?
【归纳总结】
表示溶液的组成方法很多,这里主要介绍溶质的质量分数。
【提出问题】
请同学们完成教材P43练一练。
【学生活动】
按所学的计算,完成表格并进行讨论。
【活动与探究2】
请同学们按教材P43实验9-8进行实验,并填好表格中的空栏。
【过渡】
在上面的活动中我们学会了溶质的质量分数的计算及配制一定质量分数的溶液,那么我们能否利用质量分数解决实际中的一些问题呢?
【课件展示】
例1
展示敎材P43例1
【分析】
溶质的质量=溶液的质量×溶质的质量分数
溶剂的质量=溶液的质量-溶质的质量
【答案】溶质的质量=150kg×16%
=
24kg
溶剂的质量=150kg
-
24kg
=
126kg
答:配制150kg质量分数为16%的氯化钠溶液,需24kg氯化钠和126kg水。
【分析小结】
上述计算要归纳为:已知溶液的质量和溶质的质量分数,求溶质和溶剂的质量。
【课件展示】
例2
已知20°C时氯化钠的溶解度为36.
0g,在该温度下把40g氯化钠放入100g水中,充分搅拌,则所得溶液中
溶质的质量分数约为多少?
【分析】由溶解度的定义可知,20°C时100g水最多溶解36.
0g氯化钠,则所加40g的氯化钠不能全部溶解
答:所得溶液中溶质的质量分数约为26.
5%。
【提出问题】
在实际生产生活中,往往要将溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
【交流回答】
1.增加溶质的质量,可使溶质的质量分数增大。
2.增大溶剂的质量,可使溶质的质量分数减小。
3.蒸发溶剂可使溶质的质量分数增大。
【课件展示】
例3
展示敎材P44例2
【分析】抓住关键,溶液稀释前后溶质的质量不变。
【答案】解:设稀释后溶液的质量为x
需要水的质量=25g
-50g
=
195g
答:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸,需要195g的水。
【课堂小结】
本节课我们学习了溶液组成的表示方法──溶质的质量分数,并进行了两种简单计算。以及溶液稀释混合的计算。
【布置作业】
完成本课时对应练习,并提醒学生预习下一节的内容。
板书设计
课题3
溶液的浓度
第1课时
溶质质量分数
一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.公式:溶质的质量分数=溶液的质量×l00%
二、溶质的质量分数的计算
1.已知溶质、溶剂的质量,求溶质的质量分数。
2.已知溶液的质量分数和溶液的质量,求溶质、溶剂的质量。
三、溶液稀释混合的计算
教学反思
教师从配制三种组成不同的硫酸铜溶液的实验入手,引导学生观察和思考,并根据溶液的颜色深浅区分有色溶液是浓还是稀,在这个基础上来阐明溶液组成的含义,学生容易接受。溶液稀释和配制问题的计算比较复杂,教师要引导学生从另一角度去思考这类问题,要让学生理解,加水稀释和配制溶液时,溶质的质量总是不变的,要教会学生建立等式关系来解决这类问题。教师在进行实验时,要充分发挥学生的主体作用,让学生的思维能力、创新能力得到磨练、升华。
