高二化学人教版选修6第一单元 课题一 实验化学起步 第2课时 练习题(含解析)
文档属性
| 名称 | 高二化学人教版选修6第一单元 课题一 实验化学起步 第2课时 练习题(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-26 16:57:12 | ||
图片预览


文档简介
自我小测
1.下列实验操作中,仪器需插入液面以下的有( )。
①制备Fe(OH)2,用滴管将NaOH溶液滴入FeSO4溶液中 ②制备氢气的简易装置中的长颈漏斗 ③分馏石油时控制温度所用的温度计 ④用乙醇制备乙烯时所用的温度计 ⑤用水吸收氨气时的导气管 ⑥向试管中的BaCl2溶液中滴加稀硫酸 ⑦测定乙醇溶液沸点的温度计。
A.③⑤⑥⑦
B.②⑤⑦
C.①②④
D.①②③④⑤⑥
2.下列说法正确的是( )。
A.催化剂只能加快化学反应速率
B.光是影响某些化学反应速率的外界条件之一
C.决定化学反应速率的主要因素是浓度
D.不管什么反应,增大浓度,或加热,或加压,都可以加快反应速率
3.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )。
组别
c(HCl)/(mol·L-1)
温度/℃
状态
1
2.0
25
块状
2
2.5
30
块状
3
2.5
50
块状
4
2.5
30
粉末状
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
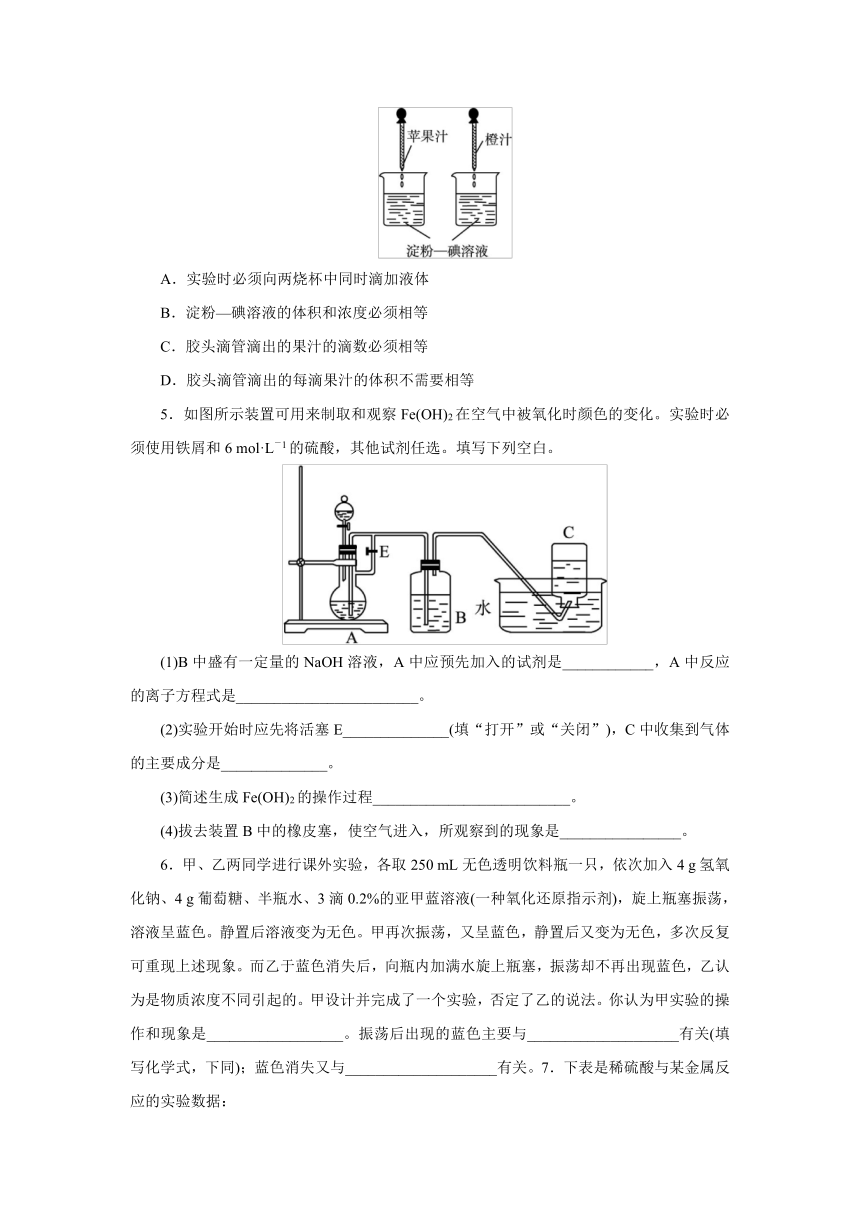
4.利用维生素C能使淀粉—碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C浓度的大小。要得出正确结论,在实验时需要控制的条件是( )。
A.实验时必须向两烧杯中同时滴加液体
B.淀粉—碘溶液的体积和浓度必须相等
C.胶头滴管滴出的果汁的滴数必须相等
D.胶头滴管滴出的每滴果汁的体积不需要相等
5.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6
mol·L-1的硫酸,其他试剂任选。填写下列空白。
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是________________________。
(2)实验开始时应先将活塞E______________(填“打开”或“关闭”),C中收集到气体的主要成分是______________。
(3)简述生成Fe(OH)2的操作过程__________________________。
(4)拔去装置B中的橡皮塞,使空气进入,所观察到的现象是________________。
6.甲、乙两同学进行课外实验,各取250
mL无色透明饮料瓶一只,依次加入4
g氢氧化钠、4
g葡萄糖、半瓶水、3滴0.2%的亚甲蓝溶液(一种氧化还原指示剂),旋上瓶塞振荡,溶液呈蓝色。静置后溶液变为无色。甲再次振荡,又呈蓝色,静置后又变为无色,多次反复可重现上述现象。而乙于蓝色消失后,向瓶内加满水旋上瓶塞,振荡却不再出现蓝色,乙认为是物质浓度不同引起的。甲设计并完成了一个实验,否定了乙的说法。你认为甲实验的操作和现象是__________________。振荡后出现的蓝色主要与____________________有关(填写化学式,下同);蓝色消失又与____________________有关。7.下表是稀硫酸与某金属反应的实验数据:
实验序号
金属质量/g
金属状态
溶液温度/℃
金属消失的时间/s
反应前
反应后
1
0.10
丝
0.5
50
20
34
500
2
0.10
粉末
0.5
50
20
35
50
21世纪教育网3
0.10
丝
0.7
50
20
36
250
4
0.10
丝
0.8
50
20
35
200
5
0.10
粉末
0.8
50
20
36
25
6
0.10
丝
1.0
50
20
35
125
7
0.10
丝
1.0
50
35
50
50
8
0.10
丝
1.1
50
20
34
100
9
0.10
丝
1.1
50
30
44
40
分析上述数据,回答下列问题:(1)实验4和5表明,________________对反应速率有影响。其结论为________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有______,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15
℃)相近,推测其原因:________________________________________________________________________。
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:(1)上述实验中发生反应的化学方程式有__________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO44种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有__________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________________________________________________。
参考答案
1.答案:C 解析:①将滴管插入液面以下是为了避免引入氧气;②长颈漏斗下口伸入液面以下是为了形成液封;③分馏石油检测的是蒸气的温度,故温度计的水银球在蒸馏烧瓶的支管口处;④用乙醇制备乙烯时要控制的是反应液的温度,故温度计插到液面以下;⑤氨气极易溶于水,故用水吸收氨气时的导气管不可插入液面以下(以免倒吸);⑥向试管中的BaCl2溶液中滴加稀硫酸,滴管不能伸入试管口内;⑦测沸点时,温度计的水银球在蒸馏烧瓶的支管口处。
2.答案:B 解析:催化剂有正负之分,正催化剂能够加快化学反应速率,负催化剂能够减慢化学反应速率,故A错;光能影响某些反应,例如氯水、浓硝酸及硝酸银的分解,故B正确;决定化学反应速率的主要因素是参加反应物质的性质,所以C错;加压只能加快有气体参加的化学反应的速率,所以D错。
3.答案:AC 解析:化学反应速率与温度、浓度和固体物质的表面积的大小有关。实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较化学反应速率的快慢。
4.
答案:B 解析:做对比实验需要使条件相同。根据题目要求,通过比较加入两种果汁的多少确定维生素C浓度,故应该使淀粉—碘溶液物质的量相同,每滴果汁的体积相等,而不是滴数相等,滴加液体的时间不一定相同。
5.答案:(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开 H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应
(4)白色沉淀很快变为灰绿色,最终变为红褐色
解析:实验开始时先打开活塞E,让H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的白色。H2充满B装置后关闭活塞E,A中的FeSO4溶液沿竖直长导管进入B装置,与NaOH反应。6.答案:将乙瓶中溶液倒掉一半(一部分)后振荡即可出现蓝色(或向乙瓶中通入氧气或空气,即可出现蓝色) O2 C6H12O6
解析:甲既然否定了乙的说法(物质浓度不同引起,即水量多少),再分析甲同学实验中饮料瓶未充满(有空气)而乙同学实验中饮料瓶充满(无空气),从而找到解决问题的关键:将乙瓶中溶液倒掉一半(一部分)后,振荡即可出现蓝色。也可向乙瓶中通入氧气或空气,即可出现蓝色。
7.答案:(1)固体反应物的表面积 表面积越大 1和2
(2)1、3、4、6、8(或2、5)
(3)反应温度 6和7(或8、9)
(4)因为所有反应中,金属质量和硫酸体积均相同,且硫酸过量,产生热量相等,所以溶液温度变化值相近
解析:比较表中实验1和2、实验4和5,其他条件相同,只是金属状态由丝变成了粉末,金属消失的时间变短,反应速率变快,说明金属固体的表面积越大,反应速率越快。同理,对表中各项数据进行对比分析不难得出其他问题的正确答案。
8.答案:(1)Zn+CuSO4===ZnSO4+Cu、Zn+H2SO4===ZnSO4+H2↑
(2)CuSO4与Zn反应产生的Cu、与Zn形成铜锌微电池,加快了氢气产生的速率
(3)Ag2SO4
(4)升高反应温度,适当增加硫酸的浓度(或增加锌粒的比表面积等)
(5)①30 10 17.5 ②灰黑 暗红 ③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积解析:本题考查了原电池原理的应用、影响化学反应速率的因素,意在考查学生的应用能力及化学实验设计探究能力。稀硫酸与锌的反应过程中加入少量硫酸铜,是利用锌置换出铜,构成Cu-Zn-H2SO4原电池,加快锌的反应速率,Ag2SO4也可以达到同样效果。由于是研究CuSO4的量对氢气生成速率的影响,所以硫酸的浓度要相同,一是所加硫酸的量相同,二是混合溶液的体积相同,所以V1~V5均为30,由F组数据可知,CuSO4溶液的体积加水的体积为20
mL。A组中无铜生成,反应后锌呈灰黑色,E组中生成较多的铜,呈暗红色。有较多的铜生成时,其覆盖在锌表面,降低了锌与溶液的接触面积。
1.下列实验操作中,仪器需插入液面以下的有( )。
①制备Fe(OH)2,用滴管将NaOH溶液滴入FeSO4溶液中 ②制备氢气的简易装置中的长颈漏斗 ③分馏石油时控制温度所用的温度计 ④用乙醇制备乙烯时所用的温度计 ⑤用水吸收氨气时的导气管 ⑥向试管中的BaCl2溶液中滴加稀硫酸 ⑦测定乙醇溶液沸点的温度计。
A.③⑤⑥⑦
B.②⑤⑦
C.①②④
D.①②③④⑤⑥
2.下列说法正确的是( )。
A.催化剂只能加快化学反应速率
B.光是影响某些化学反应速率的外界条件之一
C.决定化学反应速率的主要因素是浓度
D.不管什么反应,增大浓度,或加热,或加压,都可以加快反应速率
3.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生气体体积(V)的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )。
组别
c(HCl)/(mol·L-1)
温度/℃
状态
1
2.0
25
块状
2
2.5
30
块状
3
2.5
50
块状
4
2.5
30
粉末状
A.4-3-2-1
B.1-2-3-4
C.3-4-2-1
D.1-2-4-3
4.利用维生素C能使淀粉—碘溶液褪色的性质,通过实验(如图所示)比较加入苹果汁和橙汁的多少来确定它们中维生素C浓度的大小。要得出正确结论,在实验时需要控制的条件是( )。
A.实验时必须向两烧杯中同时滴加液体
B.淀粉—碘溶液的体积和浓度必须相等
C.胶头滴管滴出的果汁的滴数必须相等
D.胶头滴管滴出的每滴果汁的体积不需要相等
5.如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6
mol·L-1的硫酸,其他试剂任选。填写下列空白。
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是________________________。
(2)实验开始时应先将活塞E______________(填“打开”或“关闭”),C中收集到气体的主要成分是______________。
(3)简述生成Fe(OH)2的操作过程__________________________。
(4)拔去装置B中的橡皮塞,使空气进入,所观察到的现象是________________。
6.甲、乙两同学进行课外实验,各取250
mL无色透明饮料瓶一只,依次加入4
g氢氧化钠、4
g葡萄糖、半瓶水、3滴0.2%的亚甲蓝溶液(一种氧化还原指示剂),旋上瓶塞振荡,溶液呈蓝色。静置后溶液变为无色。甲再次振荡,又呈蓝色,静置后又变为无色,多次反复可重现上述现象。而乙于蓝色消失后,向瓶内加满水旋上瓶塞,振荡却不再出现蓝色,乙认为是物质浓度不同引起的。甲设计并完成了一个实验,否定了乙的说法。你认为甲实验的操作和现象是__________________。振荡后出现的蓝色主要与____________________有关(填写化学式,下同);蓝色消失又与____________________有关。7.下表是稀硫酸与某金属反应的实验数据:
实验序号
金属质量/g
金属状态
溶液温度/℃
金属消失的时间/s
反应前
反应后
1
0.10
丝
0.5
50
20
34
500
2
0.10
粉末
0.5
50
20
35
50
21世纪教育网3
0.10
丝
0.7
50
20
36
250
4
0.10
丝
0.8
50
20
35
200
5
0.10
粉末
0.8
50
20
36
25
6
0.10
丝
1.0
50
20
35
125
7
0.10
丝
1.0
50
35
50
50
8
0.10
丝
1.1
50
20
34
100
9
0.10
丝
1.1
50
30
44
40
分析上述数据,回答下列问题:(1)实验4和5表明,________________对反应速率有影响。其结论为________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有______,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15
℃)相近,推测其原因:________________________________________________________________________。
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:(1)上述实验中发生反应的化学方程式有__________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是______________________________;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO44种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有__________________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=______,V6=______,V9=______;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_______________________________________________________________。
参考答案
1.答案:C 解析:①将滴管插入液面以下是为了避免引入氧气;②长颈漏斗下口伸入液面以下是为了形成液封;③分馏石油检测的是蒸气的温度,故温度计的水银球在蒸馏烧瓶的支管口处;④用乙醇制备乙烯时要控制的是反应液的温度,故温度计插到液面以下;⑤氨气极易溶于水,故用水吸收氨气时的导气管不可插入液面以下(以免倒吸);⑥向试管中的BaCl2溶液中滴加稀硫酸,滴管不能伸入试管口内;⑦测沸点时,温度计的水银球在蒸馏烧瓶的支管口处。
2.答案:B 解析:催化剂有正负之分,正催化剂能够加快化学反应速率,负催化剂能够减慢化学反应速率,故A错;光能影响某些反应,例如氯水、浓硝酸及硝酸银的分解,故B正确;决定化学反应速率的主要因素是参加反应物质的性质,所以C错;加压只能加快有气体参加的化学反应的速率,所以D错。
3.答案:AC 解析:化学反应速率与温度、浓度和固体物质的表面积的大小有关。实验1的盐酸的浓度最小,反应的温度最低,所以化学反应速率最慢;由于实验3的反应温度比实验2的反应温度高,所以反应速率实验3大于实验2;而实验4和实验3虽然浓度相同,但反应的温度不同,物质的状态也不相同,所以不能比较化学反应速率的快慢。
4.
答案:B 解析:做对比实验需要使条件相同。根据题目要求,通过比较加入两种果汁的多少确定维生素C浓度,故应该使淀粉—碘溶液物质的量相同,每滴果汁的体积相等,而不是滴数相等,滴加液体的时间不一定相同。
5.答案:(1)铁屑 Fe+2H+===Fe2++H2↑
(2)打开 H2
(3)关闭活塞E,使FeSO4溶液压入B瓶中进行反应
(4)白色沉淀很快变为灰绿色,最终变为红褐色
解析:实验开始时先打开活塞E,让H2把A、B装置中的空气排出,让Fe(OH)2在H2气氛中生成,以便较长时间观察Fe(OH)2的白色。H2充满B装置后关闭活塞E,A中的FeSO4溶液沿竖直长导管进入B装置,与NaOH反应。6.答案:将乙瓶中溶液倒掉一半(一部分)后振荡即可出现蓝色(或向乙瓶中通入氧气或空气,即可出现蓝色) O2 C6H12O6
解析:甲既然否定了乙的说法(物质浓度不同引起,即水量多少),再分析甲同学实验中饮料瓶未充满(有空气)而乙同学实验中饮料瓶充满(无空气),从而找到解决问题的关键:将乙瓶中溶液倒掉一半(一部分)后,振荡即可出现蓝色。也可向乙瓶中通入氧气或空气,即可出现蓝色。
7.答案:(1)固体反应物的表面积 表面积越大 1和2
(2)1、3、4、6、8(或2、5)
(3)反应温度 6和7(或8、9)
(4)因为所有反应中,金属质量和硫酸体积均相同,且硫酸过量,产生热量相等,所以溶液温度变化值相近
解析:比较表中实验1和2、实验4和5,其他条件相同,只是金属状态由丝变成了粉末,金属消失的时间变短,反应速率变快,说明金属固体的表面积越大,反应速率越快。同理,对表中各项数据进行对比分析不难得出其他问题的正确答案。
8.答案:(1)Zn+CuSO4===ZnSO4+Cu、Zn+H2SO4===ZnSO4+H2↑
(2)CuSO4与Zn反应产生的Cu、与Zn形成铜锌微电池,加快了氢气产生的速率
(3)Ag2SO4
(4)升高反应温度,适当增加硫酸的浓度(或增加锌粒的比表面积等)
(5)①30 10 17.5 ②灰黑 暗红 ③当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与溶液的接触面积解析:本题考查了原电池原理的应用、影响化学反应速率的因素,意在考查学生的应用能力及化学实验设计探究能力。稀硫酸与锌的反应过程中加入少量硫酸铜,是利用锌置换出铜,构成Cu-Zn-H2SO4原电池,加快锌的反应速率,Ag2SO4也可以达到同样效果。由于是研究CuSO4的量对氢气生成速率的影响,所以硫酸的浓度要相同,一是所加硫酸的量相同,二是混合溶液的体积相同,所以V1~V5均为30,由F组数据可知,CuSO4溶液的体积加水的体积为20
mL。A组中无铜生成,反应后锌呈灰黑色,E组中生成较多的铜,呈暗红色。有较多的铜生成时,其覆盖在锌表面,降低了锌与溶液的接触面积。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
