高二化学人教版选修6第一单元 课题二 化学实验的绿色追求 第2课时1课后练习题(含解析)
文档属性
| 名称 | 高二化学人教版选修6第一单元 课题二 化学实验的绿色追求 第2课时1课后练习题(含解析) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-26 19:55:45 | ||
图片预览

文档简介
自我小测
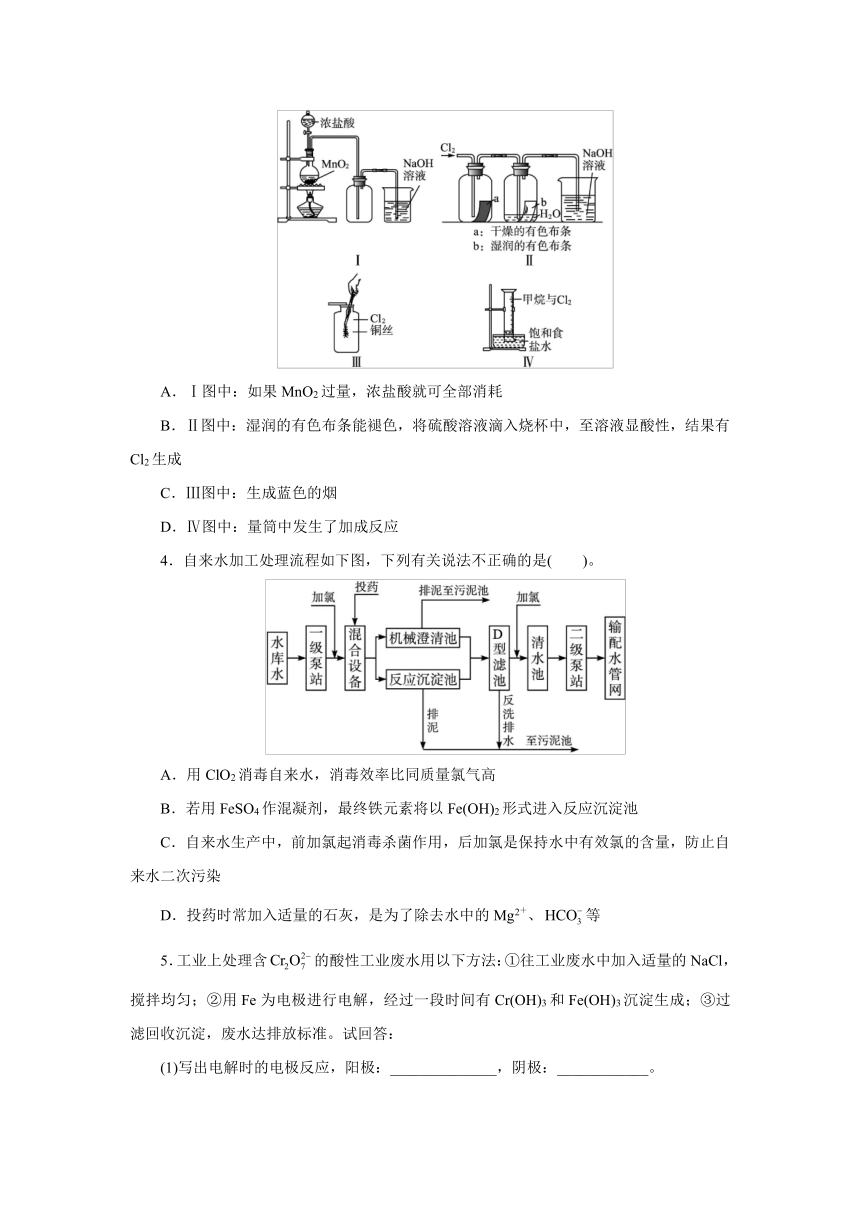
1.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉花球,反应一段时间后,对下图中指定部位颜色描述正确的是( )。
①
②
③
④
A
黄绿色
棕黄色
蓝色
白色
B
无色
棕黄色
紫色
白色
C
黄绿色
棕黄色
蓝色
无色
D
黄绿色
无色
紫色
白色
21世纪教育网2.工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法类别都正确的是( )。
选项
污染物
处理措施
方法类别
A
废酸
加生石灰中和
物理法
B
Cu2+等重金属离子
加硫酸盐沉降
化学法
C
含苯废水
用活性炭吸附
物理法
D
含纯碱的废水
加石灰水反应
化学法
3.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )。
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:量筒中发生了加成反应
4.自来水加工处理流程如下图,下列有关说法不正确的是( )。
A.用ClO2消毒自来水,消毒效率比同质量氯气高
B.若用FeSO4作混凝剂,最终铁元素将以Fe(OH)2形式进入反应沉淀池
C.自来水生产中,前加氯起消毒杀菌作用,后加氯是保持水中有效氯的含量,防止自来水二次污染
D.投药时常加入适量的石灰,是为了除去水中的Mg2+、等
5.工业上处理含的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;③过滤回收沉淀,废水达排放标准。试回答:
(1)写出电解时的电极反应,阳极:______________,阴极:____________。
(2)写出转变成Cr3+的离子反应方程式________________________________。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
(4)能否将铁电极改成石墨电极?为什么?
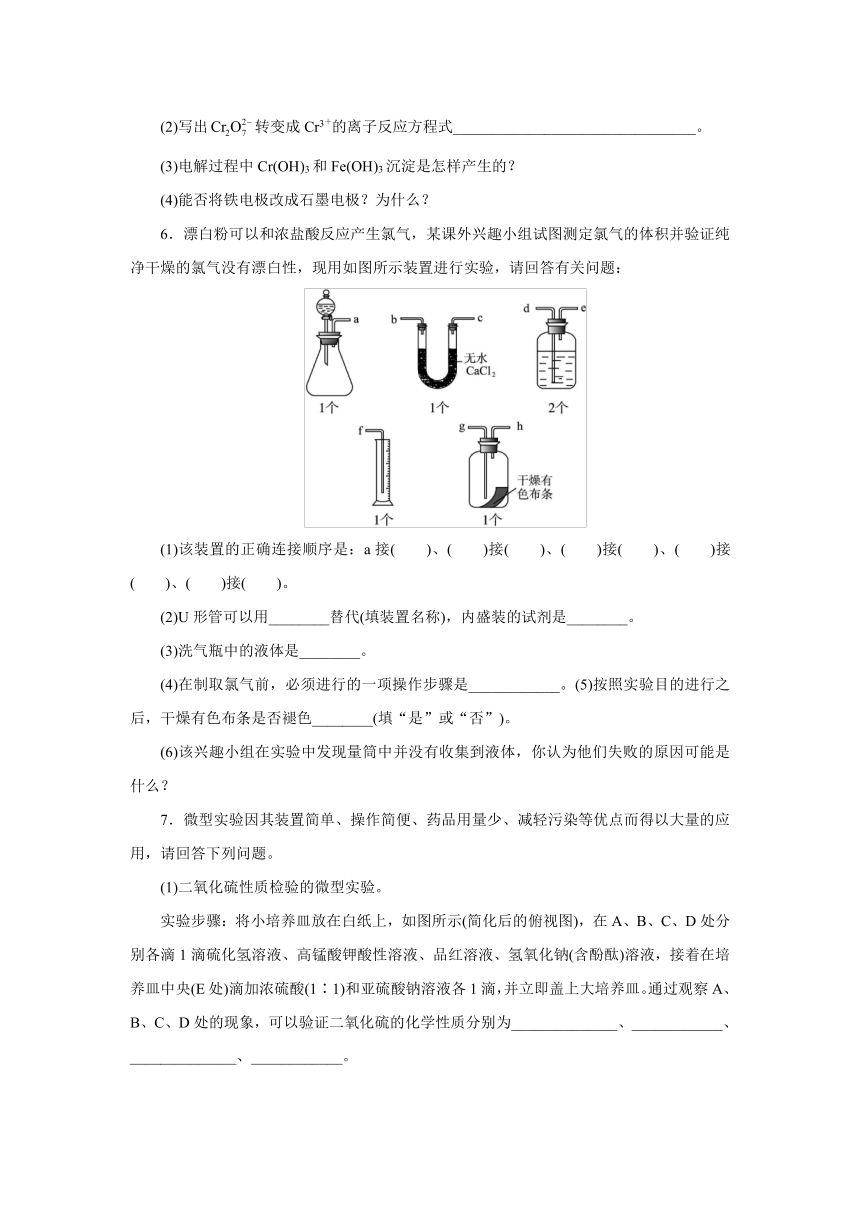
6.漂白粉可以和浓盐酸反应产生氯气,某课外兴趣小组试图测定氯气的体积并验证纯净干燥的氯气没有漂白性,现用如图所示装置进行实验,请回答有关问题:
(1)该装置的正确连接顺序是:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)U形管可以用________替代(填装置名称),内盛装的试剂是________。
(3)洗气瓶中的液体是________。
(4)在制取氯气前,必须进行的一项操作步骤是____________。(5)按照实验目的进行之后,干燥有色布条是否褪色________(填“是”或“否”)。
(6)该兴趣小组在实验中发现量筒中并没有收集到液体,你认为他们失败的原因可能是什么?
7.微型实验因其装置简单、操作简便、药品用量少、减轻污染等优点而得以大量的应用,请回答下列问题。
(1)二氧化硫性质检验的微型实验。
实验步骤:将小培养皿放在白纸上,如图所示(简化后的俯视图),在A、B、C、D处分别各滴1滴硫化氢溶液、高锰酸钾酸性溶液、品红溶液、氢氧化钠(含酚酞)溶液,接着在培养皿中央(E处)滴加浓硫酸(1∶1)和亚硫酸钠溶液各1滴,并立即盖上大培养皿。通过观察A、B、C、D处的现象,可以验证二氧化硫的化学性质分别为______________、____________、______________、____________。
(2)下图为氢气还原氧化铜的微型快速实验装置。
实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的燃烧匙,可上下拉动控制反应;将铜丝2一端弯曲成螺旋状(见图)。
请回答下列问题:
①在Ⅰ中生成的氢气速率比较快的原因是__________________________;
②操作铜丝2的方法是:检验产生氢气的纯度后,将铜丝2加热至红热后伸入Ⅱ中。
问题一:如何检验氢气的纯度__________________________。
问题二:Ⅱ中的反应方程式为__________________________。
参考答案1.答案:A 解析:氯气:黄绿色,氯水:黄绿色,液溴:深棕红色,溴水:棕黄色,碘:紫色,碘水:黄色,碘的淀粉溶液:蓝色。Cl2通入NaOH溶液中生成NaCl、NaClO呈无色,但由于棉花球呈白色,故Cl2被蘸有NaOH溶液的棉花球吸收后棉花球仍显白色,选A。
2.答案:C 解析:本题考查运用化学知识处理污染物的常用方法。用生石灰中和废酸,是化学方法,A错。CuSO4不是沉淀,故处理措施错误,B错。活性炭能吸附某些有气味的气体和有色、有毒物质,是物理方法,C正确。Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,溶液碱性更强,污染更严重,D错。
3.
答案:B 解析:本题考查氯气的制备及性质。稀盐酸不与二氧化锰反应,所以当二氧化锰过量时,浓盐酸变稀后不再继续反应,最后剩余盐酸,A错;氯气溶于水生成次氯酸具有漂白性,使有色布条褪色,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,加入酸后氯离子与次氯酸根离子发生反应生成氯气,B对;铜在氯气中燃烧生成棕色的烟,C错;甲烷与氯气发生取代反应,D错。
4.
答案:B 解析:消毒效率通常以单位质量的消毒剂所得到的电子数来表示,ClO2和Cl2的消毒效率之比为∶=2.63;投入石灰,能除去Mg2+、[生成Mg(OH)2、CaCO3沉淀];以FeSO4作混凝剂,铁元素会被氧化而以Fe(OH)3形式进入沉淀池。
5.答案:(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)6Fe2+++14H+===6Fe3++2Cr3++7H2O
(3)Fe3+、Cr3+与溶液中OH-形成Fe(OH)3、Cr(OH)3沉淀。
(4)不能用石墨电极代替铁电极。因为铁电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72—还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒。
解析:(1)铁电极作阳极,铁被氧化而溶解:Fe-2e-===Fe2+,阴极上溶液中氢离子放电生成氢气:2H++2e-===H2↑;(2)阳极生成的Fe2+与含的酸性工业废水发生氧化还原反应,离子方程式为6Fe2+++14H+===6Fe3++2Cr3++7H2O;(3)由于阴极H+放电,破坏了水的电离平衡:H2OH++OH-,溶液中OH-逐渐增大并向阳极移动,与Fe3+、Cr3+形成Fe(OH)3、Cr(OH)3沉淀;(4)不能用石墨电极代替铁电极,因为铁电极在电解过程中产生还原性的Fe2+,将溶液中还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒。
6.答案:(1)d e b(或c) c(或b) g h e d f
(2)洗气瓶 浓硫酸(3)饱和食盐水
(4)检查装置的气密性
(5)否
(6)盐酸浓度小,反应没发生;装置漏气;e与f连接。
解析:本实验有两个目的:其一是验证干燥的氯气没有漂白性;其二是测量氯气的体积。由于测量氯气的体积是根据排入量筒里的水的体积来计算,所以验证干燥的氯气无漂白性的实验必须放在测量氯气的体积之前(否则无法连接)。连接顺序:发生装置→除氯化氢杂质→除水蒸气→验证漂白性→排液体→收集液体。除去水蒸气可以用装有无水CaCl2的U形管,也可以用盛有浓硫酸的洗气瓶。
7.答案:(1)氧化性 还原性 漂白性 溶于水显酸性
(2)①铜和锌可形成原电池,锌作负极,反应速率加快
②将收集到氢气的试管用大拇指堵住,对着酒精灯火焰,松开拇指,若听到“噗”的响声,则可证明H2较纯净 CuO+H2Cu+H2O
解析:根据培养皿上的试剂:H2S溶液、酸性KMnO4溶液、品红溶液、NaOH(含酚酞)溶液,可以推知验证SO2的氧化性、还原性、漂白性,溶于水显酸性(或酸性氧化物的性质)。原电池原理的应用之一是加快反应速率。H2的检验用点燃法,H2具有还原性,可还原CuO。
1.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉花球,反应一段时间后,对下图中指定部位颜色描述正确的是( )。
①
②
③
④
A
黄绿色
棕黄色
蓝色
白色
B
无色
棕黄色
紫色
白色
C
黄绿色
棕黄色
蓝色
无色
D
黄绿色
无色
紫色
白色
21世纪教育网2.工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法类别都正确的是( )。
选项
污染物
处理措施
方法类别
A
废酸
加生石灰中和
物理法
B
Cu2+等重金属离子
加硫酸盐沉降
化学法
C
含苯废水
用活性炭吸附
物理法
D
含纯碱的废水
加石灰水反应
化学法
3.某同学用下列装置制备并检验Cl2的性质。下列说法正确的是( )。
A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗
B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:量筒中发生了加成反应
4.自来水加工处理流程如下图,下列有关说法不正确的是( )。
A.用ClO2消毒自来水,消毒效率比同质量氯气高
B.若用FeSO4作混凝剂,最终铁元素将以Fe(OH)2形式进入反应沉淀池
C.自来水生产中,前加氯起消毒杀菌作用,后加氯是保持水中有效氯的含量,防止自来水二次污染
D.投药时常加入适量的石灰,是为了除去水中的Mg2+、等
5.工业上处理含的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成;③过滤回收沉淀,废水达排放标准。试回答:
(1)写出电解时的电极反应,阳极:______________,阴极:____________。
(2)写出转变成Cr3+的离子反应方程式________________________________。
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
(4)能否将铁电极改成石墨电极?为什么?
6.漂白粉可以和浓盐酸反应产生氯气,某课外兴趣小组试图测定氯气的体积并验证纯净干燥的氯气没有漂白性,现用如图所示装置进行实验,请回答有关问题:
(1)该装置的正确连接顺序是:a接( )、( )接( )、( )接( )、( )接( )、( )接( )。
(2)U形管可以用________替代(填装置名称),内盛装的试剂是________。
(3)洗气瓶中的液体是________。
(4)在制取氯气前,必须进行的一项操作步骤是____________。(5)按照实验目的进行之后,干燥有色布条是否褪色________(填“是”或“否”)。
(6)该兴趣小组在实验中发现量筒中并没有收集到液体,你认为他们失败的原因可能是什么?
7.微型实验因其装置简单、操作简便、药品用量少、减轻污染等优点而得以大量的应用,请回答下列问题。
(1)二氧化硫性质检验的微型实验。
实验步骤:将小培养皿放在白纸上,如图所示(简化后的俯视图),在A、B、C、D处分别各滴1滴硫化氢溶液、高锰酸钾酸性溶液、品红溶液、氢氧化钠(含酚酞)溶液,接着在培养皿中央(E处)滴加浓硫酸(1∶1)和亚硫酸钠溶液各1滴,并立即盖上大培养皿。通过观察A、B、C、D处的现象,可以验证二氧化硫的化学性质分别为______________、____________、______________、____________。
(2)下图为氢气还原氧化铜的微型快速实验装置。
实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的燃烧匙,可上下拉动控制反应;将铜丝2一端弯曲成螺旋状(见图)。
请回答下列问题:
①在Ⅰ中生成的氢气速率比较快的原因是__________________________;
②操作铜丝2的方法是:检验产生氢气的纯度后,将铜丝2加热至红热后伸入Ⅱ中。
问题一:如何检验氢气的纯度__________________________。
问题二:Ⅱ中的反应方程式为__________________________。
参考答案1.答案:A 解析:氯气:黄绿色,氯水:黄绿色,液溴:深棕红色,溴水:棕黄色,碘:紫色,碘水:黄色,碘的淀粉溶液:蓝色。Cl2通入NaOH溶液中生成NaCl、NaClO呈无色,但由于棉花球呈白色,故Cl2被蘸有NaOH溶液的棉花球吸收后棉花球仍显白色,选A。
2.答案:C 解析:本题考查运用化学知识处理污染物的常用方法。用生石灰中和废酸,是化学方法,A错。CuSO4不是沉淀,故处理措施错误,B错。活性炭能吸附某些有气味的气体和有色、有毒物质,是物理方法,C正确。Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,溶液碱性更强,污染更严重,D错。
3.
答案:B 解析:本题考查氯气的制备及性质。稀盐酸不与二氧化锰反应,所以当二氧化锰过量时,浓盐酸变稀后不再继续反应,最后剩余盐酸,A错;氯气溶于水生成次氯酸具有漂白性,使有色布条褪色,氯气与氢氧化钠反应生成氯化钠与次氯酸钠,加入酸后氯离子与次氯酸根离子发生反应生成氯气,B对;铜在氯气中燃烧生成棕色的烟,C错;甲烷与氯气发生取代反应,D错。
4.
答案:B 解析:消毒效率通常以单位质量的消毒剂所得到的电子数来表示,ClO2和Cl2的消毒效率之比为∶=2.63;投入石灰,能除去Mg2+、[生成Mg(OH)2、CaCO3沉淀];以FeSO4作混凝剂,铁元素会被氧化而以Fe(OH)3形式进入沉淀池。
5.答案:(1)Fe-2e-===Fe2+ 2H++2e-===H2↑
(2)6Fe2+++14H+===6Fe3++2Cr3++7H2O
(3)Fe3+、Cr3+与溶液中OH-形成Fe(OH)3、Cr(OH)3沉淀。
(4)不能用石墨电极代替铁电极。因为铁电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72—还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒。
解析:(1)铁电极作阳极,铁被氧化而溶解:Fe-2e-===Fe2+,阴极上溶液中氢离子放电生成氢气:2H++2e-===H2↑;(2)阳极生成的Fe2+与含的酸性工业废水发生氧化还原反应,离子方程式为6Fe2+++14H+===6Fe3++2Cr3++7H2O;(3)由于阴极H+放电,破坏了水的电离平衡:H2OH++OH-,溶液中OH-逐渐增大并向阳极移动,与Fe3+、Cr3+形成Fe(OH)3、Cr(OH)3沉淀;(4)不能用石墨电极代替铁电极,因为铁电极在电解过程中产生还原性的Fe2+,将溶液中还原为Cr3+而除去,若改用石墨电极,不能产生还原性微粒。
6.答案:(1)d e b(或c) c(或b) g h e d f
(2)洗气瓶 浓硫酸(3)饱和食盐水
(4)检查装置的气密性
(5)否
(6)盐酸浓度小,反应没发生;装置漏气;e与f连接。
解析:本实验有两个目的:其一是验证干燥的氯气没有漂白性;其二是测量氯气的体积。由于测量氯气的体积是根据排入量筒里的水的体积来计算,所以验证干燥的氯气无漂白性的实验必须放在测量氯气的体积之前(否则无法连接)。连接顺序:发生装置→除氯化氢杂质→除水蒸气→验证漂白性→排液体→收集液体。除去水蒸气可以用装有无水CaCl2的U形管,也可以用盛有浓硫酸的洗气瓶。
7.答案:(1)氧化性 还原性 漂白性 溶于水显酸性
(2)①铜和锌可形成原电池,锌作负极,反应速率加快
②将收集到氢气的试管用大拇指堵住,对着酒精灯火焰,松开拇指,若听到“噗”的响声,则可证明H2较纯净 CuO+H2Cu+H2O
解析:根据培养皿上的试剂:H2S溶液、酸性KMnO4溶液、品红溶液、NaOH(含酚酞)溶液,可以推知验证SO2的氧化性、还原性、漂白性,溶于水显酸性(或酸性氧化物的性质)。原电池原理的应用之一是加快反应速率。H2的检验用点燃法,H2具有还原性,可还原CuO。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
