2016-2017高二化学人教版选修6自我小测:第三单元 课题一 物质的检验 第1课时(含解析)
文档属性
| 名称 | 2016-2017高二化学人教版选修6自我小测:第三单元 课题一 物质的检验 第1课时(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 922.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-29 07:15:43 | ||
图片预览

文档简介
自我小测
1.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁,这种试剂是( )。
A.NaOH
B.NH3·H2O
C.AgNO3
D.BaCl22.离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子的检验方法不合理的是( )。
A.—气体法
B.I-—沉淀法
C.Fe3+—显色法
D.Ca2+—气体法3.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )。
A.Na2SO3溶液(BaCl2)
B.FeCl2溶液(KSCN)
C.KI(淀粉溶液)
D.HCHO溶液(石蕊试液)
4.下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )。①KOH、Na2SO4、AlCl3 ②NaHCO3、Ba(OH)2、H2SO4 ③HCl、NaAlO2、NaHSO4 ④Ca(OH)2、Na2CO3、BaCl2
A.①②
B.②③
C.①③④
D.①②④
5.某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr中的一种或几种。将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )。
A.一定存在HCl
B.一定存在SO2
C.肯定没有CO2
D.不能肯定是否含有NO2、HI
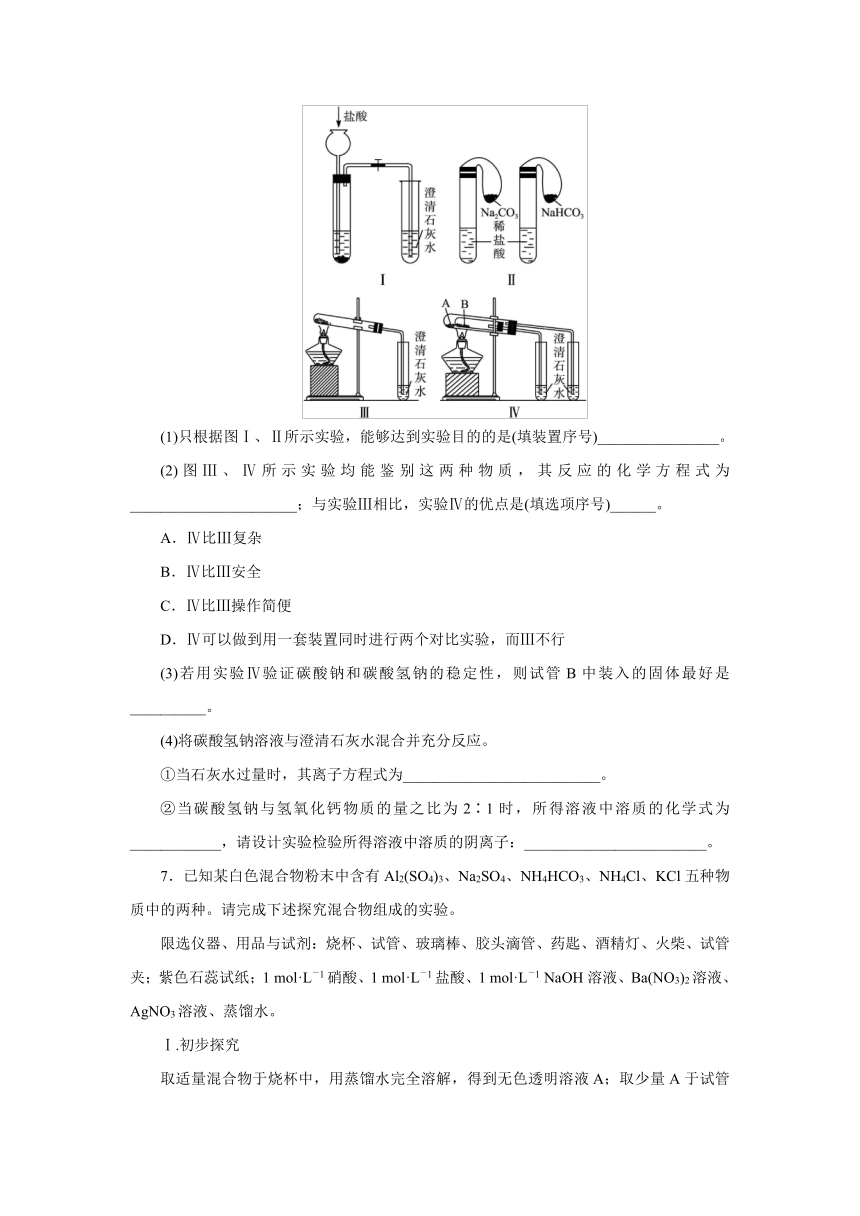
6.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为______________________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是__________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为__________________________。
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为____________,请设计实验检验所得溶液中溶质的阴离子:________________________。
7.已知某白色混合物粉末中含有Al2(SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验。
限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1
mol·L-1硝酸、1
mol·L-1盐酸、1
mol·L-1
NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
Ⅰ.初步探究
取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管中,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验证明:该混合物中肯定含有________(名称),肯定不含有________(化学式)。
Ⅱ.进一步探究
(2)为了进一步确定该混合固体的组成,需要进行实验一或实验一、二,完成下表:
实验操作
预期现象和结论
实验一:取少量溶液B于试管中,加入少量Ba(NO3)2溶液,振荡,静置观察
实验二:
参考答案
1.答案:A 解析:NaOH与(NH4)2SO4加热反应有刺激性气味的气体产生;与KCl不反应,无明显现象;与MgCl2反应生成白色沉淀,当NaOH过量时,白色沉淀不溶解;与Al2(SO4)3反应生成白色沉淀,当NaOH过量时,白色沉淀溶解;与Fe2(SO4)3反应时,有红褐色沉淀生成。则A正确。
2.答案:D 解析:的检验是利用NaOH与其反应产生NH3;I-的检验可用硝酸酸化的硝酸银,反应产生黄色沉淀AgI;Fe3+遇KSCN溶液显红色(或者与苯酚反应,溶液显紫色);只有Ca2+不能反应生成气体,故D不合理。
3.答案:A 解析:由于加入BaCl2能形成亚硫酸钡及硫酸钡沉淀,所以无法确定Na2SO3溶液是否变质。
4.答案:A 解析:将各组溶液进行两两混合后,若现象各不相同,即可鉴别,否则不能鉴别。①中KOH和AlCl3滴加顺序不同,现象不同。②中Ba(OH)2与NaHCO3和H2SO4均生成沉淀,再向两沉淀中交叉滴加H2SO4和NaHCO3,一种沉淀中产生气体,但仍有白色沉淀存在,另一种沉淀不溶解,无新现象产生。③中HCl、NaHSO4分别与NaAlO2混合时,现象相同。④中Ca(OH)2、BaCl2分别与Na2CO3混合时,现象相同,因此答案为A。
5.答案:B 解析:由无色气体可排除NO2,通入氯水中,得到无色透明溶液可排除HBr、HI。向无色溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,应有BaSO4生成,只可能由SO2与氯水反应产生,由此可以判断一定有SO2存在。
6.答案:(1)Ⅱ
(2)2NaHCO3Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O D
(3)NaHCO3
(4)①Ca2++OH-+
===CaCO3↓+H2O ②Na2CO3
取少量上层清液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有
(四个要点“操作、试剂、现象、结论”)
解析:在(1)中,本实验的目的是鉴别碳酸钠和碳酸氢钠两种白色固体,所以在图Ⅰ、Ⅱ所示实验中,Ⅱ可以通过观察气球鼓起的大小和快慢进行判断,能达到实验要求;而二者均能产生使澄清石灰水变浑浊的气体,故Ⅰ不能达到实验要求。
在(2)中,书写反应的化学方程式比较简单,要比较两个装置的优缺点,需要依据图示认真分析其不同之处。在(3)中,试管B比试管A受热升温慢,即温度要低,所以试管B装入的固体应该是NaHCO3。
在(4)中,注意当反应物比例不同时,其产物的区别,这是正确解答的关键。
7.答案:(1)碳酸氢铵 Al2(SO4)3
(2)
实验操作
预期现象和结论
若产生白色沉淀,说明固体中含有Na2SO4,组成为NH4HCO3和Na2SO4;若无明显现象,则说明不含有Na2SO4,继续做实验二
实验二:取少量原固体于试管中,平铺于试管底部,充分加热
若没有(或有)固体剩余,则组成为NH4HCO3和NH4Cl(或NH4HCO3和KCl)
解析:审题时要看清条件——白色粉末含有五种物质中的两种。由粉末溶于水得无色透明溶液A,A中加稀硝酸有无色气泡产生可知原粉末一定有NH4HCO3(因为只有与HNO3反应产生气体),一定没有Al2(SO4)3[因为Al3+与发生双水解反应产生沉淀和气体:Al3++3
===Al(OH)3↓+3CO2↑]。
(2)中的实验一能判断是否存在Na2SO4,若产生白色沉淀,则原固体组成为NH4HCO3和Na2SO4,不必做实验二;若无Na2SO4,则应继续确定另一种物质是NH4Cl还是KCl,可取原固体充分加热,通过有无固体剩余来确定。
1.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁,这种试剂是( )。
A.NaOH
B.NH3·H2O
C.AgNO3
D.BaCl22.离子检验的常用方法有三种:
检验方法
沉淀法
显色法
气体法
含义
反应中有沉淀产生或溶解
反应中有颜色变化
反应中有气体产生
下列离子的检验方法不合理的是( )。
A.—气体法
B.I-—沉淀法
C.Fe3+—显色法
D.Ca2+—气体法3.为确定下列置于空气中的物质是否变质,所选检验试剂(括号内物质)不能达到目的的是( )。
A.Na2SO3溶液(BaCl2)
B.FeCl2溶液(KSCN)
C.KI(淀粉溶液)
D.HCHO溶液(石蕊试液)
4.下列各组物质的无色溶液,不用其他试剂即可鉴别的是( )。①KOH、Na2SO4、AlCl3 ②NaHCO3、Ba(OH)2、H2SO4 ③HCl、NaAlO2、NaHSO4 ④Ca(OH)2、Na2CO3、BaCl2
A.①②
B.②③
C.①③④
D.①②④
5.某无色气体,可能含HCl、CO2、NO2、HI、SO2、HBr中的一种或几种。将其通入氯水中,得到无色透明溶液,把溶液分成两份,向一份加入盐酸酸化的BaCl2溶液,出现白色沉淀,另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是( )。
A.一定存在HCl
B.一定存在SO2
C.肯定没有CO2
D.不能肯定是否含有NO2、HI
6.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________________。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式为______________________;与实验Ⅲ相比,实验Ⅳ的优点是(填选项序号)______。
A.Ⅳ比Ⅲ复杂
B.Ⅳ比Ⅲ安全
C.Ⅳ比Ⅲ操作简便
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是__________。
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为__________________________。
②当碳酸氢钠与氢氧化钙物质的量之比为2∶1时,所得溶液中溶质的化学式为____________,请设计实验检验所得溶液中溶质的阴离子:________________________。
7.已知某白色混合物粉末中含有Al2(SO4)3、Na2SO4、NH4HCO3、NH4Cl、KCl五种物质中的两种。请完成下述探究混合物组成的实验。
限选仪器、用品与试剂:烧杯、试管、玻璃棒、胶头滴管、药匙、酒精灯、火柴、试管夹;紫色石蕊试纸;1
mol·L-1硝酸、1
mol·L-1盐酸、1
mol·L-1
NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
Ⅰ.初步探究
取适量混合物于烧杯中,用蒸馏水完全溶解,得到无色透明溶液A;取少量A于试管中,滴加稀硝酸,有无色气泡产生,继续滴加稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)上述实验证明:该混合物中肯定含有________(名称),肯定不含有________(化学式)。
Ⅱ.进一步探究
(2)为了进一步确定该混合固体的组成,需要进行实验一或实验一、二,完成下表:
实验操作
预期现象和结论
实验一:取少量溶液B于试管中,加入少量Ba(NO3)2溶液,振荡,静置观察
实验二:
参考答案
1.答案:A 解析:NaOH与(NH4)2SO4加热反应有刺激性气味的气体产生;与KCl不反应,无明显现象;与MgCl2反应生成白色沉淀,当NaOH过量时,白色沉淀不溶解;与Al2(SO4)3反应生成白色沉淀,当NaOH过量时,白色沉淀溶解;与Fe2(SO4)3反应时,有红褐色沉淀生成。则A正确。
2.答案:D 解析:的检验是利用NaOH与其反应产生NH3;I-的检验可用硝酸酸化的硝酸银,反应产生黄色沉淀AgI;Fe3+遇KSCN溶液显红色(或者与苯酚反应,溶液显紫色);只有Ca2+不能反应生成气体,故D不合理。
3.答案:A 解析:由于加入BaCl2能形成亚硫酸钡及硫酸钡沉淀,所以无法确定Na2SO3溶液是否变质。
4.答案:A 解析:将各组溶液进行两两混合后,若现象各不相同,即可鉴别,否则不能鉴别。①中KOH和AlCl3滴加顺序不同,现象不同。②中Ba(OH)2与NaHCO3和H2SO4均生成沉淀,再向两沉淀中交叉滴加H2SO4和NaHCO3,一种沉淀中产生气体,但仍有白色沉淀存在,另一种沉淀不溶解,无新现象产生。③中HCl、NaHSO4分别与NaAlO2混合时,现象相同。④中Ca(OH)2、BaCl2分别与Na2CO3混合时,现象相同,因此答案为A。
5.答案:B 解析:由无色气体可排除NO2,通入氯水中,得到无色透明溶液可排除HBr、HI。向无色溶液中加入盐酸酸化的BaCl2溶液,出现白色沉淀,应有BaSO4生成,只可能由SO2与氯水反应产生,由此可以判断一定有SO2存在。
6.答案:(1)Ⅱ
(2)2NaHCO3Na2CO3+H2O+CO2↑,CO2+Ca(OH)2===CaCO3↓+H2O D
(3)NaHCO3
(4)①Ca2++OH-+
===CaCO3↓+H2O ②Na2CO3
取少量上层清液于试管中,加入适量氯化钙溶液,振荡,若有白色沉淀生成,则证明溶液中含有
(四个要点“操作、试剂、现象、结论”)
解析:在(1)中,本实验的目的是鉴别碳酸钠和碳酸氢钠两种白色固体,所以在图Ⅰ、Ⅱ所示实验中,Ⅱ可以通过观察气球鼓起的大小和快慢进行判断,能达到实验要求;而二者均能产生使澄清石灰水变浑浊的气体,故Ⅰ不能达到实验要求。
在(2)中,书写反应的化学方程式比较简单,要比较两个装置的优缺点,需要依据图示认真分析其不同之处。在(3)中,试管B比试管A受热升温慢,即温度要低,所以试管B装入的固体应该是NaHCO3。
在(4)中,注意当反应物比例不同时,其产物的区别,这是正确解答的关键。
7.答案:(1)碳酸氢铵 Al2(SO4)3
(2)
实验操作
预期现象和结论
若产生白色沉淀,说明固体中含有Na2SO4,组成为NH4HCO3和Na2SO4;若无明显现象,则说明不含有Na2SO4,继续做实验二
实验二:取少量原固体于试管中,平铺于试管底部,充分加热
若没有(或有)固体剩余,则组成为NH4HCO3和NH4Cl(或NH4HCO3和KCl)
解析:审题时要看清条件——白色粉末含有五种物质中的两种。由粉末溶于水得无色透明溶液A,A中加稀硝酸有无色气泡产生可知原粉末一定有NH4HCO3(因为只有与HNO3反应产生气体),一定没有Al2(SO4)3[因为Al3+与发生双水解反应产生沉淀和气体:Al3++3
===Al(OH)3↓+3CO2↑]。
(2)中的实验一能判断是否存在Na2SO4,若产生白色沉淀,则原固体组成为NH4HCO3和Na2SO4,不必做实验二;若无Na2SO4,则应继续确定另一种物质是NH4Cl还是KCl,可取原固体充分加热,通过有无固体剩余来确定。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
