2016-2017高二化学人教版选修6自我小测:第四单元 课题三 综合实验设计1(含解析)
文档属性
| 名称 | 2016-2017高二化学人教版选修6自我小测:第四单元 课题三 综合实验设计1(含解析) |

|
|
| 格式 | zip | ||
| 文件大小 | 6.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-29 00:00:00 | ||
图片预览


文档简介
自我小测
1.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )。
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①②
B.②④
C.③④
D.②③
2.下图是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图装置可起到与下图装置相同的效果的是( )。
3.某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO七种气体中的两种,则下列判断中,正确的是( )。
A.X是NH3,Y是HCl
B.X是Cl2,Y是CH4C.X是SO2,Y是O2
D.X是NO,Y是O2
4.如下图所示,锥形瓶内装有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球Z鼓起。则对于气体X和液体Y不可能的是( )。
A.X是Cl2,Y是NaOH溶液
B.X是NH3,Y是NaCl溶液
C.X是SO2,Y是NaOH溶液
D.X是CO2,Y是稀硫酸
5.下列实验设计能够成功的是( )。
实验目的
实验步骤及现象
A
检验亚硫酸钠试样是否变质
试样白色沉淀沉淀不溶解
B
除去乙酸乙酯中混有的乙酸
混合液溶液分层得上层液体
C
证明酸性条件下H2O2氧化性比I2强
NaI溶液溶液变蓝色
D
鉴定盐A的成分是FeBr2
A
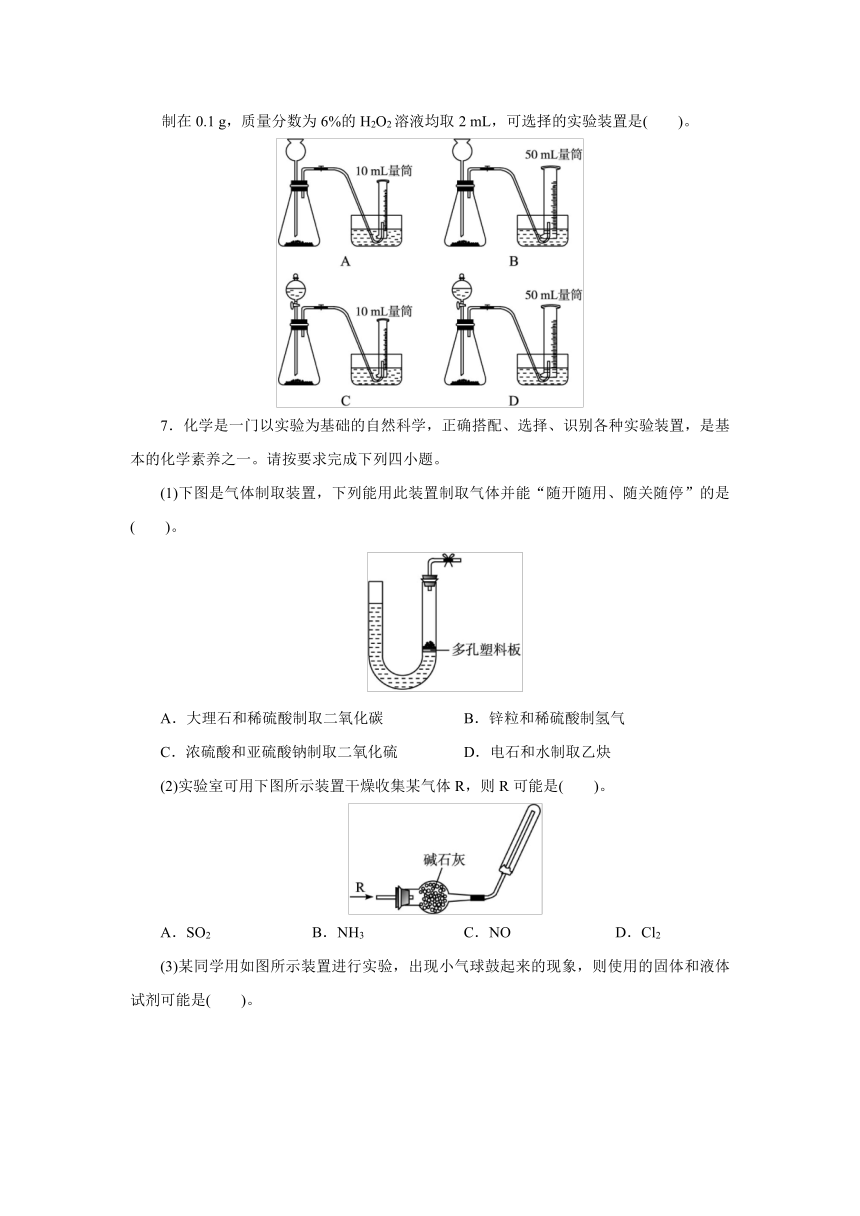
6.比较MnO2和CuO对H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在0.1
g,质量分数为6%的H2O2溶液均取2
mL,可选择的实验装置是( )。
7.化学是一门以实验为基础的自然科学,正确搭配、选择、识别各种实验装置,是基本的化学素养之一。请按要求完成下列四小题。
(1)下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )。
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓硫酸和亚硫酸钠制取二氧化硫
D.电石和水制取乙炔
(2)实验室可用下图所示装置干燥收集某气体R,则R可能是( )。
A.SO2
B.NH3
C.NO
D.Cl2
(3)某同学用如图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是( )。
A.铜与浓硫酸
B.铁与浓硫酸
C.铝和氢氧化钠溶液
D.二氧化锰和浓盐酸
(4)指出下面3个实验中各存在的一个错误:
A____________,B________,C____________。
8.铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。
Ⅰ.查阅资料:
①Cu2O属于碱性氧化物。
②高温灼烧CuO生成Cu2O。
③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+===Cu+Cu2++H2O
Ⅱ.设计实验方案:方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化。方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a
g,取红色试样置于坩埚中称得总质量为b
g,在空气中高温灼烧至质量恒定,称得最后总质量为c
g。
(1)请你评价方案1和方案2。如果你认为方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1:__________________________________________________________________。
方案2:__________________________________________________________________。(2)方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为________,该实验方案最少得进行________次称量。
Ⅲ.研究性学习小组乙设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示:
(3)简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论):________________________________________________________________________
________________________________________________________________________。(4)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有:________(填序号)。
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
参考答案
1.答案:D 解析:溶液能够倒吸,说明集气瓶能够形成低气压,①④气体互不反应;②中Cl2与CH4光照条件下发生反应,反应后气体体积减小,且产物HCl易溶于水;③的气体与水共同作用,气压减小。
2.
答案:BD 解析:题目给出的简易装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果,即符合启普发生器原理。A装置无法实现使大理石和盐酸脱离接触,不符合启普发生器原理;C选项产生的气体无法排出,存在安全隐患。
3.答案:A 解析:X必须是一种易溶于NaOH溶液的气体,才能使甲内气压减小导致乙中的气体进入甲,可排除D;乙中的气体进入甲后反应产生白烟,可排除B、C,虽然Cl2与CH4光照能反应但无白烟现象,SO2与O2在通常情况下不反应。胶头滴管中的液体应为酚酞。
4.答案:D 解析:将滴管内的液体滴入锥形瓶,只有锥形瓶内的气体被液体吸收,导致锥形瓶内压强减小,小于大气压,利用大气压使气球在锥形瓶内膨胀。Cl2、SO2都能与NaOH溶液反应,NaCl溶液中的水能够溶解NH3。
5.答案:B 解析:A项中亚硫酸钠变质应被氧化成硫酸钠,检验时应使用氯化钡溶液和稀盐酸作检验试剂,而不应该使用硝酸钡和稀硝酸,因为在酸性条件下硝酸根(硝酸)能将亚硫酸盐(亚硫酸根)氧化成硫酸盐,干扰实验现象,A项错误;B项中由于乙酸能和碳酸钠溶液反应生成可溶性的乙酸钠,且乙酸乙酯在饱和碳酸钠溶液中的溶解度小,故可通过分液分离,B项正确;C项中后续操作用到了具有强氧化性的稀硝酸,稀硝酸也能将I-氧化成I2,干扰实验,应改用稀盐酸,C项错误;D项中并没有检验出Fe2+,因为硝酸具有强氧化性,将Fe2+氧化成了Fe3+,无法判定A是FeBr2还是FeBr3,D项错误。
6.答案:D 解析:A、B两装置中使用的长颈漏斗没有形成液封,无法收集到气体;根据双氧水分解反应的化学方程式进行粗略计算可知,2
mL
6%的H2O2溶液完全分解产生的氧气在标准状况下的体积约为39.5
mL,故答案选D。
7.答案:
(1)B (2)B (3)C (4)A.胶头滴管口伸入试管中 B.试管口比试管底高(应略向下倾斜) C.混合气体从短导管进入洗气瓶
解析:(1)制取二氧化碳,不能用大理石和稀硫酸反应,因为生成的硫酸钙微溶于水覆盖在大理石表面阻碍反应的进行,故A错;浓硫酸和亚硫酸钠制取二氧化硫,由于亚硫酸钠不是难溶的块状固体,所以不能使用此装置,故C错;电石和水制取乙炔的反应太剧烈,也不宜使用此装置,故D错。(2)能用此装置干燥收集的某气体R,只能是选项中的NH3,因为SO2、Cl2会与碱石灰反应,NO不能用排空气法收集。(3)小气球鼓起来说明装置中有气体产生。铜与浓硫酸、二氧化锰和浓盐酸均需要加热才能反应,铁与浓硫酸在常温下发生钝化,只有铝和氢氧化钠溶液在常温下反应产生氢气。
8.答案:(1)不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液 合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色
(2)c<(9b-a)/8 4
(3)关闭导气管上的活塞,从漏斗中往试管中注水,漏斗中的液面高度高于试管中的液面高度,且一段时间内液面无变化,则说明气体发生装置气密性良好
(4)ABC
解析:(2)设红色粉末中Cu元素的物质的量为n,则(b-a)/64>n>(c-a)/72,即c<(9b-a)/8;称量a、b各1次,确定c至少两次,确认反应完全。(4)氢气还原CuO,需要排尽系统中的空气,以保证安全;实验中通过测定生成水的量进行定量验证,在整个实验过程中确保不进入外来水分,因此必须除水干燥。
1.如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )。
①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A.①②
B.②④
C.③④
D.②③
2.下图是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图装置可起到与下图装置相同的效果的是( )。
3.某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO七种气体中的两种,则下列判断中,正确的是( )。
A.X是NH3,Y是HCl
B.X是Cl2,Y是CH4C.X是SO2,Y是O2
D.X是NO,Y是O2
4.如下图所示,锥形瓶内装有干燥的气体X,胶头滴管内盛有液体Y,若挤压胶头滴管,使液体Y滴入瓶中,振荡,一会儿可见小气球Z鼓起。则对于气体X和液体Y不可能的是( )。
A.X是Cl2,Y是NaOH溶液
B.X是NH3,Y是NaCl溶液
C.X是SO2,Y是NaOH溶液
D.X是CO2,Y是稀硫酸
5.下列实验设计能够成功的是( )。
实验目的
实验步骤及现象
A
检验亚硫酸钠试样是否变质
试样白色沉淀沉淀不溶解
B
除去乙酸乙酯中混有的乙酸
混合液溶液分层得上层液体
C
证明酸性条件下H2O2氧化性比I2强
NaI溶液溶液变蓝色
D
鉴定盐A的成分是FeBr2
A
6.比较MnO2和CuO对H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在0.1
g,质量分数为6%的H2O2溶液均取2
mL,可选择的实验装置是( )。
7.化学是一门以实验为基础的自然科学,正确搭配、选择、识别各种实验装置,是基本的化学素养之一。请按要求完成下列四小题。
(1)下图是气体制取装置,下列能用此装置制取气体并能“随开随用、随关随停”的是( )。
A.大理石和稀硫酸制取二氧化碳
B.锌粒和稀硫酸制氢气
C.浓硫酸和亚硫酸钠制取二氧化硫
D.电石和水制取乙炔
(2)实验室可用下图所示装置干燥收集某气体R,则R可能是( )。
A.SO2
B.NH3
C.NO
D.Cl2
(3)某同学用如图所示装置进行实验,出现小气球鼓起来的现象,则使用的固体和液体试剂可能是( )。
A.铜与浓硫酸
B.铁与浓硫酸
C.铝和氢氧化钠溶液
D.二氧化锰和浓盐酸
(4)指出下面3个实验中各存在的一个错误:
A____________,B________,C____________。
8.铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得红色固体中是否含有Cu2O进行了认真的探究。
Ⅰ.查阅资料:
①Cu2O属于碱性氧化物。
②高温灼烧CuO生成Cu2O。
③Cu2O在酸性条件下能发生下列反应:Cu2O+2H+===Cu+Cu2++H2O
Ⅱ.设计实验方案:方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化。方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a
g,取红色试样置于坩埚中称得总质量为b
g,在空气中高温灼烧至质量恒定,称得最后总质量为c
g。
(1)请你评价方案1和方案2。如果你认为方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1:__________________________________________________________________。
方案2:__________________________________________________________________。(2)方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为________,该实验方案最少得进行________次称量。
Ⅲ.研究性学习小组乙设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示:
(3)简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论):________________________________________________________________________
________________________________________________________________________。(4)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有:________(填序号)。
A.在氢气发生器与硬质玻璃管之间加一个干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
参考答案
1.答案:D 解析:溶液能够倒吸,说明集气瓶能够形成低气压,①④气体互不反应;②中Cl2与CH4光照条件下发生反应,反应后气体体积减小,且产物HCl易溶于水;③的气体与水共同作用,气压减小。
2.
答案:BD 解析:题目给出的简易装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果,即符合启普发生器原理。A装置无法实现使大理石和盐酸脱离接触,不符合启普发生器原理;C选项产生的气体无法排出,存在安全隐患。
3.答案:A 解析:X必须是一种易溶于NaOH溶液的气体,才能使甲内气压减小导致乙中的气体进入甲,可排除D;乙中的气体进入甲后反应产生白烟,可排除B、C,虽然Cl2与CH4光照能反应但无白烟现象,SO2与O2在通常情况下不反应。胶头滴管中的液体应为酚酞。
4.答案:D 解析:将滴管内的液体滴入锥形瓶,只有锥形瓶内的气体被液体吸收,导致锥形瓶内压强减小,小于大气压,利用大气压使气球在锥形瓶内膨胀。Cl2、SO2都能与NaOH溶液反应,NaCl溶液中的水能够溶解NH3。
5.答案:B 解析:A项中亚硫酸钠变质应被氧化成硫酸钠,检验时应使用氯化钡溶液和稀盐酸作检验试剂,而不应该使用硝酸钡和稀硝酸,因为在酸性条件下硝酸根(硝酸)能将亚硫酸盐(亚硫酸根)氧化成硫酸盐,干扰实验现象,A项错误;B项中由于乙酸能和碳酸钠溶液反应生成可溶性的乙酸钠,且乙酸乙酯在饱和碳酸钠溶液中的溶解度小,故可通过分液分离,B项正确;C项中后续操作用到了具有强氧化性的稀硝酸,稀硝酸也能将I-氧化成I2,干扰实验,应改用稀盐酸,C项错误;D项中并没有检验出Fe2+,因为硝酸具有强氧化性,将Fe2+氧化成了Fe3+,无法判定A是FeBr2还是FeBr3,D项错误。
6.答案:D 解析:A、B两装置中使用的长颈漏斗没有形成液封,无法收集到气体;根据双氧水分解反应的化学方程式进行粗略计算可知,2
mL
6%的H2O2溶液完全分解产生的氧气在标准状况下的体积约为39.5
mL,故答案选D。
7.答案:
(1)B (2)B (3)C (4)A.胶头滴管口伸入试管中 B.试管口比试管底高(应略向下倾斜) C.混合气体从短导管进入洗气瓶
解析:(1)制取二氧化碳,不能用大理石和稀硫酸反应,因为生成的硫酸钙微溶于水覆盖在大理石表面阻碍反应的进行,故A错;浓硫酸和亚硫酸钠制取二氧化硫,由于亚硫酸钠不是难溶的块状固体,所以不能使用此装置,故C错;电石和水制取乙炔的反应太剧烈,也不宜使用此装置,故D错。(2)能用此装置干燥收集的某气体R,只能是选项中的NH3,因为SO2、Cl2会与碱石灰反应,NO不能用排空气法收集。(3)小气球鼓起来说明装置中有气体产生。铜与浓硫酸、二氧化锰和浓盐酸均需要加热才能反应,铁与浓硫酸在常温下发生钝化,只有铝和氢氧化钠溶液在常温下反应产生氢气。
8.答案:(1)不合理,因为铜和氧化亚铜均可溶于稀硝酸形成蓝色溶液 合理,因为氧化亚铜与稀硫酸生成Cu和Cu2+,导致溶液呈蓝色
(2)c<(9b-a)/8 4
(3)关闭导气管上的活塞,从漏斗中往试管中注水,漏斗中的液面高度高于试管中的液面高度,且一段时间内液面无变化,则说明气体发生装置气密性良好
(4)ABC
解析:(2)设红色粉末中Cu元素的物质的量为n,则(b-a)/64>n>(c-a)/72,即c<(9b-a)/8;称量a、b各1次,确定c至少两次,确认反应完全。(4)氢气还原CuO,需要排尽系统中的空气,以保证安全;实验中通过测定生成水的量进行定量验证,在整个实验过程中确保不进入外来水分,因此必须除水干燥。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
