2016-2017高二化学人教版选修6自我小测:第二单元 课题一 物质的分离和提纯 第2课时(含解析)
文档属性
| 名称 | 2016-2017高二化学人教版选修6自我小测:第二单元 课题一 物质的分离和提纯 第2课时(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-04-29 14:31:56 | ||
图片预览

文档简介
自我小测
1.医疗上的血液透析原理同胶体的渗析类似。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。血液中,蛋白质和血细胞不能通过透析膜,血液中的毒性物质可以透过,由此可以判断( )。
A.蛋白质、血细胞的粒子直径大于毒性物质的粒子直径
B.蛋白质以分子形式存在,毒性物质以离子形式存在
C.蛋白质、血细胞不溶于水,毒性物质可溶于水
D.蛋白质、血细胞不能透过滤纸,毒性物质可以透过滤纸
2.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )。
A.蒸发
B.蒸馏
C.过滤
D.萃取
3.用加热结晶的方法把食盐和水分离,为了防止加热过快而使食盐水溅出,我们可以用下图的实验装置间接加热,则图中A处应加入( )。
A.酒精
B.汽油
C.水
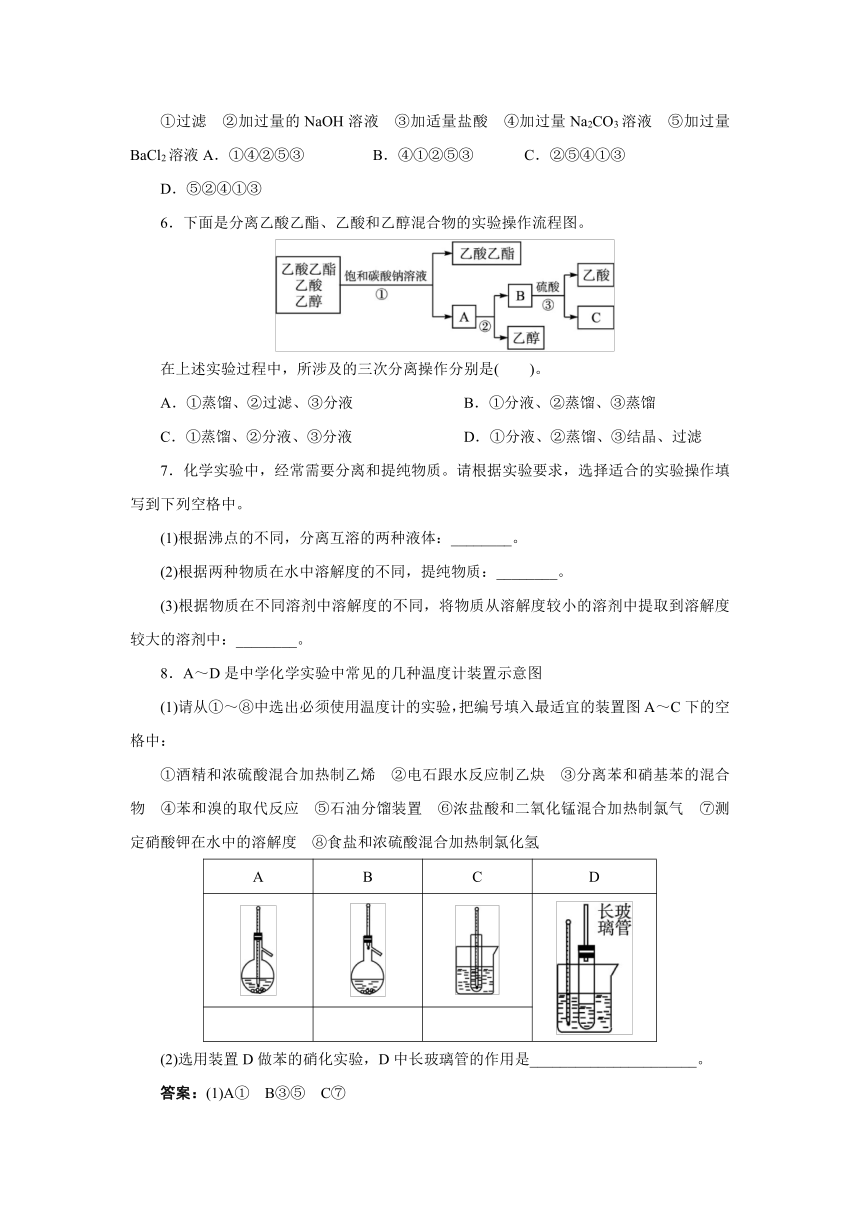
D.食盐水4.以下实验装置一般不用于分离物质的是( )。
5.为了除去粗盐中的Ca2+、Mg2+、及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )。
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
6.下面是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是( )。
A.①蒸馏、②过滤、③分液
B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液
D.①分液、②蒸馏、③结晶、过滤
7.化学实验中,经常需要分离和提纯物质。请根据实验要求,选择适合的实验操作填写到下列空格中。
(1)根据沸点的不同,分离互溶的两种液体:________。
(2)根据两种物质在水中溶解度的不同,提纯物质:________。
(3)根据物质在不同溶剂中溶解度的不同,将物质从溶解度较小的溶剂中提取到溶解度较大的溶剂中:________。
8.A~D是中学化学实验中常见的几种温度计装置示意图
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C下的空格中:
①酒精和浓硫酸混合加热制乙烯 ②电石跟水反应制乙炔 ③分离苯和硝基苯的混合物 ④苯和溴的取代反应 ⑤石油分馏装置 ⑥浓盐酸和二氧化锰混合加热制氯气 ⑦测定硝酸钾在水中的溶解度 ⑧食盐和浓硫酸混合加热制氯化氢
A
B
C
D
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是______________________。
答案:(1)A① B③⑤ C⑦
(2)减少苯的挥发(或冷凝回流作用)
9.碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如下图所示。
1.惰性电极 2.直流电源 3.离子交换膜 4.冷却水
请回答下列问题:
(1)碘是____(填颜色)固体物质,实验室常用______方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH===5KI+KIO3+3H2O
将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为____________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
实验方法
实验现象及结论
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
步骤②的操作名称是______________,步骤⑤的操作名称是______________。步骤④洗涤晶体的目的是________________________________________________________________。
参考答案1.
答案:A 解析:医学上治疗由肾功能衰竭等疾病引起的血液中毒时,最常用的血液净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理和胶体的渗析类似,透析膜同半透膜类似,透析膜的孔径应大于血液病毒性物质的粒子直径,毒性物质才可能扩散到透析液中而被除去。蛋白质、血细胞的粒子不能透过透析膜,说明其直径大于透析膜的孔径。不难看出,A是正确的。
2.
答案:CD 解析:蒸发和蒸馏主要是从物质沸点的角度考虑。过滤主要是除去液体中不溶性固体,要考虑溶解性。萃取是利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,也要考虑溶解性。3.
答案:D 解析:酒精和汽油均易燃烧,食盐水能达到比水更高的温度。
4.
答案:D 解析:蒸馏是分离沸点不同的液体混合物的方法之一;渗析是分离或提纯胶体的重要方法;过滤是分离固体和液体混合物的方法;只有D项是配制一定浓度溶液的操作步骤之一,不用于分离物质。
5.答案:CD 解析:必须了解各个实验步骤的目的,才能分清操作顺序。加入过量的NaOH溶液的目的是除去Mg2+,加入过量的BaCl2溶液是为了除去,加入过量的Na2CO3溶液是为了除去Ca2+及多余的Ba2+,然后进行过滤,除去Mg(OH)2、BaSO4、CaCO3、BaCO3、泥沙等难溶物,然后加适量的盐酸,除去多余的和调节溶液的酸碱性。综上所述,正确的实验操作顺序为C、D。
6.
答案:B 解析:乙酸乙酯在饱和碳酸钠溶液中溶解度很小,而乙酸和乙醇易溶于水,所以第一步用分液的方法;然后得到的A是乙酸钠和乙醇,由于乙酸钠的沸点高,故用蒸馏的方法分离;第三步,加硫酸将乙酸钠转变为乙酸,再蒸馏得到乙酸。7.
答案:(1)蒸馏 (2)结晶(或重结晶) (3)萃取
解析:蒸馏:根据物质的沸点不同,将物质由液态变成气态加以分离。结晶:根据溶质的溶解度随温度或溶剂量的改变而改变,将溶质从溶液中析出。萃取:根据物质在不同溶剂中溶解度的不同,将物质从溶解度较小的溶剂中提取到溶解度较大的溶剂中。
8.答案:(1)A① B③⑤ C⑦
(2)减少苯的挥发(或冷凝回流作用)
解析:A为测量或控制反应液温度;B为测量蒸馏出的气体的温度,一切蒸馏实验都适用;C为精确测定某溶液的温度;D为控制水浴温度,例如制硝基苯的实验。许多液体加热实验往往在塞子上加长玻璃管,一般是为了冷凝回流、避免某些易挥发物质损失的作用,即起冷凝器的作用。
9.
答案:(1)紫黑色 升华
(2)2I--2e-===I2(或I-+6OH--6e-===+3H2O)
有气泡产生
(3)
实验方法
实验现象及结论
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝
如果不变蓝,说明无I-(如果变蓝,说明有I-)
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
解析:(1)考查物质的物理性质,较容易。(2)阳极发生氧化反应失电子:2I--2e-===I2(或I-+6OH--6e-===+3H2O)。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水。(3)考查I-的检验,此题借助于碘单质遇淀粉变蓝这一特性,要设法将碘离子转化为碘单质。
1.医疗上的血液透析原理同胶体的渗析类似。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。血液中,蛋白质和血细胞不能通过透析膜,血液中的毒性物质可以透过,由此可以判断( )。
A.蛋白质、血细胞的粒子直径大于毒性物质的粒子直径
B.蛋白质以分子形式存在,毒性物质以离子形式存在
C.蛋白质、血细胞不溶于水,毒性物质可溶于水
D.蛋白质、血细胞不能透过滤纸,毒性物质可以透过滤纸
2.下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是( )。
A.蒸发
B.蒸馏
C.过滤
D.萃取
3.用加热结晶的方法把食盐和水分离,为了防止加热过快而使食盐水溅出,我们可以用下图的实验装置间接加热,则图中A处应加入( )。
A.酒精
B.汽油
C.水
D.食盐水4.以下实验装置一般不用于分离物质的是( )。
5.为了除去粗盐中的Ca2+、Mg2+、及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )。
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液A.①④②⑤③
B.④①②⑤③
C.②⑤④①③
D.⑤②④①③
6.下面是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
在上述实验过程中,所涉及的三次分离操作分别是( )。
A.①蒸馏、②过滤、③分液
B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液
D.①分液、②蒸馏、③结晶、过滤
7.化学实验中,经常需要分离和提纯物质。请根据实验要求,选择适合的实验操作填写到下列空格中。
(1)根据沸点的不同,分离互溶的两种液体:________。
(2)根据两种物质在水中溶解度的不同,提纯物质:________。
(3)根据物质在不同溶剂中溶解度的不同,将物质从溶解度较小的溶剂中提取到溶解度较大的溶剂中:________。
8.A~D是中学化学实验中常见的几种温度计装置示意图
(1)请从①~⑧中选出必须使用温度计的实验,把编号填入最适宜的装置图A~C下的空格中:
①酒精和浓硫酸混合加热制乙烯 ②电石跟水反应制乙炔 ③分离苯和硝基苯的混合物 ④苯和溴的取代反应 ⑤石油分馏装置 ⑥浓盐酸和二氧化锰混合加热制氯气 ⑦测定硝酸钾在水中的溶解度 ⑧食盐和浓硫酸混合加热制氯化氢
A
B
C
D
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是______________________。
答案:(1)A① B③⑤ C⑦
(2)减少苯的挥发(或冷凝回流作用)
9.碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如下图所示。
1.惰性电极 2.直流电源 3.离子交换膜 4.冷却水
请回答下列问题:
(1)碘是____(填颜色)固体物质,实验室常用______方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH===5KI+KIO3+3H2O
将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为____________________;阴极上观察到的实验现象是____________________。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
实验方法
实验现象及结论
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
步骤②的操作名称是______________,步骤⑤的操作名称是______________。步骤④洗涤晶体的目的是________________________________________________________________。
参考答案1.
答案:A 解析:医学上治疗由肾功能衰竭等疾病引起的血液中毒时,最常用的血液净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理和胶体的渗析类似,透析膜同半透膜类似,透析膜的孔径应大于血液病毒性物质的粒子直径,毒性物质才可能扩散到透析液中而被除去。蛋白质、血细胞的粒子不能透过透析膜,说明其直径大于透析膜的孔径。不难看出,A是正确的。
2.
答案:CD 解析:蒸发和蒸馏主要是从物质沸点的角度考虑。过滤主要是除去液体中不溶性固体,要考虑溶解性。萃取是利用溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液里提取出来的操作,也要考虑溶解性。3.
答案:D 解析:酒精和汽油均易燃烧,食盐水能达到比水更高的温度。
4.
答案:D 解析:蒸馏是分离沸点不同的液体混合物的方法之一;渗析是分离或提纯胶体的重要方法;过滤是分离固体和液体混合物的方法;只有D项是配制一定浓度溶液的操作步骤之一,不用于分离物质。
5.答案:CD 解析:必须了解各个实验步骤的目的,才能分清操作顺序。加入过量的NaOH溶液的目的是除去Mg2+,加入过量的BaCl2溶液是为了除去,加入过量的Na2CO3溶液是为了除去Ca2+及多余的Ba2+,然后进行过滤,除去Mg(OH)2、BaSO4、CaCO3、BaCO3、泥沙等难溶物,然后加适量的盐酸,除去多余的和调节溶液的酸碱性。综上所述,正确的实验操作顺序为C、D。
6.
答案:B 解析:乙酸乙酯在饱和碳酸钠溶液中溶解度很小,而乙酸和乙醇易溶于水,所以第一步用分液的方法;然后得到的A是乙酸钠和乙醇,由于乙酸钠的沸点高,故用蒸馏的方法分离;第三步,加硫酸将乙酸钠转变为乙酸,再蒸馏得到乙酸。7.
答案:(1)蒸馏 (2)结晶(或重结晶) (3)萃取
解析:蒸馏:根据物质的沸点不同,将物质由液态变成气态加以分离。结晶:根据溶质的溶解度随温度或溶剂量的改变而改变,将溶质从溶液中析出。萃取:根据物质在不同溶剂中溶解度的不同,将物质从溶解度较小的溶剂中提取到溶解度较大的溶剂中。
8.答案:(1)A① B③⑤ C⑦
(2)减少苯的挥发(或冷凝回流作用)
解析:A为测量或控制反应液温度;B为测量蒸馏出的气体的温度,一切蒸馏实验都适用;C为精确测定某溶液的温度;D为控制水浴温度,例如制硝基苯的实验。许多液体加热实验往往在塞子上加长玻璃管,一般是为了冷凝回流、避免某些易挥发物质损失的作用,即起冷凝器的作用。
9.
答案:(1)紫黑色 升华
(2)2I--2e-===I2(或I-+6OH--6e-===+3H2O)
有气泡产生
(3)
实验方法
实验现象及结论
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝
如果不变蓝,说明无I-(如果变蓝,说明有I-)
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
解析:(1)考查物质的物理性质,较容易。(2)阳极发生氧化反应失电子:2I--2e-===I2(或I-+6OH--6e-===+3H2O)。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水。(3)考查I-的检验,此题借助于碘单质遇淀粉变蓝这一特性,要设法将碘离子转化为碘单质。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
