第1章 物质及其变化复习
图片预览




文档简介
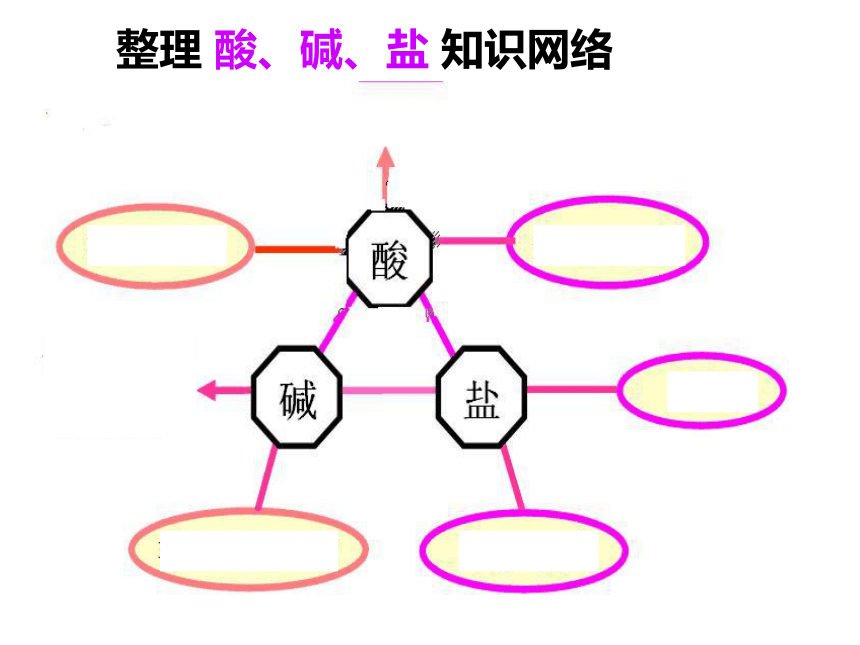
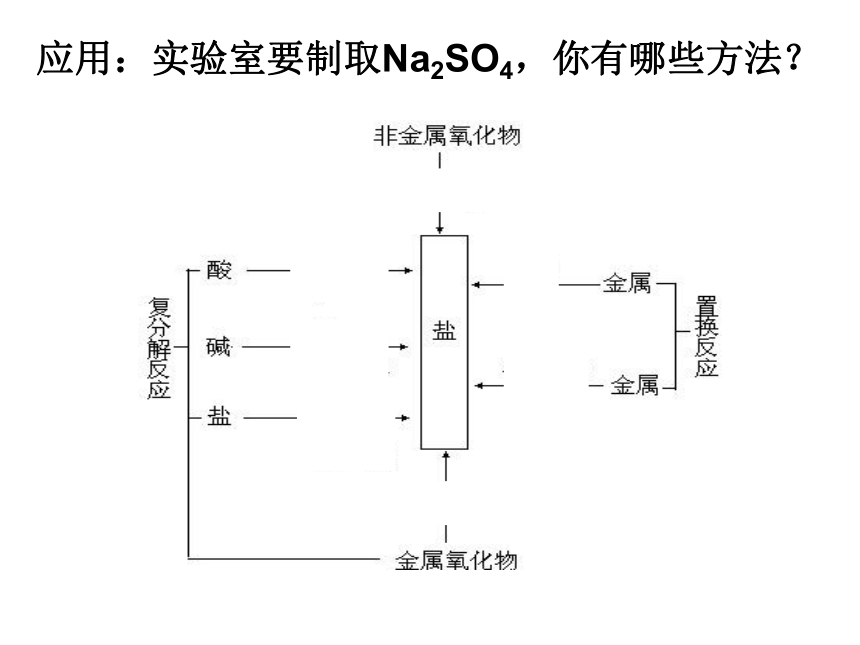
课件17张PPT。第一章 物质及其变化 复习整理 酸、碱、盐 知识网络应用:实验室要制取Na2SO4,你有哪些方法?1、下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、锌
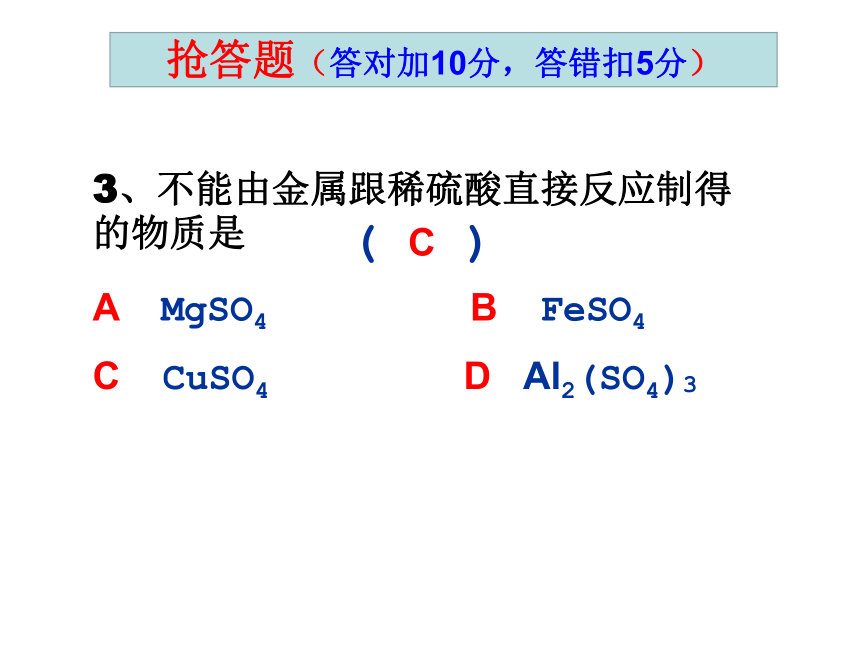
C、铁锈 D、氢氧化铜A抢答题(答对加10分,答错扣5分)C抢答题(答对加10分,答错扣5分)3、不能由金属跟稀硫酸直接反应制得的物质是
A MgSO4 B FeSO4
C CuSO4 D Al2(SO4)3
( C )抢答题(答对加10分,答错扣5分)
4、下列试剂分别加入到NaOH溶液、澄清石灰水和稀H2SO4中,能出现三种不同现象的是 ( )
A.KCl溶液 B.Na2CO3溶液
C.石蕊试液 D.CuCl2溶液
抢答题(答对加10分,答错扣5分)B 合作学习是解决疑难问题的好方法,请各小组同学在电脑题板的10道备选题中选择一题,讨论并解决。 说明:(1)先选题,再讨论。若无法选择该题,则 说明别组已选择了这道题,请另外选题。 (2)答题时将由老师指定组内任一成员回答, 故组内应充分合作,确保每个成员都会。 (3)选题和讨论时间限定在10分钟以内。 (4)各组选完以后,剩余的4题将作为抢答题, 请做好准备。必答题(答对加20分,答错不扣分)第1题第2题第3题第4题第5题第6题第7题第8题必答题(答对加20分,答错不扣分)问题1:Na2C03、AgN03、BaCl2、H2SO4、HCl、Ca(OH)2这六种物质相互之间最多能发生 个反应。12必答题(答对加20分,答错不扣分)问题2:某地有甲、乙两个工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-.两厂单独排放时,都会造成严重的水污染.如果将两厂的污水按一定比例混合,过滤沉淀后污水就变为无色澄清且只含NaNO3而排放,污染程度大大降低.关于污染源的分析,你认为正确的是( )
A.Cl-和NO3-一定来自不同的工厂
B.SO42-和NO3-可能来自同一工厂
C.Ag+和Na+可能来自同一工厂
D.Na+和NO3-可能来自不同工厂A必答题(答对加20分,答错不扣分)问题3:在托盘天平两盘上分别放有盛有等质量的稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8g镁条,向右边烧杯中加入10.8g铝条(两金属外形相同,表面均经过砂纸打磨处理),结果两边金属均有剩余。反应过程中指针偏转情况正确的是 ( )
A. 先偏左,最后偏右
B.先偏右,最后偏左
C.先偏左,最后平衡
D.先偏右,最后平衡D必答题1(答对加20分,答错不扣分)问题4:a、b、c、d可能是Na2CO3、AgNO3、BaCl2、HCl四种溶液中各一种,把它们两两混合后产生如下现象:
则:a是 ;
b是 ;
c是 ;
d是 。AgNO3Na2CO3HClBaCl2必答题(答对加20分,答错不扣分)问题5:为了除去粗盐中混有的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行操下列五项操作。你认为可能的操作顺序有 。
(填序号,至少写出两种可行顺序。)
a.过滤;b.加过量NaOH溶液;c.加适量HCl;d.加过量Na2CO3溶液;e.加过量BaCl2溶液。edbac;ebdac;bedac;必答题(答对加20分,答错不扣分)问题6:书写化学方程式
(1)烷烃(CnH2n)在空气中燃烧,生成二氧化碳和水 。
(2)铜不活泼,通常情况下与稀硫酸不反应,便向铜和稀硫酸混合物中滴入H2O2后,溶液很快变蓝色,试写出该反应的化学方程式 。Cu+H2O2+H2SO4=CuSO4+2H2O 计算题(答对加20分,答错扣0分)问题7、取一定量含有杂质的某金属R的样品,投入到73g质量分数为20%的盐酸中,金属与盐酸恰好完全反应(杂质不参加反应也不溶于水),测得所得金属氯化物中氯元素的质量分数质量分数为74.4%。?
计算:(1)样品中含金属R的质量????
?(2)所得溶液中溶质的质量分数?4.8g24.5% 计算题(答对加20分,答错扣0分)问题8:某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做的五次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,气体体积在相同条件下测定)。
实验编号 R的质量/g 稀硫酸的体积/mL 生成H2的体积/L
1 1.5 50.0 1.47
2 2.0 50.0 1.96
3 2.2 50.0 2.16
4 2.5 50.0 2.16
5 3.0 50.0 2.16
根据上述实验结果回答下列问题:
(1)上述实验中,金属一定过量的组的编号是 ,稀硫酸一定过量的组的编号是 。
(2)若在当时实验条件下,H2的密度为0.085g/L,则反应所用金属R的相对原子质量是多少?
(3)若所使用的稀硫酸密度为1.12g/cm3 ,则反应所用的硫酸溶液中溶质的质量分数是多少?4和5 1和22416%
A、盐酸 B、锌
C、铁锈 D、氢氧化铜A抢答题(答对加10分,答错扣5分)C抢答题(答对加10分,答错扣5分)3、不能由金属跟稀硫酸直接反应制得的物质是
A MgSO4 B FeSO4
C CuSO4 D Al2(SO4)3
( C )抢答题(答对加10分,答错扣5分)
4、下列试剂分别加入到NaOH溶液、澄清石灰水和稀H2SO4中,能出现三种不同现象的是 ( )
A.KCl溶液 B.Na2CO3溶液
C.石蕊试液 D.CuCl2溶液
抢答题(答对加10分,答错扣5分)B 合作学习是解决疑难问题的好方法,请各小组同学在电脑题板的10道备选题中选择一题,讨论并解决。 说明:(1)先选题,再讨论。若无法选择该题,则 说明别组已选择了这道题,请另外选题。 (2)答题时将由老师指定组内任一成员回答, 故组内应充分合作,确保每个成员都会。 (3)选题和讨论时间限定在10分钟以内。 (4)各组选完以后,剩余的4题将作为抢答题, 请做好准备。必答题(答对加20分,答错不扣分)第1题第2题第3题第4题第5题第6题第7题第8题必答题(答对加20分,答错不扣分)问题1:Na2C03、AgN03、BaCl2、H2SO4、HCl、Ca(OH)2这六种物质相互之间最多能发生 个反应。12必答题(答对加20分,答错不扣分)问题2:某地有甲、乙两个工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-.两厂单独排放时,都会造成严重的水污染.如果将两厂的污水按一定比例混合,过滤沉淀后污水就变为无色澄清且只含NaNO3而排放,污染程度大大降低.关于污染源的分析,你认为正确的是( )
A.Cl-和NO3-一定来自不同的工厂
B.SO42-和NO3-可能来自同一工厂
C.Ag+和Na+可能来自同一工厂
D.Na+和NO3-可能来自不同工厂A必答题(答对加20分,答错不扣分)问题3:在托盘天平两盘上分别放有盛有等质量的稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8g镁条,向右边烧杯中加入10.8g铝条(两金属外形相同,表面均经过砂纸打磨处理),结果两边金属均有剩余。反应过程中指针偏转情况正确的是 ( )
A. 先偏左,最后偏右
B.先偏右,最后偏左
C.先偏左,最后平衡
D.先偏右,最后平衡D必答题1(答对加20分,答错不扣分)问题4:a、b、c、d可能是Na2CO3、AgNO3、BaCl2、HCl四种溶液中各一种,把它们两两混合后产生如下现象:
则:a是 ;
b是 ;
c是 ;
d是 。AgNO3Na2CO3HClBaCl2必答题(答对加20分,答错不扣分)问题5:为了除去粗盐中混有的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行操下列五项操作。你认为可能的操作顺序有 。
(填序号,至少写出两种可行顺序。)
a.过滤;b.加过量NaOH溶液;c.加适量HCl;d.加过量Na2CO3溶液;e.加过量BaCl2溶液。edbac;ebdac;bedac;必答题(答对加20分,答错不扣分)问题6:书写化学方程式
(1)烷烃(CnH2n)在空气中燃烧,生成二氧化碳和水 。
(2)铜不活泼,通常情况下与稀硫酸不反应,便向铜和稀硫酸混合物中滴入H2O2后,溶液很快变蓝色,试写出该反应的化学方程式 。Cu+H2O2+H2SO4=CuSO4+2H2O 计算题(答对加20分,答错扣0分)问题7、取一定量含有杂质的某金属R的样品,投入到73g质量分数为20%的盐酸中,金属与盐酸恰好完全反应(杂质不参加反应也不溶于水),测得所得金属氯化物中氯元素的质量分数质量分数为74.4%。?
计算:(1)样品中含金属R的质量????
?(2)所得溶液中溶质的质量分数?4.8g24.5% 计算题(答对加20分,答错扣0分)问题8:某学生在课外活动中用一定量的二价金属R和稀硫酸反应来制取氢气,所做的五次实验结果记录如下表(假设每次实验所产生的氢气全部被收集,气体体积在相同条件下测定)。
实验编号 R的质量/g 稀硫酸的体积/mL 生成H2的体积/L
1 1.5 50.0 1.47
2 2.0 50.0 1.96
3 2.2 50.0 2.16
4 2.5 50.0 2.16
5 3.0 50.0 2.16
根据上述实验结果回答下列问题:
(1)上述实验中,金属一定过量的组的编号是 ,稀硫酸一定过量的组的编号是 。
(2)若在当时实验条件下,H2的密度为0.085g/L,则反应所用金属R的相对原子质量是多少?
(3)若所使用的稀硫酸密度为1.12g/cm3 ,则反应所用的硫酸溶液中溶质的质量分数是多少?4和5 1和22416%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
