水和溶液专题复习
图片预览









文档简介
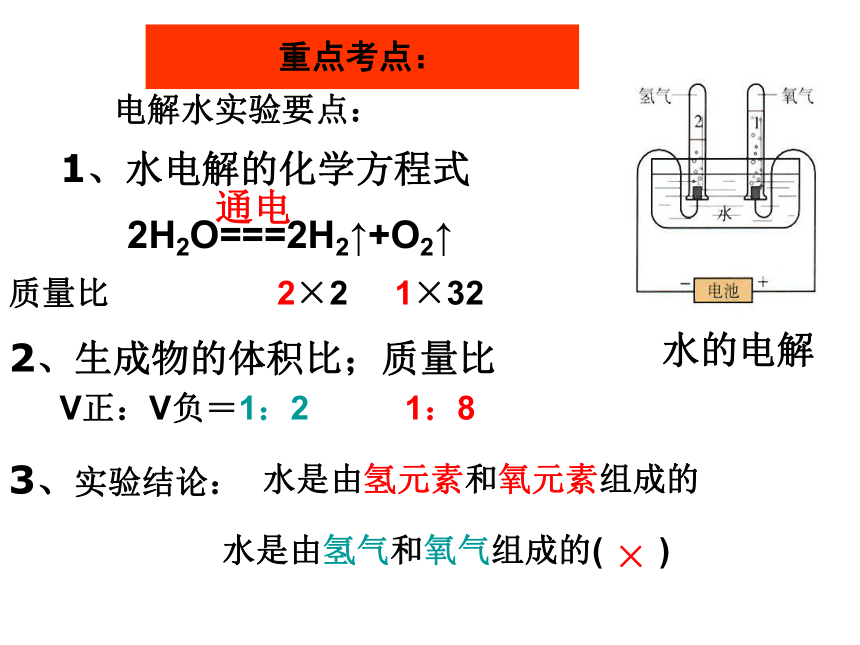
课件34张PPT。水的电解1、水电解的化学方程式2、生成物的体积比;质量比3、实验结论: 2H2O===2H2↑+O2↑通电质量比 2×2 1×32 重点考点:电解水实验要点:V正:V负=1:21:8水是由氢元素和氧元素组成的水是由氢气和氧气组成的( )×最轻的气体 1、最轻2、可以燃烧H23、未来的理想能源来源广泛,发热量高,没有污染要检验纯度!! 点燃
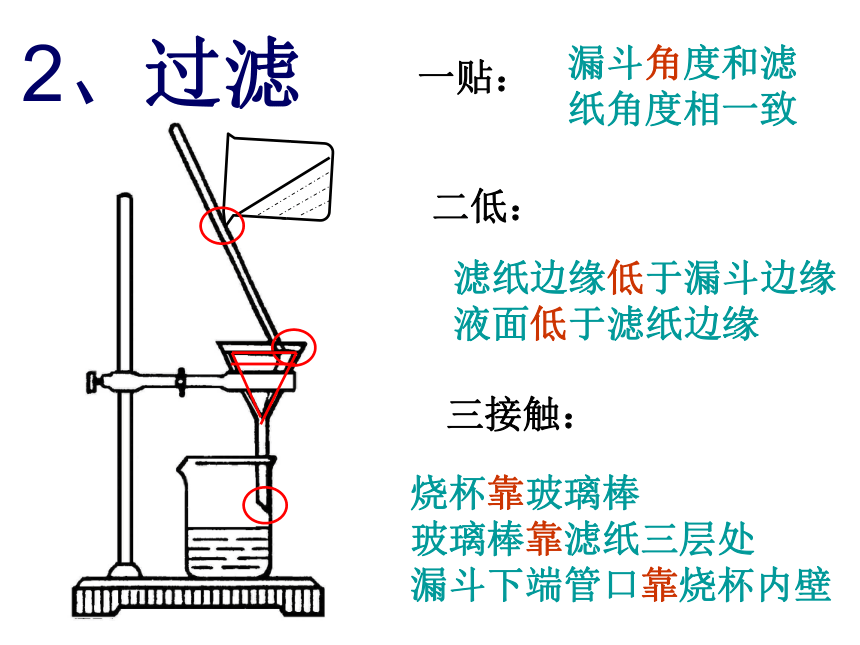
氢气 + 氧气─→ 水1. 沉淀法沉淀物让部分不可溶大颗粒的杂质沉到水底。净水剂除去悬浮在水中及浮于水面的固体物质。加入明矾水的净化一贴:二低:三接触:漏斗角度和滤
纸角度相一致滤纸边缘低于漏斗边缘
液面低于滤纸边缘烧杯靠玻璃棒
玻璃棒靠滤纸三层处
漏斗下端管口靠烧杯内壁2、过滤 在过滤实验中,有些同学得到的液体仍然是浑浊的,请你分析一下可能的原因。思考:(1) 滤纸破损(2) 漏斗内液面高于滤纸边缘(3) 仪器不干净问题二、 天然水经过沉淀、过滤、吸附等净化处理后,得到的水是否为纯净物?为什么? 不是;因为经过上述操作处理后除去的主要是不溶性杂质,水中还有许多可溶性杂质。净水器的原理 水的四种净化手段(物理方法)1、常见净化水的方法是: 、 、
、 。
2、净水过程中常用 吸附色素和异味;也可用 代替。
3、过滤操作要使用的仪器有:
、 、
、 。沉降过滤蒸馏吸附活性炭重点考点:铁架台烧杯玻璃棒 漏斗木炭练习题1.下列净化的操作,净化程度最高的是( )
(A)静置 (B)吸附
(C)过滤 (D)蒸馏
2.过滤时必须使用的一组仪器是( )
(A)蒸发皿、量筒、玻璃棒
(B)烧杯、漏斗、玻璃棒
(C)漏斗、试管、玻璃棒
(D)试管、坩埚钳、烧杯DB(2010年陕西)
16、Ⅱ、今春我国西南部分省区遭受百年不遇的特大干旱。一些灾区群众用水极其困难,他们在政府的帮助下,多方寻找水源。
(1)将浑浊的水变澄清的简单方法是 。
(2)将澄清的水煮沸,若水中出现较多水垢,该水为 (填“硬水”或“软水”)。中考真题再现过滤硬水定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶夜。均一性:指溶液任一部分的组成和性质相同
稳定性:在外界条件不变时,溶质不会溶剂中 分离出来
混合物:凡是溶液都属于混合物溶液的宏观特征 :(1)均一性 (2)稳定性
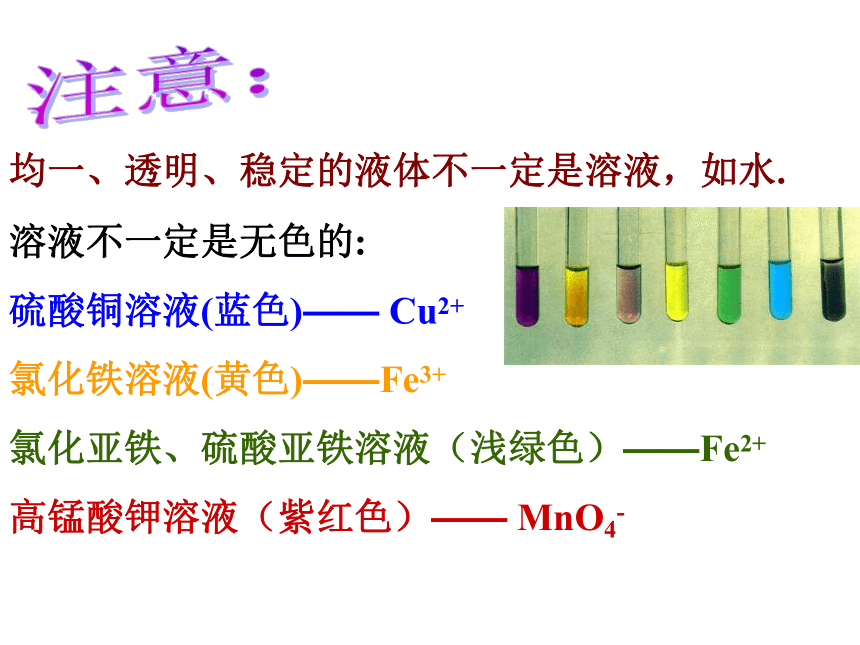
(3) 透明性一、溶液的概念均一、透明、稳定的液体不一定是溶液,如水.溶液不一定是无色的:
硫酸铜溶液(蓝色)—— Cu2+
氯化铁溶液(黄色)——Fe3+
氯化亚铁、硫酸亚铁溶液(浅绿色)——Fe2+
高锰酸钾溶液(紫红色)—— MnO4-注意:例:下列关于溶液的说法正确的是:A、均一、稳定的液体都是溶液
B、溶液是均一、稳定的纯净物
C、溶液是无色透明的液体
D、溶液是均一、稳定的混合物D例、下列说法正确的是:A、溶液一定是液体
B、空气也是溶液
C、50mL酒精和50mL水混合得到100mL溶液
D、盐水和糖水都是溶液,两者混合在一起,则不是溶液了B说明:
1。水是最常用的溶剂,最常见的溶液就是水溶液
2.汽油也可能做溶剂,它可以溶解油脂—用汽油洗油污.
3.酒精也可做溶剂,如溶解碘形成碘酒。 4。物质在溶解过程中发生了化学变化,在形成的溶液中,溶质是反应后的生成物,如:二氧化碳溶于水时,形成的溶液中溶质是碳酸,而不是二氧化碳. )1、把下列物质混合,能得到溶液的是 ( )
A.冰加到水中 B.植物油加到水中
C.碘加入酒精中 D.面粉加到水中练一练:2、填下表:CCa(OH)2水酒精水汽油花生油硫酸锌水CaCl2水Zn+H2SO4=ZnSO4+H2↑CaCO3+2HCl=CaCl2+H2O+CO2↑4、溶液一定是( )
A 化合物 B 单质 C 混合物 D 纯净物C5、下列各组物质中,前者是化合物,后
者是溶液的是( )
A 澄清石灰水、水 B 氧气、稀硫酸
C 空气、汽水 D 氯化氢气体、盐酸D6、下列各组物质混合形成的溶液中,前
者是溶剂,后者是溶质的一组是( )
A 糖、水 B 硫酸铜、水
C 酒精、碘 D 氢氧化钠、水C7、下列各组物质中,前者是后者的溶质
的是( )
A、氯化氢、盐酸 B、生石灰、石灰水
C、二氧化碳、碳酸溶液 D、氯化钠、食盐水AD物质溶解伴随能量的变化,表现温度的升降溶于水降低:生石灰、浓硫酸、氢氧化钠固体溶于水升高:硝酸铵物质溶解在水中(或受热熔化)时能
够产生自由移动的离子,这个过程叫电离。
如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是
A、活性炭 B、生石灰
C、硝酸铵 D、氢氧化钠
C.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是( )
A.硝酸铵和水 B.锌和稀硫酸
C.氯化钠和水 D.氢氧化钠和水
BD 乳化作用食用油在表面活性剂作用下,以细小的小液滴均匀分散在水中。洗发液、肥皂、沐浴露、洗涤剂、洗衣粉。常见的表面活性剂衣服上沾油污有几种洗法?汽 油:
洗衣粉:溶解功能
乳化作用(二)饱和溶液 不饱和溶液 知识回顾1.概念
(1)饱和溶液和不饱和溶液 在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.
讲溶液饱和或不饱和,一定要指明温度和溶剂质量.
讲饱和溶液或不饱和溶液一定要强调溶质
(2)浓溶液和稀溶液---粗略地表示溶液里溶质含量的多少 强调第二课时知识回顾2、饱和溶液和不饱和溶液的相互转化关系 ?
一般规律:不饱和溶液 饱和溶液
升温、蒸发溶剂、加溶质
特殊溶质Ca(OH)2不饱和溶液 饱和溶液
降温、加溶剂
记准降温、蒸发溶剂、加溶质升温、加溶剂1.在某一瓶某溶质的饱和溶液中,加入一些该溶质的 晶体,则( )
A 晶体质量减少 B 溶液中溶质质量增大
C 晶体质量不变 D溶液质量增大
2、将40℃时的KCl饱和溶液降温至10℃,然后将析出的晶体过滤;再将滤液恢复到 40℃,则该溶液与原溶液相比 ( )
A.还是饱和溶液 B.溶质的质量分数不变
C 溶质的质量没变 D.溶剂的质量不变CD2.固体物质的溶解度
(1)抓住的四个要点:
①“在一定温度下” ②“在100克溶剂
③“饱和状态”” ④“所溶解的克数”
(3)溶解性粗略地、定性地表示物质的溶解能力.而溶解度精确地、定量地衡量溶解性的大小.如20℃时溶解度与溶解性的关系见下表(S表示溶解度)
气体的溶解度与温度和压强有关,随温度升高而减小,随压强增大而增大 规律知识回顾饱和溶液析出晶体的方法:
(1)蒸发结晶:用于温度升高,溶解度变化不大的物质
(2)降温结晶:用于温度升高,溶解度变化大的物质 ?????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????配制溶质质量分数一定的氯化钠溶液步骤
1、计算:算出溶质质量,水的体积
2、称量:称固体质量,量液体体积
3、溶解
4、装入试剂瓶,贴上标签
·人教版 关于溶质质量分数的计算溶质溶液溶质溶剂溶液 溶解度与饱和溶液中溶质质量分数互算关系现有100g溶质的质量分数为10%的氯化钠溶液,为使其溶质质量分数增大一倍,应蒸发掉水
g或加入 g氯化钠;为使其溶质的质量分数减少一半,应加入水的质量为 g5012.5100解:(1)设蒸发掉水的质量为x,或加入氯化钠的质量为为y
100g×10%=(100g-x) ×20% 100g×10%+y=(100g+y) ×20%
x=50g y=12.5g
(2)设为使其溶质的质量分数减少一半,应加入水的质量为z
100g×10%=(100g+z) ×5%
z=100g例题1:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的 硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%答:略需要水的质量= 245 g– 50g = 195g注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题2:100g 9.8%硫酸跟多少克锌反应?同时生成
多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 100gX9.8%= 9.8g练习1:实验室用100g稀硫酸和一定量的锌完全反应
在,制得0.8g氢气。求该稀硫酸溶质的质量分数。解:设稀硫酸溶质的质量分数为x%H2SO4 + Zn = ZnSO4 + H2?98 2100g? x% 0.8gX%==39.2%答:略??1、100克40%的氢氧化钠溶液恰好与200克硫酸铜溶液完全反应,求:
(1)生成沉淀多少克?
(2)硫酸铜溶液中溶质质量分数?
*(3)生成物溶液中溶质质量分数?
拓展练习 1:
氢气 + 氧气─→ 水1. 沉淀法沉淀物让部分不可溶大颗粒的杂质沉到水底。净水剂除去悬浮在水中及浮于水面的固体物质。加入明矾水的净化一贴:二低:三接触:漏斗角度和滤
纸角度相一致滤纸边缘低于漏斗边缘
液面低于滤纸边缘烧杯靠玻璃棒
玻璃棒靠滤纸三层处
漏斗下端管口靠烧杯内壁2、过滤 在过滤实验中,有些同学得到的液体仍然是浑浊的,请你分析一下可能的原因。思考:(1) 滤纸破损(2) 漏斗内液面高于滤纸边缘(3) 仪器不干净问题二、 天然水经过沉淀、过滤、吸附等净化处理后,得到的水是否为纯净物?为什么? 不是;因为经过上述操作处理后除去的主要是不溶性杂质,水中还有许多可溶性杂质。净水器的原理 水的四种净化手段(物理方法)1、常见净化水的方法是: 、 、
、 。
2、净水过程中常用 吸附色素和异味;也可用 代替。
3、过滤操作要使用的仪器有:
、 、
、 。沉降过滤蒸馏吸附活性炭重点考点:铁架台烧杯玻璃棒 漏斗木炭练习题1.下列净化的操作,净化程度最高的是( )
(A)静置 (B)吸附
(C)过滤 (D)蒸馏
2.过滤时必须使用的一组仪器是( )
(A)蒸发皿、量筒、玻璃棒
(B)烧杯、漏斗、玻璃棒
(C)漏斗、试管、玻璃棒
(D)试管、坩埚钳、烧杯DB(2010年陕西)
16、Ⅱ、今春我国西南部分省区遭受百年不遇的特大干旱。一些灾区群众用水极其困难,他们在政府的帮助下,多方寻找水源。
(1)将浑浊的水变澄清的简单方法是 。
(2)将澄清的水煮沸,若水中出现较多水垢,该水为 (填“硬水”或“软水”)。中考真题再现过滤硬水定义:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶夜。均一性:指溶液任一部分的组成和性质相同
稳定性:在外界条件不变时,溶质不会溶剂中 分离出来
混合物:凡是溶液都属于混合物溶液的宏观特征 :(1)均一性 (2)稳定性
(3) 透明性一、溶液的概念均一、透明、稳定的液体不一定是溶液,如水.溶液不一定是无色的:
硫酸铜溶液(蓝色)—— Cu2+
氯化铁溶液(黄色)——Fe3+
氯化亚铁、硫酸亚铁溶液(浅绿色)——Fe2+
高锰酸钾溶液(紫红色)—— MnO4-注意:例:下列关于溶液的说法正确的是:A、均一、稳定的液体都是溶液
B、溶液是均一、稳定的纯净物
C、溶液是无色透明的液体
D、溶液是均一、稳定的混合物D例、下列说法正确的是:A、溶液一定是液体
B、空气也是溶液
C、50mL酒精和50mL水混合得到100mL溶液
D、盐水和糖水都是溶液,两者混合在一起,则不是溶液了B说明:
1。水是最常用的溶剂,最常见的溶液就是水溶液
2.汽油也可能做溶剂,它可以溶解油脂—用汽油洗油污.
3.酒精也可做溶剂,如溶解碘形成碘酒。 4。物质在溶解过程中发生了化学变化,在形成的溶液中,溶质是反应后的生成物,如:二氧化碳溶于水时,形成的溶液中溶质是碳酸,而不是二氧化碳. )1、把下列物质混合,能得到溶液的是 ( )
A.冰加到水中 B.植物油加到水中
C.碘加入酒精中 D.面粉加到水中练一练:2、填下表:CCa(OH)2水酒精水汽油花生油硫酸锌水CaCl2水Zn+H2SO4=ZnSO4+H2↑CaCO3+2HCl=CaCl2+H2O+CO2↑4、溶液一定是( )
A 化合物 B 单质 C 混合物 D 纯净物C5、下列各组物质中,前者是化合物,后
者是溶液的是( )
A 澄清石灰水、水 B 氧气、稀硫酸
C 空气、汽水 D 氯化氢气体、盐酸D6、下列各组物质混合形成的溶液中,前
者是溶剂,后者是溶质的一组是( )
A 糖、水 B 硫酸铜、水
C 酒精、碘 D 氢氧化钠、水C7、下列各组物质中,前者是后者的溶质
的是( )
A、氯化氢、盐酸 B、生石灰、石灰水
C、二氧化碳、碳酸溶液 D、氯化钠、食盐水AD物质溶解伴随能量的变化,表现温度的升降溶于水降低:生石灰、浓硫酸、氢氧化钠固体溶于水升高:硝酸铵物质溶解在水中(或受热熔化)时能
够产生自由移动的离子,这个过程叫电离。
如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是
A、活性炭 B、生石灰
C、硝酸铵 D、氢氧化钠
C.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是( )
A.硝酸铵和水 B.锌和稀硫酸
C.氯化钠和水 D.氢氧化钠和水
BD 乳化作用食用油在表面活性剂作用下,以细小的小液滴均匀分散在水中。洗发液、肥皂、沐浴露、洗涤剂、洗衣粉。常见的表面活性剂衣服上沾油污有几种洗法?汽 油:
洗衣粉:溶解功能
乳化作用(二)饱和溶液 不饱和溶液 知识回顾1.概念
(1)饱和溶液和不饱和溶液 在一定温度下,在一定量溶剂里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液.
讲溶液饱和或不饱和,一定要指明温度和溶剂质量.
讲饱和溶液或不饱和溶液一定要强调溶质
(2)浓溶液和稀溶液---粗略地表示溶液里溶质含量的多少 强调第二课时知识回顾2、饱和溶液和不饱和溶液的相互转化关系 ?
一般规律:不饱和溶液 饱和溶液
升温、蒸发溶剂、加溶质
特殊溶质Ca(OH)2不饱和溶液 饱和溶液
降温、加溶剂
记准降温、蒸发溶剂、加溶质升温、加溶剂1.在某一瓶某溶质的饱和溶液中,加入一些该溶质的 晶体,则( )
A 晶体质量减少 B 溶液中溶质质量增大
C 晶体质量不变 D溶液质量增大
2、将40℃时的KCl饱和溶液降温至10℃,然后将析出的晶体过滤;再将滤液恢复到 40℃,则该溶液与原溶液相比 ( )
A.还是饱和溶液 B.溶质的质量分数不变
C 溶质的质量没变 D.溶剂的质量不变CD2.固体物质的溶解度
(1)抓住的四个要点:
①“在一定温度下” ②“在100克溶剂
③“饱和状态”” ④“所溶解的克数”
(3)溶解性粗略地、定性地表示物质的溶解能力.而溶解度精确地、定量地衡量溶解性的大小.如20℃时溶解度与溶解性的关系见下表(S表示溶解度)
气体的溶解度与温度和压强有关,随温度升高而减小,随压强增大而增大 规律知识回顾饱和溶液析出晶体的方法:
(1)蒸发结晶:用于温度升高,溶解度变化不大的物质
(2)降温结晶:用于温度升高,溶解度变化大的物质 ?????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????配制溶质质量分数一定的氯化钠溶液步骤
1、计算:算出溶质质量,水的体积
2、称量:称固体质量,量液体体积
3、溶解
4、装入试剂瓶,贴上标签
·人教版 关于溶质质量分数的计算溶质溶液溶质溶剂溶液 溶解度与饱和溶液中溶质质量分数互算关系现有100g溶质的质量分数为10%的氯化钠溶液,为使其溶质质量分数增大一倍,应蒸发掉水
g或加入 g氯化钠;为使其溶质的质量分数减少一半,应加入水的质量为 g5012.5100解:(1)设蒸发掉水的质量为x,或加入氯化钠的质量为为y
100g×10%=(100g-x) ×20% 100g×10%+y=(100g+y) ×20%
x=50g y=12.5g
(2)设为使其溶质的质量分数减少一半,应加入水的质量为z
100g×10%=(100g+z) ×5%
z=100g例题1:化学实验室现有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的 硫酸溶液需要多少克水?解:设稀释后溶液的质量为x50g ?98% = X ?20%答:略需要水的质量= 245 g– 50g = 195g注意点:溶液是混合物,溶液的质量不能直接代入
化学方程式中计算,必须换算成溶质的质量。例题2:100g 9.8%硫酸跟多少克锌反应?同时生成
多少克氢气?解:100g9.8%硫酸中含纯硫酸的质量为:设参加反应的锌质量为X ,生成氢气的质量为YZn + H2SO4 = ZnSO4 + H2?65 98 2X 9.8g YX=6.5g Y=0.2g答:略[题型四]: 有关化学方程式的计算 100gX9.8%= 9.8g练习1:实验室用100g稀硫酸和一定量的锌完全反应
在,制得0.8g氢气。求该稀硫酸溶质的质量分数。解:设稀硫酸溶质的质量分数为x%H2SO4 + Zn = ZnSO4 + H2?98 2100g? x% 0.8gX%==39.2%答:略??1、100克40%的氢氧化钠溶液恰好与200克硫酸铜溶液完全反应,求:
(1)生成沉淀多少克?
(2)硫酸铜溶液中溶质质量分数?
*(3)生成物溶液中溶质质量分数?
拓展练习 1:
