2017年中考化学沪教版专题复习教学案 图表应用题(含答案)
文档属性
| 名称 | 2017年中考化学沪教版专题复习教学案 图表应用题(含答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 1007.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-05-17 00:00:00 | ||
图片预览

文档简介
2017年中考化学专题复习
图表应用题
【题型概述】
图表题是近年来中考化学的热点题型,它具有图文并茂、知识覆盖面广、综合性强等特点,既能够提高同学们的解题兴趣,又可以培养同学们识图及综合运用化学知识解决实际问题的能力。图表题属于综合性较强的题型,基本形式是先给出一定量的图表信息,主要考查学生对图形和图表的观察,获取有关的感性知识和印象,并运用分析、比较、概括、归纳等方法对所获取的信息进行初步的加工和应用的能力。
【解题方法】
解图表类试题的一般步骤:第一审题:认真审读原题,弄清文意和图意,理出题给条件,深挖细找,反复推敲;第二分析:抓住关键,找准解题的突破口,并从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果;第三解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答,第四检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确;若出现不符,则说明答案有误,需要另行思考,推出正确答案。
【真题精讲】
类型一
坐标图像类
例1.(2016·湖南衡阳)下列图像能正确反映其对应关系的是(
)。
A.①某温度下,向一定量的硝酸钾不饱和溶液中不断加入硝酸钾晶体
B.②在两份等质量、等溶质质量分数的过氧化氢溶液中,一份加催化剂,一份不加催化剂
C.③通电使水分解
D.④向盛有等质量、等溶质质量分数的稀硫酸的两支试管中,分别加入过量的镁和铝
【解析】不饱和的硝酸钾溶液,再加入硝酸钾固体还能继续溶解,等到饱和后硝酸钾不再溶解,所以溶质的质量分数也不会再改变,A正确;催化剂会加快过氧化氢分解的速率,不会改变氧气量的多少,加催化剂和不加催化剂放出的氧气量相同,只是反应时间的不同,B错误;电解水时生成的氢气和氧气的体积比是2:1,C错误;将过量的镁片和铝片分别和等质量、等溶质质量分数的稀盐酸混合,则酸全部参加反应,最后生成的氢气质量相同,图中横坐标表示的是金属的质量,当加入少量金属时,等质量的Al和Mg,Al产生氢气的质量比Mg多,因此Al所对应的曲线在Mg的上方,图像符合该特点,D正确。
【答案】AD
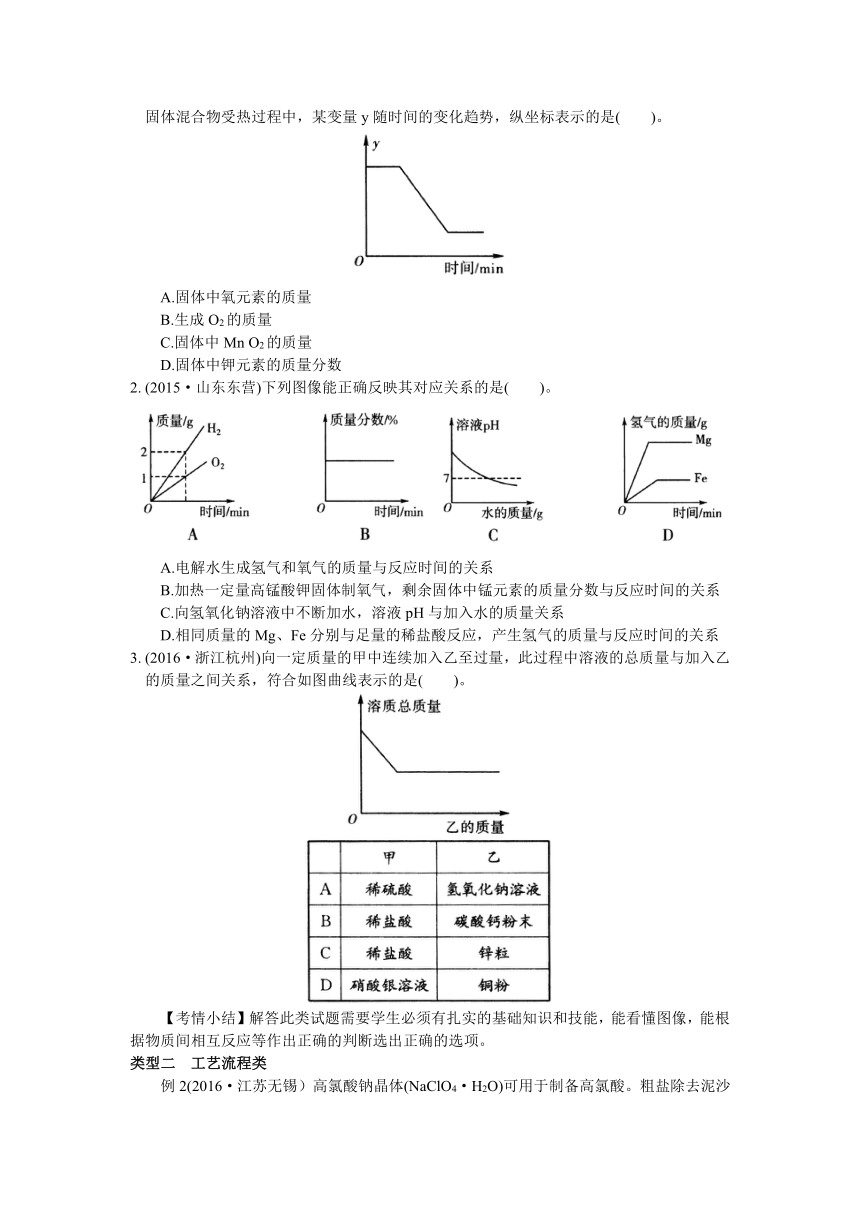
1.
(2015·北京)已知,下图表示一定质量的KCLO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是(
)。
A.固体中氧元素的质量
B.生成O2的质量
C.固体中Mn
O2的质量
D.固体中钾元素的质量分数
2.
(2015·山东东营)下列图像能正确反映其对应关系的是(
)。
A.电解水生成氢气和氧气的质量与反应时间的关系
B.加热一定量高锰酸钾固体制氧气,剩余固体中锰元素的质量分数与反应时间的关系
C.向氢氧化钠溶液中不断加水,溶液pH与加入水的质量关系
D.相同质量的Mg、Fe分别与足量的稀盐酸反应,产生氢气的质量与反应时间的关系
3.
(2016·浙江杭州)向一定质量的甲中连续加入乙至过量,此过程中溶液的总质量与加入乙的质量之间关系,符合如图曲线表示的是(
)。
【考情小结】解答此类试题需要学生必须有扎实的基础知识和技能,能看懂图像,能根据物质间相互反应等作出正确的判断选出正确的选项。
类型二
工艺流程类
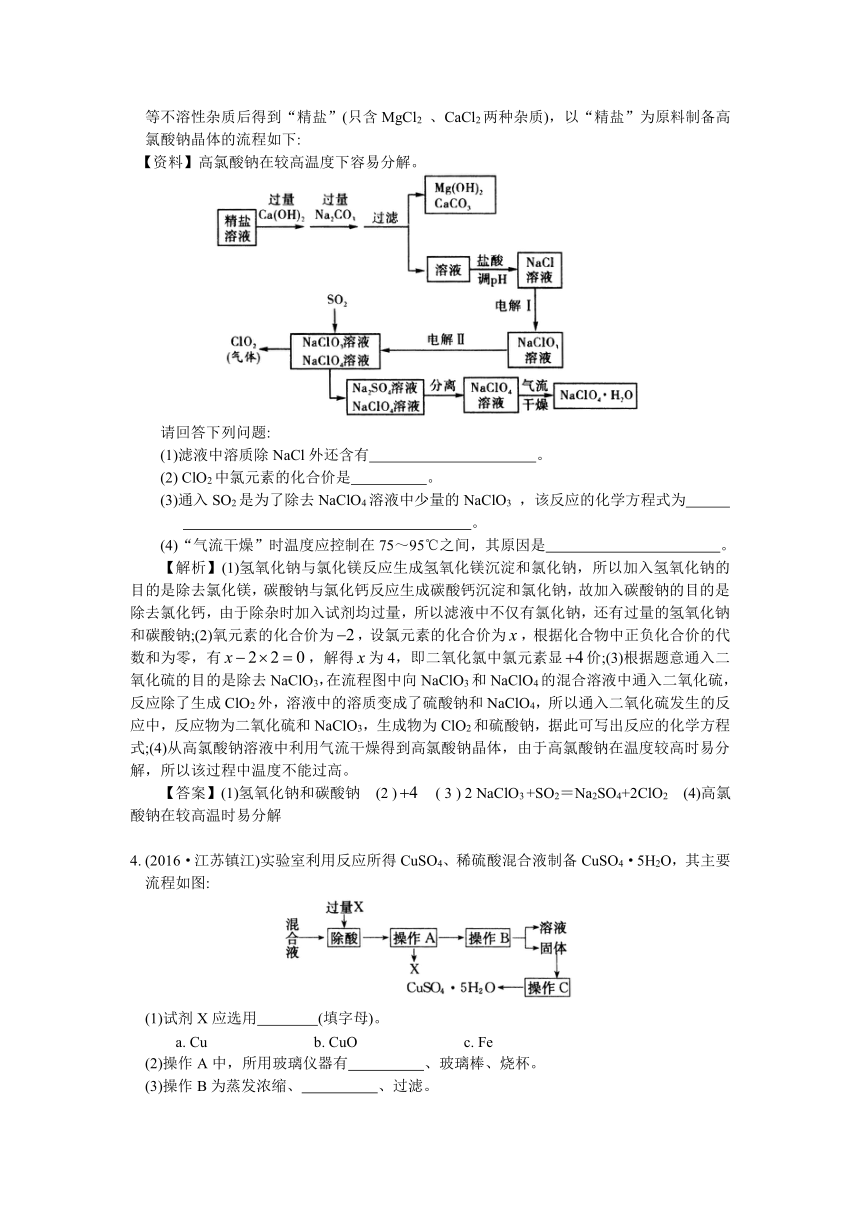
例2(2016·江苏无锡)高氯酸钠晶体(NaClO4·H2O)可用于制备高氯酸。粗盐除去泥沙等不溶性杂质后得到“精盐”(只含MgCl2
、CaCl2两种杂质),以“精盐”为原料制备高氯酸钠晶体的流程如下:
【资料】高氯酸钠在较高温度下容易分解。
请回答下列问题:
(1)滤液中溶质除NaCl外还含有
。
(2)
ClO2中氯元素的化合价是
。
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3
,该反应的化学方程式为
。
(4)“气流干燥”时温度应控制在75~95℃之间,其原因是
。
【解析】(1)氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入氢氧化钠的目的是除去氯化镁,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,故加入碳酸钠的目的是除去氯化钙,由于除杂时加入试剂均过量,所以滤液中不仅有氯化钠,还有过量的氢氧化钠和碳酸钠;(2)氧元素的化合价为,设氯元素的化合价为,根据化合物中正负化合价的代数和为零,有,解得为4,即二氧化氯中氯元素显价;(3)根据题意通入二氧化硫的目的是除去NaClO3,在流程图中向NaClO3和NaClO4的混合溶液中通入二氧化硫,反应除了生成ClO2外,溶液中的溶质变成了硫酸钠和NaClO4,所以通入二氧化硫发生的反应中,反应物为二氧化硫和NaClO3,生成物为ClO2和硫酸钠,据此可写出反应的化学方程式;(4)从高氯酸钠溶液中利用气流干燥得到高氯酸钠晶体,由于高氯酸钠在温度较高时易分解,所以该过程中温度不能过高。
【答案】(1)氢氧化钠和碳酸钠
(2
)
(
3
)
2
NaClO3
+SO2=Na2SO4+2ClO2
(4)高氯酸钠在较高温时易分解
4.
(2016·江苏镇江)实验室利用反应所得CuSO4、稀硫酸混合液制备CuSO4·5H2O,其主要流程如图:
(1)试剂X应选用
(填字母)。
a.
Cu
b.
CuO
c.
Fe
(2)操作A中,所用玻璃仪器有
、玻璃棒、烧杯。
(3)操作B为蒸发浓缩、
、过滤。
(4)操作C为洗涤、低温干燥,其中洗涤剂不可选用
(填字母)。
a.热水
b.冰水
c.饱和CuSO4溶液
5.
(2015·江苏无锡)工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:
已知相关物质的溶解度(20℃)如下表
(1)
KMnO4中锰元素的化合价为
。
(2)操作I的名称是
。“干燥”过程中温度不宜过高的原因是
(用化学方程式表示)。
(3)“通CO2酸化”,反应的化学方程式为
3
K2MnO4+
2CO2=2KMnO4十MnO2↓+2K2CO3
若用稀硫酸酸化,反应的化学方程式为:
3
K2MnO4+
2H2SO4=2KMnO4+
MnO2↓+2K2SO4+2H2O
工业上不采用稀硫酸酸化的原因是
。
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为。与“通CO2酸化”相比,其优点是
。
6.
(2016·贵州遵义)氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如下:
(1)请写出步骤一中发生反应的化学方程式:
(任写一个)。
(2)溶液A中所含的阳离子有
(填离子符号)。
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
步骤二中加入熟石灰,调节溶液的pH范围为
。
(4)3个步骤中均用到的操作是
。
(5)步骤三中生成产品的化学方程式为
。
7.
(2015·江苏淮安)能源和环境成为人们日益关注的问题。目前煤炭在我国能源结构中占有的比例最大。
(1)我国正在推广家庭中用天然气逐步代替煤作燃料,天然气的主要成分是
。
(2)含硫煤燃烧会产生大气污染,其中二氧化硫排放到空气中会导致的环境问题是
。
(3)为防治该污染,某工厂设计了新的治污方法,不仅吸收了二氧化硫,还得到了某种化工产品,该工艺流程如下图所示:
①Fe2(
SO4)3和H2O吸收SO2生成FeSO4和H2SO4的化学方程式是
。
②该过程中可得到的化工产品是
。
(4)为应对人们对能源和环保的需求,需要“节约现有能源、开发新能源、环保与发展共进”,下列做法符合该理念的有
(填序号)。
①屋顶安装太阳能发电装置
②焚烧田间秸秆,草木灰返田
③优化建筑设计,减少空调使用
④乘坐轨道交通,减少私家车使用
【考情小结】此类试题主要考查常见物质间的相互转化,可以利用物质的性质解答。解答此类试题时应掌握常见物质的性质、根据物质的性质以及题意合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提。
参考答案
1.
A
2.
D
3.
D
4.
(1)
b
(2)漏斗
(3)降温结晶
(4)a
5.
(1)+7
(2)过滤
(3)有K2
SO4生成,而K2
SO4的溶解度和KMnO4溶解度相差不多,KMnO4与之难以分离
(4)生成的氢氧化钾可以循环使用
6.
(1)
MgO+2HCl=MgCl2+H2O(或Fe2O3+6
HCl=2FeCl3+3H2O或CuO+2HCl=CuCl2+H2O)
(2)
Mg2+、Fe3+、Cu2+、H+
(3)
6.7~9.1
(4)
过滤
(5)
MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
7.
(1)
甲烷(或CH4)
(2)
酸雨
(3)①Fe2(SO4)3+2H2O+SO2=2FeSO4+2H2SO4
②
H2SO4
(4)
①③④
图表应用题
【题型概述】
图表题是近年来中考化学的热点题型,它具有图文并茂、知识覆盖面广、综合性强等特点,既能够提高同学们的解题兴趣,又可以培养同学们识图及综合运用化学知识解决实际问题的能力。图表题属于综合性较强的题型,基本形式是先给出一定量的图表信息,主要考查学生对图形和图表的观察,获取有关的感性知识和印象,并运用分析、比较、概括、归纳等方法对所获取的信息进行初步的加工和应用的能力。
【解题方法】
解图表类试题的一般步骤:第一审题:认真审读原题,弄清文意和图意,理出题给条件,深挖细找,反复推敲;第二分析:抓住关键,找准解题的突破口,并从突破口出发,探求知识间的内在联系,应用多种思维方式,进行严密的分析和逻辑推理,推出符合题意的结果;第三解答:根据题目的要求,按照分析和推理的结果,认真而全面地解答,第四检验:得出结论后切勿忘记验证。其方法是将所得答案放回原题中检验,若完全符合,则说明答案正确;若出现不符,则说明答案有误,需要另行思考,推出正确答案。
【真题精讲】
类型一
坐标图像类
例1.(2016·湖南衡阳)下列图像能正确反映其对应关系的是(
)。
A.①某温度下,向一定量的硝酸钾不饱和溶液中不断加入硝酸钾晶体
B.②在两份等质量、等溶质质量分数的过氧化氢溶液中,一份加催化剂,一份不加催化剂
C.③通电使水分解
D.④向盛有等质量、等溶质质量分数的稀硫酸的两支试管中,分别加入过量的镁和铝
【解析】不饱和的硝酸钾溶液,再加入硝酸钾固体还能继续溶解,等到饱和后硝酸钾不再溶解,所以溶质的质量分数也不会再改变,A正确;催化剂会加快过氧化氢分解的速率,不会改变氧气量的多少,加催化剂和不加催化剂放出的氧气量相同,只是反应时间的不同,B错误;电解水时生成的氢气和氧气的体积比是2:1,C错误;将过量的镁片和铝片分别和等质量、等溶质质量分数的稀盐酸混合,则酸全部参加反应,最后生成的氢气质量相同,图中横坐标表示的是金属的质量,当加入少量金属时,等质量的Al和Mg,Al产生氢气的质量比Mg多,因此Al所对应的曲线在Mg的上方,图像符合该特点,D正确。
【答案】AD
1.
(2015·北京)已知,下图表示一定质量的KCLO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是(
)。
A.固体中氧元素的质量
B.生成O2的质量
C.固体中Mn
O2的质量
D.固体中钾元素的质量分数
2.
(2015·山东东营)下列图像能正确反映其对应关系的是(
)。
A.电解水生成氢气和氧气的质量与反应时间的关系
B.加热一定量高锰酸钾固体制氧气,剩余固体中锰元素的质量分数与反应时间的关系
C.向氢氧化钠溶液中不断加水,溶液pH与加入水的质量关系
D.相同质量的Mg、Fe分别与足量的稀盐酸反应,产生氢气的质量与反应时间的关系
3.
(2016·浙江杭州)向一定质量的甲中连续加入乙至过量,此过程中溶液的总质量与加入乙的质量之间关系,符合如图曲线表示的是(
)。
【考情小结】解答此类试题需要学生必须有扎实的基础知识和技能,能看懂图像,能根据物质间相互反应等作出正确的判断选出正确的选项。
类型二
工艺流程类
例2(2016·江苏无锡)高氯酸钠晶体(NaClO4·H2O)可用于制备高氯酸。粗盐除去泥沙等不溶性杂质后得到“精盐”(只含MgCl2
、CaCl2两种杂质),以“精盐”为原料制备高氯酸钠晶体的流程如下:
【资料】高氯酸钠在较高温度下容易分解。
请回答下列问题:
(1)滤液中溶质除NaCl外还含有
。
(2)
ClO2中氯元素的化合价是
。
(3)通入SO2是为了除去NaClO4溶液中少量的NaClO3
,该反应的化学方程式为
。
(4)“气流干燥”时温度应控制在75~95℃之间,其原因是
。
【解析】(1)氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠,所以加入氢氧化钠的目的是除去氯化镁,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,故加入碳酸钠的目的是除去氯化钙,由于除杂时加入试剂均过量,所以滤液中不仅有氯化钠,还有过量的氢氧化钠和碳酸钠;(2)氧元素的化合价为,设氯元素的化合价为,根据化合物中正负化合价的代数和为零,有,解得为4,即二氧化氯中氯元素显价;(3)根据题意通入二氧化硫的目的是除去NaClO3,在流程图中向NaClO3和NaClO4的混合溶液中通入二氧化硫,反应除了生成ClO2外,溶液中的溶质变成了硫酸钠和NaClO4,所以通入二氧化硫发生的反应中,反应物为二氧化硫和NaClO3,生成物为ClO2和硫酸钠,据此可写出反应的化学方程式;(4)从高氯酸钠溶液中利用气流干燥得到高氯酸钠晶体,由于高氯酸钠在温度较高时易分解,所以该过程中温度不能过高。
【答案】(1)氢氧化钠和碳酸钠
(2
)
(
3
)
2
NaClO3
+SO2=Na2SO4+2ClO2
(4)高氯酸钠在较高温时易分解
4.
(2016·江苏镇江)实验室利用反应所得CuSO4、稀硫酸混合液制备CuSO4·5H2O,其主要流程如图:
(1)试剂X应选用
(填字母)。
a.
Cu
b.
CuO
c.
Fe
(2)操作A中,所用玻璃仪器有
、玻璃棒、烧杯。
(3)操作B为蒸发浓缩、
、过滤。
(4)操作C为洗涤、低温干燥,其中洗涤剂不可选用
(填字母)。
a.热水
b.冰水
c.饱和CuSO4溶液
5.
(2015·江苏无锡)工业上以高纯度的二氧化锰为原料制备高锰酸钾的主要流程如下:
已知相关物质的溶解度(20℃)如下表
(1)
KMnO4中锰元素的化合价为
。
(2)操作I的名称是
。“干燥”过程中温度不宜过高的原因是
(用化学方程式表示)。
(3)“通CO2酸化”,反应的化学方程式为
3
K2MnO4+
2CO2=2KMnO4十MnO2↓+2K2CO3
若用稀硫酸酸化,反应的化学方程式为:
3
K2MnO4+
2H2SO4=2KMnO4+
MnO2↓+2K2SO4+2H2O
工业上不采用稀硫酸酸化的原因是
。
(4)电解法也可以实现由K2MnO4向KMnO4的转化,反应的化学方程式为。与“通CO2酸化”相比,其优点是
。
6.
(2016·贵州遵义)氢氧化镁是一种重要的化工原料,某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如下:
(1)请写出步骤一中发生反应的化学方程式:
(任写一个)。
(2)溶液A中所含的阳离子有
(填离子符号)。
(3)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
步骤二中加入熟石灰,调节溶液的pH范围为
。
(4)3个步骤中均用到的操作是
。
(5)步骤三中生成产品的化学方程式为
。
7.
(2015·江苏淮安)能源和环境成为人们日益关注的问题。目前煤炭在我国能源结构中占有的比例最大。
(1)我国正在推广家庭中用天然气逐步代替煤作燃料,天然气的主要成分是
。
(2)含硫煤燃烧会产生大气污染,其中二氧化硫排放到空气中会导致的环境问题是
。
(3)为防治该污染,某工厂设计了新的治污方法,不仅吸收了二氧化硫,还得到了某种化工产品,该工艺流程如下图所示:
①Fe2(
SO4)3和H2O吸收SO2生成FeSO4和H2SO4的化学方程式是
。
②该过程中可得到的化工产品是
。
(4)为应对人们对能源和环保的需求,需要“节约现有能源、开发新能源、环保与发展共进”,下列做法符合该理念的有
(填序号)。
①屋顶安装太阳能发电装置
②焚烧田间秸秆,草木灰返田
③优化建筑设计,减少空调使用
④乘坐轨道交通,减少私家车使用
【考情小结】此类试题主要考查常见物质间的相互转化,可以利用物质的性质解答。解答此类试题时应掌握常见物质的性质、根据物质的性质以及题意合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提。
参考答案
1.
A
2.
D
3.
D
4.
(1)
b
(2)漏斗
(3)降温结晶
(4)a
5.
(1)+7
(2)过滤
(3)有K2
SO4生成,而K2
SO4的溶解度和KMnO4溶解度相差不多,KMnO4与之难以分离
(4)生成的氢氧化钾可以循环使用
6.
(1)
MgO+2HCl=MgCl2+H2O(或Fe2O3+6
HCl=2FeCl3+3H2O或CuO+2HCl=CuCl2+H2O)
(2)
Mg2+、Fe3+、Cu2+、H+
(3)
6.7~9.1
(4)
过滤
(5)
MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓
7.
(1)
甲烷(或CH4)
(2)
酸雨
(3)①Fe2(SO4)3+2H2O+SO2=2FeSO4+2H2SO4
②
H2SO4
(4)
①③④
同课章节目录
