江苏省盐城市阜宁县2016-2017学年高一下学期期中考试化学试题
文档属性
| 名称 | 江苏省盐城市阜宁县2016-2017学年高一下学期期中考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 314.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-05-24 14:44:26 | ||
图片预览

文档简介
高一年级期中学情调研
化
学
试
题
可能用到的相对原子质量:
H-1
C-12
N-14
O-16
Na-23
Al-27
S-32
Fe-56
Ni-58.7
Cu-64
第I卷(选择题,共50分)
单项选择题:本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意。
1.光伏产业是阜宁的支柱产业之一,光伏发电是利用太阳能电池在太阳光照射下发电。下列说法正确的是
A.制作太阳能电池的材料是SiO2
B.光伏发电是将化学能转化为电能
C.发展太阳能经济有助于减缓温室效应
D.光伏产业是高污染产业,应限制生产规模
2.科研人员发现放射性同位素钬166
67Ho可有效地治疗肝癌。该同位素原子核内中子数与电子数之差为
A.32
B.67
C.99
D.166
3.下列属于含共价键的离子化合物是
A.H2O
B.CaCl2
C.NaOH
D.CO2
4.下列气体只能用排水法,不能用排空气法收集的是
A.O2
B.NO2
C.NO
D.SO2
5.下列化学用语正确的是
A.Cl-离子的结构示意图:
B.甲烷的球棍模型:
C.H2O2的电子式:H[]2-H
D.碳酸氢钠的电离方程式:
NaHCO3=Na++HCO3-
6.下列气体不能用无水氯化钙干燥的是
A.H2
B.Cl2
C.NH3
D.CO2
7.在透明的酸性溶液中能大量共存的离子组是
A.Ba2+、K+、OH-、NO3-
B.NH4+、Cu2+、SO42-、Cl-
C.Al3+、Fe
2+、SO42-、NO3-
D.Na+、Ca2+、Cl-、CO32-
8.下列离子方程式书写正确的是
A.在氯化铝溶液中加入过量氨水:Al3++3NH3·H2O==Al(OH)3↓+3NH
B.钠投入水中:Na+H2O===Na++2OH-+H2↑
C.氯气和冷的氢氧化钠溶液反应:2Cl2+2OH-==3Cl-+ClO-+H2O
D.石灰石加入硝酸溶液中:2H++CO==CO2↑+H2O
9.下列关于物质检验的说法正确的是
A.加入氯化钡溶液有不溶于稀盐酸的白色沉淀生成,则原溶液中一定有SO42﹣
B.加入烧碱溶液后加热,产生能使湿润红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+
C.加入盐酸,放出能使澄淸石灰水变浑浊的无色气体,则原溶液中一定有CO32﹣
D.加入AgNO3溶液,有白色沉淀生成,则原溶液中一定含有Cl-
10.下列说法正确的是
A.1H、D、T互为同位素
B.金刚石、石墨、C60互为同分异构体
C.SO2和SO3互为同分异构体
D.正丁烷和异丁烷互为同素异形体
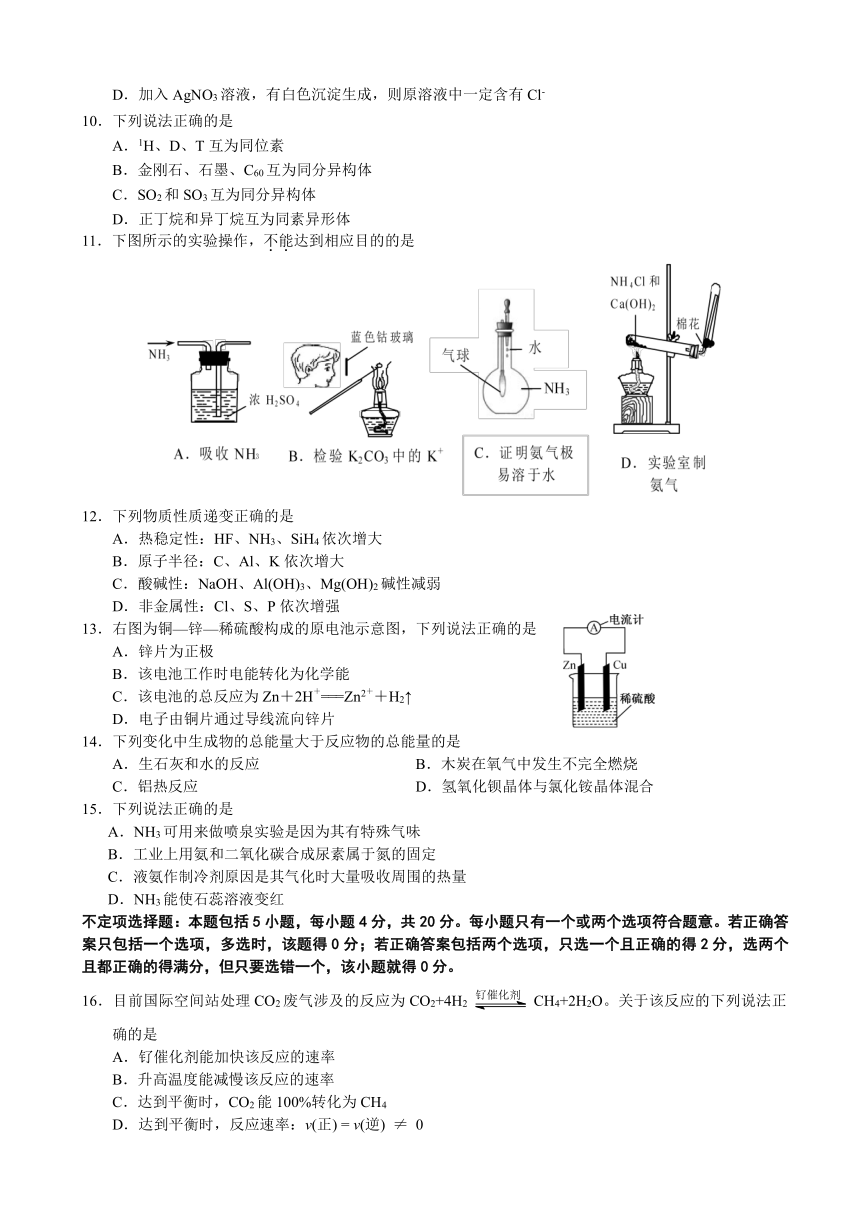
11.下图所示的实验操作,不能达到相应目的的是
12.下列物质性质递变正确的是
A.热稳定性:HF、NH3、SiH4依次增大
B.原子半径:C、Al、K依次增大
C.酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱
D.非金属性:Cl、S、P依次增强
13.右图为铜—锌—稀硫酸构成的原电池示意图,下列说法正确的是
A.锌片为正极
B.该电池工作时电能转化为化学能
C.该电池的总反应为Zn+2H+===Zn2++H2↑
D.电子由铜片通过导线流向锌片
14.下列变化中生成物的总能量大于反应物的总能量的是
A.生石灰和水的反应
B.木炭在氧气中发生不完全燃烧
C.铝热反应
D.氢氧化钡晶体与氯化铵晶体混合
15.下列说法正确的是
A.NH3可用来做喷泉实验是因为其有特殊气味
B.工业上用氨和二氧化碳合成尿素属于氮的固定
C.液氨作制冷剂原因是其气化时大量吸收周围的热量
D.NH3能使石蕊溶液变红
不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
16.目前国际空间站处理CO2废气涉及的反应为CO2+4H2CH4+2H2O。关于该反应的下列说法正确的是
A.钌催化剂能加快该反应的速率
B.升高温度能减慢该反应的速率
C.达到平衡时,CO2能100%转化为CH4
D.达到平衡时,反应速率:v(正)
=
v(逆)
≠
0
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,
D是地壳中含量最多的金属元素。下列说法正确的是
A.原子半径:A<B<C<D<E
B.金属性:D>C
C.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D.化合物AE与CE含有相同类型的化学键
18.关于如图装置(X、Y均为石墨)的下列说法正确的是
A.电极X上发生氧化反应
B.电极Y上有气体产生
C.接通电路时,电子从电源的负极流出经过溶液后再从正极流
回电源
D.若反应中有0.1mol电子转移则阴极产物的质量为3.2g
19.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl和HNO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均为含氧酸盐
20.将5.6
g
Fe全部溶于200
mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24
L,又测得反应后溶液中H+的浓度为0.2
mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法不正确的是
A.2.24
L气体是NO
B.反应后Fe全部转化为Fe3+
C.反应后的溶液中c(NO)=1.7
mol·L-1
D.反应后的溶液最多还能再溶解2.24
g
Fe
第II卷(非选择题,共50分)
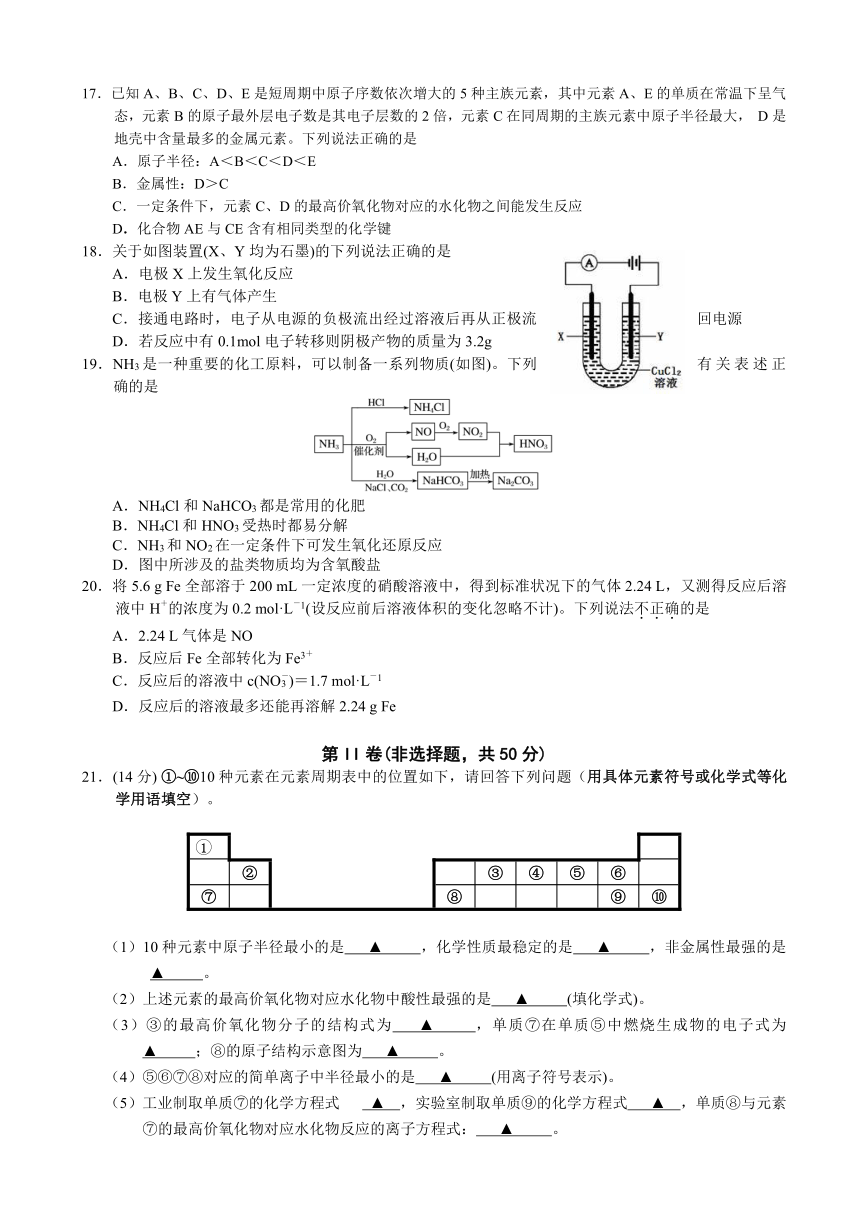
21.(14分)
①~⑩10种元素在元素周期表中的位置如下,请回答下列问题(用具体元素符号或化学式等化学用语填空)。
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
(1)10种元素中原子半径最小的是
▲
,化学性质最稳定的是
▲
,非金属性最强的是
▲
。
(2)上述元素的最高价氧化物对应水化物中酸性最强的是
▲
(填化学式)。
(3)③的最高价氧化物分子的结构式为
▲
,单质⑦在单质⑤中燃烧生成物的电子式为
▲
;⑧的原子结构示意图为
▲
。
(4)⑤⑥⑦⑧对应的简单离子中半径最小的是
▲
(用离子符号表示)。
(5)工业制取单质⑦的化学方程式
▲ ,实验室制取单质⑨的化学方程式
▲ ,单质⑧与元素⑦的最高价氧化物对应水化物反应的离子方程式:
▲
。
22.(12分)化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)(标准状况)
100
240
464
576
620
①
哪一时间段反应速率最大
▲
min(填0~1、1~2、2~3、3~4、4~5),原因是
▲
。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率
▲
(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是
▲
。
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是
▲
。
②该反应达到平衡状态的标志是
▲
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.生成1mol
Y的同时生成2mol
Z
③2min内X的转化率为
▲
。
④若上述反应中X、Y、Z分别为H2、N2、NH3,
且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:
▲
。
23.(8分)
A—G是中学化学中常见的物质,它们之间的转化关系如图
(部分反应的条件和生成物被略去)。A是由两种元素组成的化合物;
B是强碱,焰色反应时火焰呈黄色;D
为无色有刺激性气味的气体,且其水溶液呈碱性;
E是一种既能和盐酸反应又能够和氢氧化钠反应的白色胶状沉淀;G是一种固体单质,其原子的最外层电子数是次外层电子数的两倍;H是空气中含量最多的气体。
请回答下列问题:
(1)B
的电子式为
▲
。
(2)C的化学式为
▲
。
(3)写出E与B溶液反应的离子方程式
▲
。
(4)高温下,F、G、H反应得到A及一种有毒气体,写出该反应的化学方程式
▲ 。
24.(6分)美国NASA曾开发一种铁-空气二次电池。该电池放电时,其原理如右图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。
(1)该电池放电时电极b上发生
▲
反应(填“氧化”或“还原”)。
(2)写出该电池放电时的电极反应式。
负极:
▲
;
正极:
▲
。
25.(10分)碱式氧化镍[NiO(OH)]可用作镍氢电池的正极材料。工业上以含镍(Ni2+)废液为原料生产的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是
▲
。
(2)滤液Ⅱ中所含溶质的化学式为
▲
,实验室里进行过滤操作时需要的玻璃仪器有玻璃棒、烧杯、
▲
。
(3)写出在空气中加热Ni(OH)2制取NiO(OH)的化学方程式:
▲
。
(4)若加热不充分,制得的NiO(OH)样品中会混有Ni(OH)2,为测定加热后所得样品中NiO(OH)的质量分数,进行如下实验:称取2.00
g样品溶于稀硫酸,加入100
mL
0.25
mol/L
Fe2+的标准溶液,搅拌至溶液清亮,再定容至100
mL后取出20.00
mL,用0.010
mol/L
KMnO4标准溶液滴定,用去KMnO4标准溶液20.00
mL。
试通过计算确定NiO(OH)的质量分数(写出计算过程,计算结果精确到0.1%)。
测定过程中涉及反应如下:
NiO(OH)
+
Fe2++
3
H+
==
Ni2++
Fe3++
2
H2O
5
Fe2++
MnO4-
+
8
H+
==
5
Fe3++
Mn2++
4
H2O
高一化学参考答案和评分标准
1~15:
每小题2分,共计30分。
1~5:CACCD
6~10:CBABA
11~15:ABCDC
16~20:每小题4分,共计20分。正确答案为两个的,选对一个得2分,选对两个得4分,若出现错选的该题得0分。
16:
AD
17:
C
18:
BD
19:
BC
20:
D
21.(14分)((5)每空2分,其余每空1
分,共14分)
(1)
H
Ar
F
(2)HClO4
(3)O=C=O
Na+[]2-Na+
(4)Al3+
(5)2NaCl2Na+Cl2↑
MnO2+4HClMnCl2+Cl2↑+2H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
22.(12分)
(1)①
2~3
(1分);
因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快。(1分)
②
0.025
mol/(L min)
(1分)
(2)
CD
(1分)
(3)①
3X(g)+Y(g)2Z(g)
(2分)
②
CD
(2分)
③
30%
(2分)
④
N2(g)
+3H2(g)2NH3(g)
ΔH=-92kJ/mol
(2分)
23.(每空2分,8分)
(1)
(2)NaAlO2
(3)
Al(OH)3+OH—==
AlO2—+2H2O
(4)
Al2O3+N2+3C2AlN+3CO
24.(每空2分,6分)
(1)
还原
(2)
2Fe
–
4e-
==
2Fe2+
(或2Fe
–
4e-
+
4OH-==
2
Fe(OH)2)
O2+2H2O+4e-
==
4OH-
25.
(10分)
(1)静置,在上层清液中继续滴加1-2滴Na2CO3溶液,若无沉淀生成,说明Ni2+已经完全沉淀。(2分)
(2)
Na2SO4
(2分)
漏斗(1分)
(3)
4Ni(OH)2
+
O2
4
NiO(OH)
+
2H2O(2分)
(4)91.7%
(3分)
A
E
B
水
C
D
F
H
A
G
二氧化碳、水
氢气
△
化
学
试
题
可能用到的相对原子质量:
H-1
C-12
N-14
O-16
Na-23
Al-27
S-32
Fe-56
Ni-58.7
Cu-64
第I卷(选择题,共50分)
单项选择题:本题包括15小题,每小题2分,共30分。每小题只有一个选项符合题意。
1.光伏产业是阜宁的支柱产业之一,光伏发电是利用太阳能电池在太阳光照射下发电。下列说法正确的是
A.制作太阳能电池的材料是SiO2
B.光伏发电是将化学能转化为电能
C.发展太阳能经济有助于减缓温室效应
D.光伏产业是高污染产业,应限制生产规模
2.科研人员发现放射性同位素钬166
67Ho可有效地治疗肝癌。该同位素原子核内中子数与电子数之差为
A.32
B.67
C.99
D.166
3.下列属于含共价键的离子化合物是
A.H2O
B.CaCl2
C.NaOH
D.CO2
4.下列气体只能用排水法,不能用排空气法收集的是
A.O2
B.NO2
C.NO
D.SO2
5.下列化学用语正确的是
A.Cl-离子的结构示意图:
B.甲烷的球棍模型:
C.H2O2的电子式:H[]2-H
D.碳酸氢钠的电离方程式:
NaHCO3=Na++HCO3-
6.下列气体不能用无水氯化钙干燥的是
A.H2
B.Cl2
C.NH3
D.CO2
7.在透明的酸性溶液中能大量共存的离子组是
A.Ba2+、K+、OH-、NO3-
B.NH4+、Cu2+、SO42-、Cl-
C.Al3+、Fe
2+、SO42-、NO3-
D.Na+、Ca2+、Cl-、CO32-
8.下列离子方程式书写正确的是
A.在氯化铝溶液中加入过量氨水:Al3++3NH3·H2O==Al(OH)3↓+3NH
B.钠投入水中:Na+H2O===Na++2OH-+H2↑
C.氯气和冷的氢氧化钠溶液反应:2Cl2+2OH-==3Cl-+ClO-+H2O
D.石灰石加入硝酸溶液中:2H++CO==CO2↑+H2O
9.下列关于物质检验的说法正确的是
A.加入氯化钡溶液有不溶于稀盐酸的白色沉淀生成,则原溶液中一定有SO42﹣
B.加入烧碱溶液后加热,产生能使湿润红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+
C.加入盐酸,放出能使澄淸石灰水变浑浊的无色气体,则原溶液中一定有CO32﹣
D.加入AgNO3溶液,有白色沉淀生成,则原溶液中一定含有Cl-
10.下列说法正确的是
A.1H、D、T互为同位素
B.金刚石、石墨、C60互为同分异构体
C.SO2和SO3互为同分异构体
D.正丁烷和异丁烷互为同素异形体
11.下图所示的实验操作,不能达到相应目的的是
12.下列物质性质递变正确的是
A.热稳定性:HF、NH3、SiH4依次增大
B.原子半径:C、Al、K依次增大
C.酸碱性:NaOH、Al(OH)3、Mg(OH)2碱性减弱
D.非金属性:Cl、S、P依次增强
13.右图为铜—锌—稀硫酸构成的原电池示意图,下列说法正确的是
A.锌片为正极
B.该电池工作时电能转化为化学能
C.该电池的总反应为Zn+2H+===Zn2++H2↑
D.电子由铜片通过导线流向锌片
14.下列变化中生成物的总能量大于反应物的总能量的是
A.生石灰和水的反应
B.木炭在氧气中发生不完全燃烧
C.铝热反应
D.氢氧化钡晶体与氯化铵晶体混合
15.下列说法正确的是
A.NH3可用来做喷泉实验是因为其有特殊气味
B.工业上用氨和二氧化碳合成尿素属于氮的固定
C.液氨作制冷剂原因是其气化时大量吸收周围的热量
D.NH3能使石蕊溶液变红
不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
16.目前国际空间站处理CO2废气涉及的反应为CO2+4H2CH4+2H2O。关于该反应的下列说法正确的是
A.钌催化剂能加快该反应的速率
B.升高温度能减慢该反应的速率
C.达到平衡时,CO2能100%转化为CH4
D.达到平衡时,反应速率:v(正)
=
v(逆)
≠
0
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,
D是地壳中含量最多的金属元素。下列说法正确的是
A.原子半径:A<B<C<D<E
B.金属性:D>C
C.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D.化合物AE与CE含有相同类型的化学键
18.关于如图装置(X、Y均为石墨)的下列说法正确的是
A.电极X上发生氧化反应
B.电极Y上有气体产生
C.接通电路时,电子从电源的负极流出经过溶液后再从正极流
回电源
D.若反应中有0.1mol电子转移则阴极产物的质量为3.2g
19.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl和HNO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均为含氧酸盐
20.将5.6
g
Fe全部溶于200
mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24
L,又测得反应后溶液中H+的浓度为0.2
mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法不正确的是
A.2.24
L气体是NO
B.反应后Fe全部转化为Fe3+
C.反应后的溶液中c(NO)=1.7
mol·L-1
D.反应后的溶液最多还能再溶解2.24
g
Fe
第II卷(非选择题,共50分)
21.(14分)
①~⑩10种元素在元素周期表中的位置如下,请回答下列问题(用具体元素符号或化学式等化学用语填空)。
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
(1)10种元素中原子半径最小的是
▲
,化学性质最稳定的是
▲
,非金属性最强的是
▲
。
(2)上述元素的最高价氧化物对应水化物中酸性最强的是
▲
(填化学式)。
(3)③的最高价氧化物分子的结构式为
▲
,单质⑦在单质⑤中燃烧生成物的电子式为
▲
;⑧的原子结构示意图为
▲
。
(4)⑤⑥⑦⑧对应的简单离子中半径最小的是
▲
(用离子符号表示)。
(5)工业制取单质⑦的化学方程式
▲ ,实验室制取单质⑨的化学方程式
▲ ,单质⑧与元素⑦的最高价氧化物对应水化物反应的离子方程式:
▲
。
22.(12分)化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min)
1
2
3
4
5
氢气体积(mL)(标准状况)
100
240
464
576
620
①
哪一时间段反应速率最大
▲
min(填0~1、1~2、2~3、3~4、4~5),原因是
▲
。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率
▲
(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是
▲
。
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是
▲
。
②该反应达到平衡状态的标志是
▲
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.生成1mol
Y的同时生成2mol
Z
③2min内X的转化率为
▲
。
④若上述反应中X、Y、Z分别为H2、N2、NH3,
且已知17g氨气分解成氮气和氢气要吸收46kJ热量,则该反应的热化学反应方程式为:
▲
。
23.(8分)
A—G是中学化学中常见的物质,它们之间的转化关系如图
(部分反应的条件和生成物被略去)。A是由两种元素组成的化合物;
B是强碱,焰色反应时火焰呈黄色;D
为无色有刺激性气味的气体,且其水溶液呈碱性;
E是一种既能和盐酸反应又能够和氢氧化钠反应的白色胶状沉淀;G是一种固体单质,其原子的最外层电子数是次外层电子数的两倍;H是空气中含量最多的气体。
请回答下列问题:
(1)B
的电子式为
▲
。
(2)C的化学式为
▲
。
(3)写出E与B溶液反应的离子方程式
▲
。
(4)高温下,F、G、H反应得到A及一种有毒气体,写出该反应的化学方程式
▲ 。
24.(6分)美国NASA曾开发一种铁-空气二次电池。该电池放电时,其原理如右图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。
(1)该电池放电时电极b上发生
▲
反应(填“氧化”或“还原”)。
(2)写出该电池放电时的电极反应式。
负极:
▲
;
正极:
▲
。
25.(10分)碱式氧化镍[NiO(OH)]可用作镍氢电池的正极材料。工业上以含镍(Ni2+)废液为原料生产的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是
▲
。
(2)滤液Ⅱ中所含溶质的化学式为
▲
,实验室里进行过滤操作时需要的玻璃仪器有玻璃棒、烧杯、
▲
。
(3)写出在空气中加热Ni(OH)2制取NiO(OH)的化学方程式:
▲
。
(4)若加热不充分,制得的NiO(OH)样品中会混有Ni(OH)2,为测定加热后所得样品中NiO(OH)的质量分数,进行如下实验:称取2.00
g样品溶于稀硫酸,加入100
mL
0.25
mol/L
Fe2+的标准溶液,搅拌至溶液清亮,再定容至100
mL后取出20.00
mL,用0.010
mol/L
KMnO4标准溶液滴定,用去KMnO4标准溶液20.00
mL。
试通过计算确定NiO(OH)的质量分数(写出计算过程,计算结果精确到0.1%)。
测定过程中涉及反应如下:
NiO(OH)
+
Fe2++
3
H+
==
Ni2++
Fe3++
2
H2O
5
Fe2++
MnO4-
+
8
H+
==
5
Fe3++
Mn2++
4
H2O
高一化学参考答案和评分标准
1~15:
每小题2分,共计30分。
1~5:CACCD
6~10:CBABA
11~15:ABCDC
16~20:每小题4分,共计20分。正确答案为两个的,选对一个得2分,选对两个得4分,若出现错选的该题得0分。
16:
AD
17:
C
18:
BD
19:
BC
20:
D
21.(14分)((5)每空2分,其余每空1
分,共14分)
(1)
H
Ar
F
(2)HClO4
(3)O=C=O
Na+[]2-Na+
(4)Al3+
(5)2NaCl2Na+Cl2↑
MnO2+4HClMnCl2+Cl2↑+2H2O
2Al+2OH-+2H2O=2AlO2-+3H2↑
22.(12分)
(1)①
2~3
(1分);
因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快。(1分)
②
0.025
mol/(L min)
(1分)
(2)
CD
(1分)
(3)①
3X(g)+Y(g)2Z(g)
(2分)
②
CD
(2分)
③
30%
(2分)
④
N2(g)
+3H2(g)2NH3(g)
ΔH=-92kJ/mol
(2分)
23.(每空2分,8分)
(1)
(2)NaAlO2
(3)
Al(OH)3+OH—==
AlO2—+2H2O
(4)
Al2O3+N2+3C2AlN+3CO
24.(每空2分,6分)
(1)
还原
(2)
2Fe
–
4e-
==
2Fe2+
(或2Fe
–
4e-
+
4OH-==
2
Fe(OH)2)
O2+2H2O+4e-
==
4OH-
25.
(10分)
(1)静置,在上层清液中继续滴加1-2滴Na2CO3溶液,若无沉淀生成,说明Ni2+已经完全沉淀。(2分)
(2)
Na2SO4
(2分)
漏斗(1分)
(3)
4Ni(OH)2
+
O2
4
NiO(OH)
+
2H2O(2分)
(4)91.7%
(3分)
A
E
B
水
C
D
F
H
A
G
二氧化碳、水
氢气
△
同课章节目录
