专题1 化学反应中的能量变化 第一单元 化学反应中的热效应 第2课时
文档属性
| 名称 | 专题1 化学反应中的能量变化 第一单元 化学反应中的热效应 第2课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-05-29 15:39:42 | ||
图片预览








文档简介
课件51张PPT。第2课时
反应热的测量与计算 能源的充分利用反应热的测量
(1)原理:中和反应的反应热ΔH=-cmΔt。
①c:为体系的比热容,指单位质量的物质温度升高______所需吸收的能量。
②Δt:反应后与反应前的________。
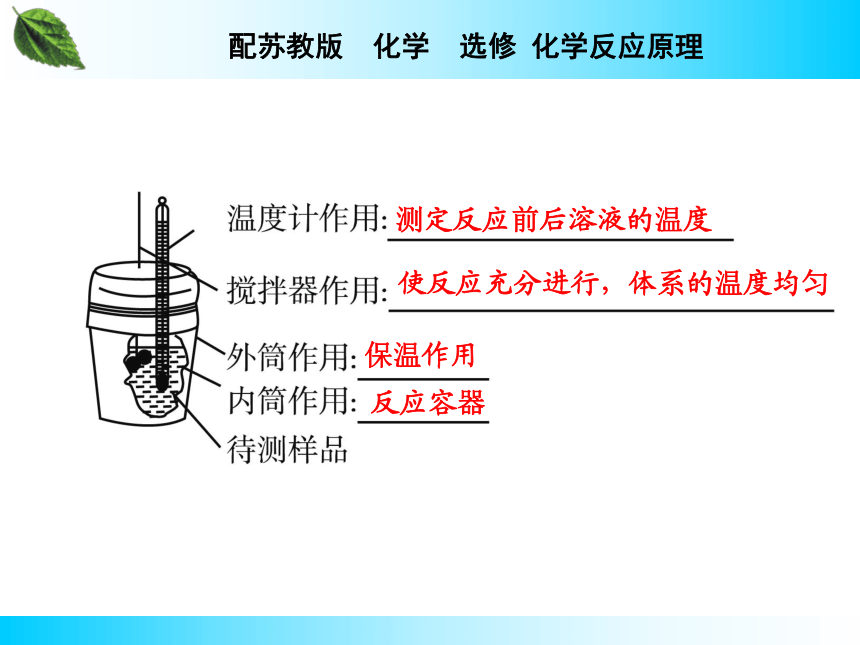
(2)仪器——量热计反应热的测量1 ℃温度差测定反应前后溶液的温度使反应充分进行,体系的温度均匀保温作用反应容器1.内容
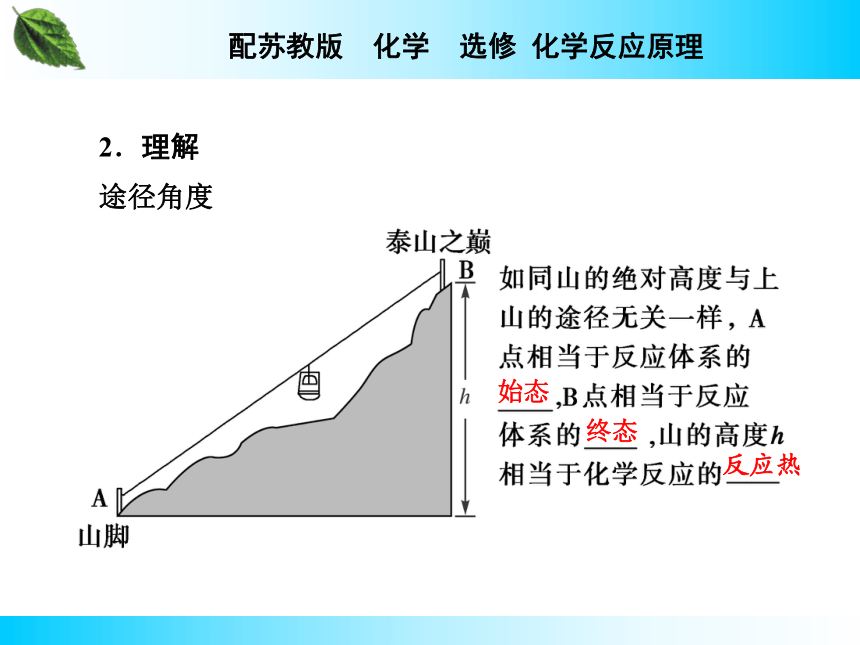
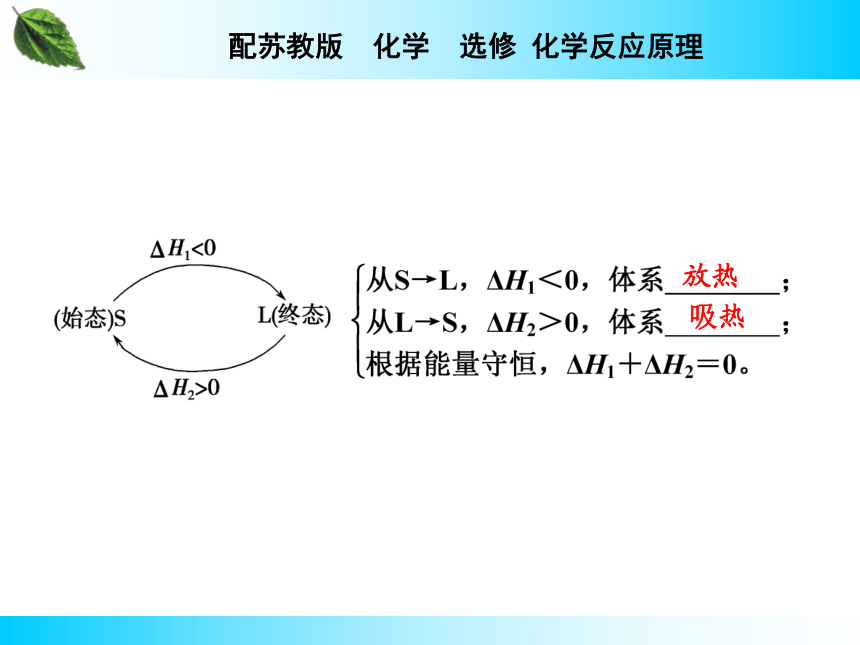
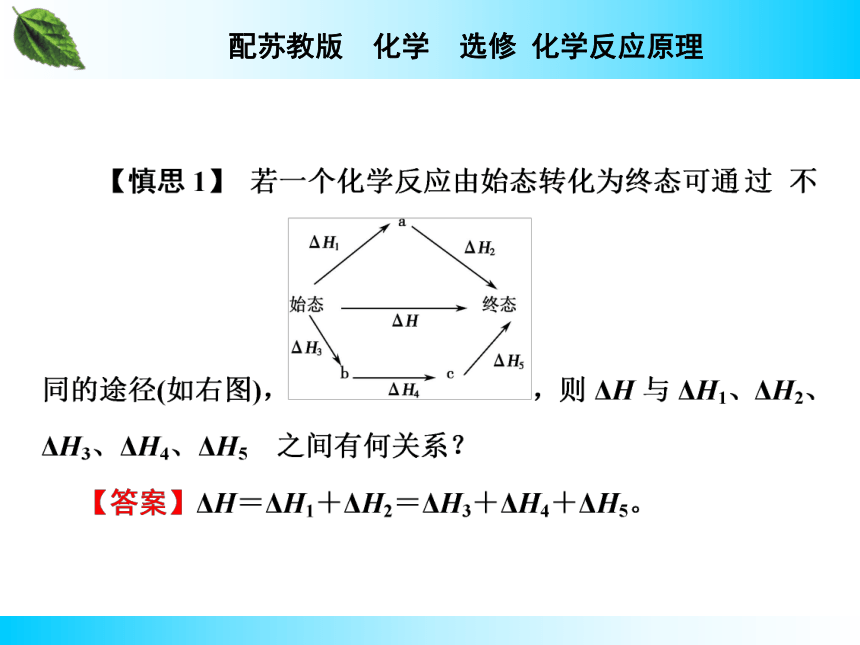
一个化学反应,无论是一步完成,还是分几步完成,其总的热效应_________。即化学反应的焓变只与反应的______和_______有关,而与反应的________无关。盖斯定律完全相同 始态终态途径2.理解
途径角度始态终态反应热放热吸热 1.概念
________时,________纯物质_______燃烧生成______的氧化物时所放出的热量。
2.表达形式
(1)符号:ΔH为____(填“+”或“-”)或ΔH____0。
(2)单位:__________。标准燃烧热101 kPa1 mol完全稳定 - <kJ·mol-1 3.解释
完全燃烧生成稳定的氧化物是指:C→________,H2→________,N→________。
4.意义
例如:C的标准燃烧热为393.5 kJ·mol-1,表示在__________时,______C完全燃烧生成________时放出393.5 kJ的热量。 CO2(g)H2O(l)N2(g) 101 kPa 1 molCO2【慎思2】 相同质量的H2分别与O2完全反应时生成液态水和气态水,哪一个放出的热量多?
【答案】设H2O(g)===H2O(l)放出的热量为ΔQ,比较两者放出热量多少时可根据盖斯定律设计成如下图过程:
因为Q1=Q2+ΔQ,所以Q1>Q2。因此,生成液态水放出的热量多。
则氢气的标准燃烧热ΔH是( )
A.-483.6 kJ·mol-1
B.-241.8 kJ·mol-1
C.-571.6 kJ·mol-1
D.-285.8 kJ·mol-1
【答案】D中和热及其测定注意事项中和热(3)理解时应注意
①稀溶液是指溶液浓度小,酸或碱都完全电离的状态。
②中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。
③中和反应的实质是H+和OH-结合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。【例1】某实验小组设计用50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1 NaOH溶液在如右图装置中进行中和反应以测定中和热。请回答下列问题:(1)若因反应中有放热现象而造成少量盐酸在反应中挥发,则测得的中和热数值________(填“偏大”“偏小”或“不变”)。
(2)实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”,下同),所求的中和热________,理由是____________________________________ __________________________________________________。 (3)该实验小组做了三次实验,每次取溶液50 mL,并记录原始数据如下:已知盐酸、NaOH溶液的密度近似为1 g·cm-3,中和后混合液的比热容c=4.18 J·(g·℃)-1,则该反应的中和热ΔH=________________。
解析 中和热测定实验主要注意如何防止或减少热量的散失,还要注意中和热的定义及中和热的计算。答案 (1)偏小
(2)不相等 相等 60 mL 0.50 mol·L-1 盐酸和50 mL 0.55 mol·L-1NaOH溶液反应能生成0.027 5 mol H2O,而50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液反应只能生成0.025 mol H2O,因此所放出的热量不同。但中和热是指酸与碱发生中和反应生成1 mol H2O时所放出的热量,与酸、碱的用量无关,因此所求中和热相等
(3)-56.01 kJ·mol-1中和热的测定应注意以下几点:
(1)酸碱溶液应当用强酸、强碱的稀溶液(0.1 ~0.5 mol/L)。
①测定中和热不能用浓酸或浓碱,因浓酸或浓碱溶于水一般都要放热。
②测定中和热时不能用弱酸或弱碱,因弱酸或弱碱在水溶液中不能完全电离,若改用弱酸或弱碱,它们电离时要吸收一部分热量。 (2)要使用同一温度计。
分别先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。
(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
(4)操作时动作要快,尽量减少热量的散失。 (5)实验时可使一种反应物稍过量,以保证另一反应物完全反应,生成1 mol H2O。但在计算时,应取二者中量小的一种,因为过量的酸或碱并不参与中和反应。
(6)重复实验三次,取其平均值,以减小误差。【体验1】实验室利用如右图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处的仪器未画出,它们是____________、________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 _______ ____________________________。 (3)做一次完整的中和热测定实验,温度计需使用________次。
(4)把温度为13 ℃,浓度为1.0 mol·L-1的酸溶液和1.1 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·℃-1),轻轻搅拌,测得酸碱混合液的温度变化数据如下:
①试计算上述两组实验测出的中和热:ΔH1=___________________________;ΔH2=____________。
②两组实验结果差异的原因是_______________________ __________________________________________________________________________________________________________。【答案】(1)环形玻璃搅拌棒 烧杯上方的泡沫塑料盖
(2)提高装置的保温效果
(3)3
(4)①56.9 kJ·mol-1 52.7 kJ·mol-1
②NH3·H2O是弱碱,一部分电离,发生电离时要吸热,中和时放热较少
【解释】本题重点考查中和热测定基本步骤和数据处理。1.虚拟路径法
如C(s)+O2(g)===CO2(g),可设置如下:
ΔH1=ΔH2+ΔH3。
运用盖斯定律解题常用的方法2.加合法:即运用所给方程式通过加减的方法得到新化学方程式。
(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
(3)将一个热化学方程式颠倒时,ΔH的“+”或“-”号必须随之改变。
(4)解题的一般步骤是:首先确定待求的方程式,然后观察待求方程式中的各物质在已知方程式中的位置,最后根据未知方程式中各物质的化学计量数和位置的需要对已知方程式进行处理(包括调整化学计量数或调整反应方向,然后把各方程式叠加并检验)。
解析 第三个方程式可由第二个方程式乘以2与第一个方程式相加得到,由盖斯定律可知ΔH3=ΔH1+2ΔH2。
答案 A应用盖斯定律进行热化学方程式相加(或减)时,做到:
(1)左侧(即反应物)加(或减)左侧;
(2)右侧(即生成物)加(或减)右侧;
(3)在此过程中已知化学方程式要扩大或缩小相应的倍数以消去中间产物;
(4)据化学方程式的变化确定反应热的变化。
【体验2】已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ·mol-1;C(石墨,s)+O2(g)===CO2(g) ΔH2=-393.51 kJ·mol-1,则金刚石转化为石墨时的热化学方程式为______________________________。由此看来更稳定的碳的同素异形体为________。【答案】C(金刚石,s)===C(石墨,s) ΔH=-1.90 kJ·mol-1
石墨
【解释】由盖斯定律知,要得到金刚石和石墨的转化关系,可将两个热化学方程式相减:C(金刚石,s)===C(石墨,s) ΔH=ΔH1-ΔH2=-395.41 kJ·mol-1+393.51 kJ·mol-1=-1.90 kJ·mol-1,即C(金刚石,s)===C(石墨,s) ΔH=-1.90 kJ·mol-1。可见金刚石转化为石墨放出热量,说明石墨的能量更低,比金刚石稳定。1.标准燃烧热是反应热的一种,其ΔH的符号为“-”或ΔH<0。
2.25 ℃、101 kPa时,可燃物完全燃烧,生成稳定的氧化物。如C完全燃烧应生成CO2(g),而生成CO(g)属于不完全燃烧。又如H2燃烧生成液态H2O,而不是水蒸气。
3.标准燃烧热通常是由实验测得的。可燃物以1 mol纯物质作为标准进行测量。在理解标准燃烧热时应注意的问题【例3】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,下列说法正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.CO的燃烧热为566 kJ·mol-1
C.CO的燃烧热ΔH=-283 kJ·mol-1
D.下图可表示由CO生成CO2的反应过程和能量关系
解析 CO的燃烧热为283 kJ·mol-1,D项图中的量标示有错误,应标为2 mol CO和2 mol CO2。
答案 C燃烧热的叙述有两种形式:一是用文字表示,此时只能用相应的数值和单位,不能用“-”号,如乙炔的燃烧热为1 300 kJ·mol-1;二是用ΔH表示,此时需用负号表示,如乙炔的燃烧热ΔH=-1 300 kJ·mol-1。
【答案】A
【解释】标准燃烧热是指在25 ℃、101 kPa时,1 mol 纯物质完全燃烧生成稳定氧化物时所放出的热量。因此正丁烷完全燃烧产物应为CO2(g)和H2O(l),所以正丁烷的标准燃烧热为ΔH=- 2 878 kJ·mol-1。实验探究二 盖斯定律在解决实际问题中的应用 (2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是_____________________________ ____________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:__________________________ ____________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇,②甲醛,③甲酸,④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,理论上可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
【答案】(1)C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.5 kJ·mol-1
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3,且ΔH2>0)
(3)①减少污染 ②燃烧充分 ③方便运输(任选两个作答) (4)②④【解释】根据盖斯定律将方程式合并即可得C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ·mol-1,由此可知煤转化成水煤气是吸热反应,而甲正是忽略了这个问题,才误认为“煤转化成水煤气可以使煤燃烧放出更多的热量”。CO和H2按1∶1反应合成物质时,可达到零排放,符合“绿色化学”的要求,则合成的物质的最简式应满足CH2O,则②、④符合。
反应热的测量与计算 能源的充分利用反应热的测量
(1)原理:中和反应的反应热ΔH=-cmΔt。
①c:为体系的比热容,指单位质量的物质温度升高______所需吸收的能量。
②Δt:反应后与反应前的________。
(2)仪器——量热计反应热的测量1 ℃温度差测定反应前后溶液的温度使反应充分进行,体系的温度均匀保温作用反应容器1.内容
一个化学反应,无论是一步完成,还是分几步完成,其总的热效应_________。即化学反应的焓变只与反应的______和_______有关,而与反应的________无关。盖斯定律完全相同 始态终态途径2.理解
途径角度始态终态反应热放热吸热 1.概念
________时,________纯物质_______燃烧生成______的氧化物时所放出的热量。
2.表达形式
(1)符号:ΔH为____(填“+”或“-”)或ΔH____0。
(2)单位:__________。标准燃烧热101 kPa1 mol完全稳定 - <kJ·mol-1 3.解释
完全燃烧生成稳定的氧化物是指:C→________,H2→________,N→________。
4.意义
例如:C的标准燃烧热为393.5 kJ·mol-1,表示在__________时,______C完全燃烧生成________时放出393.5 kJ的热量。 CO2(g)H2O(l)N2(g) 101 kPa 1 molCO2【慎思2】 相同质量的H2分别与O2完全反应时生成液态水和气态水,哪一个放出的热量多?
【答案】设H2O(g)===H2O(l)放出的热量为ΔQ,比较两者放出热量多少时可根据盖斯定律设计成如下图过程:
因为Q1=Q2+ΔQ,所以Q1>Q2。因此,生成液态水放出的热量多。
则氢气的标准燃烧热ΔH是( )
A.-483.6 kJ·mol-1
B.-241.8 kJ·mol-1
C.-571.6 kJ·mol-1
D.-285.8 kJ·mol-1
【答案】D中和热及其测定注意事项中和热(3)理解时应注意
①稀溶液是指溶液浓度小,酸或碱都完全电离的状态。
②中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离的吸热所伴随的热效应。
③中和反应的实质是H+和OH-结合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。【例1】某实验小组设计用50 mL 1.0 mol·L-1盐酸跟50 mL 1.1 mol·L-1 NaOH溶液在如右图装置中进行中和反应以测定中和热。请回答下列问题:(1)若因反应中有放热现象而造成少量盐酸在反应中挥发,则测得的中和热数值________(填“偏大”“偏小”或“不变”)。
(2)实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1氢氧化钠溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”,下同),所求的中和热________,理由是____________________________________ __________________________________________________。 (3)该实验小组做了三次实验,每次取溶液50 mL,并记录原始数据如下:已知盐酸、NaOH溶液的密度近似为1 g·cm-3,中和后混合液的比热容c=4.18 J·(g·℃)-1,则该反应的中和热ΔH=________________。
解析 中和热测定实验主要注意如何防止或减少热量的散失,还要注意中和热的定义及中和热的计算。答案 (1)偏小
(2)不相等 相等 60 mL 0.50 mol·L-1 盐酸和50 mL 0.55 mol·L-1NaOH溶液反应能生成0.027 5 mol H2O,而50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液反应只能生成0.025 mol H2O,因此所放出的热量不同。但中和热是指酸与碱发生中和反应生成1 mol H2O时所放出的热量,与酸、碱的用量无关,因此所求中和热相等
(3)-56.01 kJ·mol-1中和热的测定应注意以下几点:
(1)酸碱溶液应当用强酸、强碱的稀溶液(0.1 ~0.5 mol/L)。
①测定中和热不能用浓酸或浓碱,因浓酸或浓碱溶于水一般都要放热。
②测定中和热时不能用弱酸或弱碱,因弱酸或弱碱在水溶液中不能完全电离,若改用弱酸或弱碱,它们电离时要吸收一部分热量。 (2)要使用同一温度计。
分别先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。
(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
(4)操作时动作要快,尽量减少热量的散失。 (5)实验时可使一种反应物稍过量,以保证另一反应物完全反应,生成1 mol H2O。但在计算时,应取二者中量小的一种,因为过量的酸或碱并不参与中和反应。
(6)重复实验三次,取其平均值,以减小误差。【体验1】实验室利用如右图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处的仪器未画出,它们是____________、________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 _______ ____________________________。 (3)做一次完整的中和热测定实验,温度计需使用________次。
(4)把温度为13 ℃,浓度为1.0 mol·L-1的酸溶液和1.1 mol·L-1的碱溶液各50 mL混合(溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·g-1·℃-1),轻轻搅拌,测得酸碱混合液的温度变化数据如下:
①试计算上述两组实验测出的中和热:ΔH1=___________________________;ΔH2=____________。
②两组实验结果差异的原因是_______________________ __________________________________________________________________________________________________________。【答案】(1)环形玻璃搅拌棒 烧杯上方的泡沫塑料盖
(2)提高装置的保温效果
(3)3
(4)①56.9 kJ·mol-1 52.7 kJ·mol-1
②NH3·H2O是弱碱,一部分电离,发生电离时要吸热,中和时放热较少
【解释】本题重点考查中和热测定基本步骤和数据处理。1.虚拟路径法
如C(s)+O2(g)===CO2(g),可设置如下:
ΔH1=ΔH2+ΔH3。
运用盖斯定律解题常用的方法2.加合法:即运用所给方程式通过加减的方法得到新化学方程式。
(1)热化学方程式同乘以某一个数时,反应热数值也必须乘上该数。
(2)热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
(3)将一个热化学方程式颠倒时,ΔH的“+”或“-”号必须随之改变。
(4)解题的一般步骤是:首先确定待求的方程式,然后观察待求方程式中的各物质在已知方程式中的位置,最后根据未知方程式中各物质的化学计量数和位置的需要对已知方程式进行处理(包括调整化学计量数或调整反应方向,然后把各方程式叠加并检验)。
解析 第三个方程式可由第二个方程式乘以2与第一个方程式相加得到,由盖斯定律可知ΔH3=ΔH1+2ΔH2。
答案 A应用盖斯定律进行热化学方程式相加(或减)时,做到:
(1)左侧(即反应物)加(或减)左侧;
(2)右侧(即生成物)加(或减)右侧;
(3)在此过程中已知化学方程式要扩大或缩小相应的倍数以消去中间产物;
(4)据化学方程式的变化确定反应热的变化。
【体验2】已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为C(金刚石,s)+O2(g)===CO2(g) ΔH1=-395.41 kJ·mol-1;C(石墨,s)+O2(g)===CO2(g) ΔH2=-393.51 kJ·mol-1,则金刚石转化为石墨时的热化学方程式为______________________________。由此看来更稳定的碳的同素异形体为________。【答案】C(金刚石,s)===C(石墨,s) ΔH=-1.90 kJ·mol-1
石墨
【解释】由盖斯定律知,要得到金刚石和石墨的转化关系,可将两个热化学方程式相减:C(金刚石,s)===C(石墨,s) ΔH=ΔH1-ΔH2=-395.41 kJ·mol-1+393.51 kJ·mol-1=-1.90 kJ·mol-1,即C(金刚石,s)===C(石墨,s) ΔH=-1.90 kJ·mol-1。可见金刚石转化为石墨放出热量,说明石墨的能量更低,比金刚石稳定。1.标准燃烧热是反应热的一种,其ΔH的符号为“-”或ΔH<0。
2.25 ℃、101 kPa时,可燃物完全燃烧,生成稳定的氧化物。如C完全燃烧应生成CO2(g),而生成CO(g)属于不完全燃烧。又如H2燃烧生成液态H2O,而不是水蒸气。
3.标准燃烧热通常是由实验测得的。可燃物以1 mol纯物质作为标准进行测量。在理解标准燃烧热时应注意的问题【例3】已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,下列说法正确的是( )
A.CO的燃烧热为-283 kJ·mol-1
B.CO的燃烧热为566 kJ·mol-1
C.CO的燃烧热ΔH=-283 kJ·mol-1
D.下图可表示由CO生成CO2的反应过程和能量关系
解析 CO的燃烧热为283 kJ·mol-1,D项图中的量标示有错误,应标为2 mol CO和2 mol CO2。
答案 C燃烧热的叙述有两种形式:一是用文字表示,此时只能用相应的数值和单位,不能用“-”号,如乙炔的燃烧热为1 300 kJ·mol-1;二是用ΔH表示,此时需用负号表示,如乙炔的燃烧热ΔH=-1 300 kJ·mol-1。
【答案】A
【解释】标准燃烧热是指在25 ℃、101 kPa时,1 mol 纯物质完全燃烧生成稳定氧化物时所放出的热量。因此正丁烷完全燃烧产物应为CO2(g)和H2O(l),所以正丁烷的标准燃烧热为ΔH=- 2 878 kJ·mol-1。实验探究二 盖斯定律在解决实际问题中的应用 (2)比较反应热数据可知,1 mol CO(g)和1 mol H2(g)完全燃烧放出的热量之和比1 mol C(s)完全燃烧放出的热量多。甲同学据此认为“煤转化为水煤气可以使煤燃烧放出更多的热量”;乙同学根据盖斯定律作出下列循环图:并据此认为“煤转化为水煤气再燃烧放出的热量与煤直接燃烧放出的热量相等”。
请分析:甲、乙两同学观点正确的是________(填“甲”或“乙”);判断的理由是_____________________________ ____________________________________________________。
(3)将煤转化为水煤气作为燃料和煤直接燃烧相比有很多优点,请列举其中的两个优点:__________________________ ____________________________________________________。
(4)水煤气不仅是优良的气体燃料,也是重要的有机化工原料。CO和H2在一定条件下可以合成:①甲醇,②甲醛,③甲酸,④乙酸。试分析当CO和H2按1∶1的体积比混合反应,合成上述________(填序号)物质时,理论上可以满足“绿色化学”的要求,完全利用原料中的原子,实现零排放。
【答案】(1)C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131.5 kJ·mol-1
(2)乙 甲同学忽略了煤转化为水煤气要吸收热量(或ΔH1=ΔH2+ΔH3,且ΔH2>0)
(3)①减少污染 ②燃烧充分 ③方便运输(任选两个作答) (4)②④【解释】根据盖斯定律将方程式合并即可得C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.5 kJ·mol-1,由此可知煤转化成水煤气是吸热反应,而甲正是忽略了这个问题,才误认为“煤转化成水煤气可以使煤燃烧放出更多的热量”。CO和H2按1∶1反应合成物质时,可达到零排放,符合“绿色化学”的要求,则合成的物质的最简式应满足CH2O,则②、④符合。
