专题1化学反应中的能量变化 第2单元 化学能与电能的转化 第3课时电解池的工作原理及应用
文档属性
| 名称 | 专题1化学反应中的能量变化 第2单元 化学能与电能的转化 第3课时电解池的工作原理及应用 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-05-29 00:00:00 | ||
图片预览











文档简介
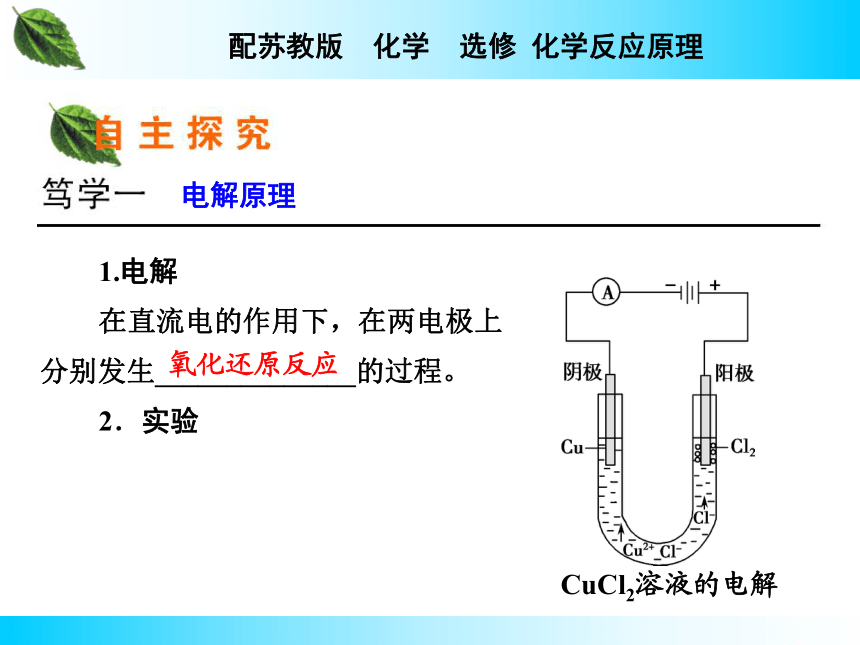
课件49张PPT。第3课时 电解池的工作原理及应用1.电解
在直流电的作用下,在两电极上分别发生______________的过程。
2.实验电解原理氧化还原反应 CuCl2溶液的电解 红色的铜 刺激性气味气体 蓝 2Cl--2e-===Cl2↑ Cu2++2e-===Cu 电解
3.电解池
把______能转变为______能的装置,叫电解池。
在电解池中,与电源负极相连的电极是______,在阴极上发生______反应;与电源______相连的电极是阳极,在阳极上发生______反应。电化学阴极还原正极氧化电解原理的应用2Cl--2e-===Cl2↑ 2H++2e-===H2↑ 2.电镀及金属精炼
(1)概念:应用电解原理在某些金属或非金属材料表面镀上一薄层其他金属或合金的过程。
(2)主要目的是使金属增强抗腐蚀能力,增加美观和表面硬度。
(3)电镀时,________________作阴极,________作阳极,用含有______________的溶液作电解质溶液。
(4)应用:电解精炼铜时,用__________作阴极,__________作阳极,__________作电解液。待镀的金属制品 镀层金属 镀层金属离子 纯铜板粗铜板CuSO4溶液 3.电冶金
由于电解是最强有力的氧化还原手段,所以电解法是冶炼像钠、钙、镁、铝这些活泼金属的重要方法。如电解熔融NaCl制备金属钠,电极反应:阴极:2Na++2e-===2Na,阳极:______________________________,总反应:
__________________________________。2Cl--2e-===Cl2↑
【慎思1】 电解质溶液导电与金属导电过程一样吗?
【答案】不一样,金属导电是因为金属中存在自由电子,是自由电子的定向移动形成电流,是物理过程,而电解质溶液是靠溶液中的自由离子定向移动形成电流,并在两极发生氧化还原反应。【慎思2】 思考并讨论,如何确定电解池的阴、阳极?
【答案】(1)通过与直流电源的连接:
阳极——连接电源正极;阴极——连接电源负极。
(2)通过发生的反应:
阳极——发生氧化反应;阴极——发生还原反应。
(3)通过电子流向及反应中电子得失:
阳极——电子流出,反应中失电子;
阴极——电子流入,反应中得电子。【慎思3】 根据所列出条件,选出组装一电解池的物质(用短线连接)。
①电源 a.干电池
b.照明线路中插座
c.乙醇
②电解液 d.KCl溶液
e.硅酸
③电极 f.石英
g.石墨
【答案】①电源——a.干电池
②电解液——d.KCl溶液
③电极——g.石墨
【慎思4】 电解饱和食盐水时阴极区溶液为什么呈碱性?
【答案】电解饱和食盐水过程中,因离子放电顺序为H+>Na+,所以H+在阴极上得电子而生成H2,破坏了水的电离平衡,促进了水的电离;使阴极区溶液中c(OH-)>c(H+),所以阴极区溶液呈碱性。【慎思5】 电镀和电解精炼过程中电解质溶液的变化有何不同?
【答案】(1)电镀时,以镀层金属作阳极时,阳极消耗的金属离子与阴极析出的金属阳离子完全相等,因此电镀液的浓度不变。
(2)电解精炼铜时,以粗铜为材料作阳极属于活性电极,粗铜有杂质(锌、铁、镍、银、金等),当铜不断溶解时,位于金属活动性顺序铜之前的金属如Zn、Fe、Ni等,也会失去电子,如Zn-2e-===Zn2+。但它们的阳离子氧化性比铜弱,并不在阴极析出,而只是留在电解液里。故Cu2+的浓度减小。电解原理2.电极反应式书写
书写电极反应式,判断是关键,“四步法”可帮你确定电极反应式的书写。
第一步:判断阴、阳极。
第二步:判断阴、阳离子的移动,阳离子移向阴极,阴离子移向阳极。
第三步:判断离子(或电极材料)的放电顺序。在第二步中将离子按阴、阳离子分开判断,谁强谁先放电。
第四步:根据得失电子守恒,判断并书写电极反应式。【例1】如下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加,据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________;
③列式计算电极b上生成的气体在标准状态下的体积:____________________________________________________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化?简述其原因:
甲溶液__________________________________________;
乙溶液_ ________________________________________;
丙溶液__________________________________________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行?为什么? _________________________________________ ____________________________________________________。解析 (1)①乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中电解K2SO4溶液,相当于电解水,设电解的水的质量为x,由电解前后溶质质量相等有:100 g×10.00%=(100 g-x)×10.47%,得x≈4.5 g,故为0.25 mol,整个反应中转移0.5 mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。 ②甲中相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-===2H2O+O2↑。
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应判断电解后溶液pH的变化,其方法如下:
(1)若电解产物只有H2而无O2,则pH变大;
(2)若电解产物只有O2而无H2,原溶液呈酸性,则pH变小;
(3)若电解产物既有O2又有H2,原溶液呈酸性,则pH变小,原溶液呈碱性,则pH变大,原溶液呈中性,则pH不变。【体验1】下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴紫色石蕊溶液。下列实验现象中,正确的是( )。
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
【答案】D1.惰性电极电解电解质溶液规律电解规律及其应用2.电化学计算的基本方法
电化学的计算方法可归纳为下列三种:
(1)根据电子守恒法计算:用于串联电路,其依据是电路中转移的电子总数相等。
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式计算。
(3)根据关系式计算:依据得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。3.电解饱和食盐水、电解精炼铜和电镀铜的比较【例2】电解原理在化学工业中有广泛的应用。下图表示一个电解池,装有电解液a。X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应为____________,在X极附近观察到的现象是_______________________________。
②Y电极上的电极反应为____________,检验该电极反应产物的方法是 _____________________________________。
(2)如果用电解法精炼铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_______________,电极反应为____________________________________。
②Y电极的材料是__________________,电极反应为________________________________________________。
(说明:杂质发生的电极反应不必写出)
解析 (1)用惰性电极电解饱和食盐水时,阳极反应:2Cl--2e-===Cl2↑;阴极反应:2H++2e-===H2↑,与电源正极相连的为阳极,反之为阴极,所以X为阴极,Y为阳极,X极在反应过程中消耗了H2O电离出来的H+,使OH-浓度增大,溶液呈碱性,加入酚酞试液,溶液变成红色;Y极产生Cl2,能使湿润的KI淀粉试纸变为蓝色。
(2)用电解法精炼铜时,用含杂质的Cu作阳极,精Cu作阴极,反应过程中阳极上的Cu以及比Cu活泼的金属失去电子,成为离子,进入溶液,活泼性比Cu差的金属形成阳极泥;在阴极只有Cu2+能得电子成为单质,其他较活泼的金属对应的离子不能得电子。根据装置图,X为阴极,Y为阳极,所以X电极的材料是精铜,电极反应为Cu2++2e-===Cu;Y电极的材料是粗铜,电极反应为Cu-2e-===Cu2+。
答案 (1)①2H++2e-===H2↑ 有气泡冒出,溶液变红 ②2Cl--2e-===Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
(2)①精铜 Cu2++2e-===Cu ②粗铜 Cu-2e-===Cu2+以惰性电极电解电解质水溶液,分析电解反应的一般方法步骤:
(1)分析电解质水溶液的组成,找全离子并分为阴、阳两组;
(2)对阴、阳离子排出放电顺序,写出两极上的电极反应式;
(3)合并两个电极反应式得出电解反应的总化学方程式或离子方程式。【体验2】关于电解NaCl水溶液,下列叙述正确的是( )
A.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.电解时在阳极得到氯气,在阴极得到金属钠
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
【答案】B【案例】 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,反应仪器如下图。
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。实验探究五 利用电解原理进行定量测定的实验设计请回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同):
E接________,C接________,______接F。实验线路中的电流方向为______―→________―→________―→_______ ―→________―→________。
(2)写出B电极上发生反应的离子方程式______________,
G试管中淀粉KI溶液变化的现象为______________,相应的离子方程式是______________________________________。(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________(填序号)。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜并称量 ⑥再次低温烘干刮下的铜并称量 ⑦再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19库仑。试列出阿伏加德罗常数计算表达式:NA=_________________________________ _________________________________________________________________________________________________。
【解释】(1)G为Cl2的吸收装置,所以B为阳极,A为阴极,则仪器的连接顺序为E接D,C接A,B接F。实验线路中的电流方向与电子流向正好相反,为F→B→A→C→D→E。
(2)B电极产生Cl2,电极反应的离子方程式为2Cl--2e-===Cl2↑,它使淀粉KI溶液变蓝,离子方程式为Cl2+2I-===2Cl-+I2。
在直流电的作用下,在两电极上分别发生______________的过程。
2.实验电解原理氧化还原反应 CuCl2溶液的电解 红色的铜 刺激性气味气体 蓝 2Cl--2e-===Cl2↑ Cu2++2e-===Cu 电解
3.电解池
把______能转变为______能的装置,叫电解池。
在电解池中,与电源负极相连的电极是______,在阴极上发生______反应;与电源______相连的电极是阳极,在阳极上发生______反应。电化学阴极还原正极氧化电解原理的应用2Cl--2e-===Cl2↑ 2H++2e-===H2↑ 2.电镀及金属精炼
(1)概念:应用电解原理在某些金属或非金属材料表面镀上一薄层其他金属或合金的过程。
(2)主要目的是使金属增强抗腐蚀能力,增加美观和表面硬度。
(3)电镀时,________________作阴极,________作阳极,用含有______________的溶液作电解质溶液。
(4)应用:电解精炼铜时,用__________作阴极,__________作阳极,__________作电解液。待镀的金属制品 镀层金属 镀层金属离子 纯铜板粗铜板CuSO4溶液 3.电冶金
由于电解是最强有力的氧化还原手段,所以电解法是冶炼像钠、钙、镁、铝这些活泼金属的重要方法。如电解熔融NaCl制备金属钠,电极反应:阴极:2Na++2e-===2Na,阳极:______________________________,总反应:
__________________________________。2Cl--2e-===Cl2↑
【慎思1】 电解质溶液导电与金属导电过程一样吗?
【答案】不一样,金属导电是因为金属中存在自由电子,是自由电子的定向移动形成电流,是物理过程,而电解质溶液是靠溶液中的自由离子定向移动形成电流,并在两极发生氧化还原反应。【慎思2】 思考并讨论,如何确定电解池的阴、阳极?
【答案】(1)通过与直流电源的连接:
阳极——连接电源正极;阴极——连接电源负极。
(2)通过发生的反应:
阳极——发生氧化反应;阴极——发生还原反应。
(3)通过电子流向及反应中电子得失:
阳极——电子流出,反应中失电子;
阴极——电子流入,反应中得电子。【慎思3】 根据所列出条件,选出组装一电解池的物质(用短线连接)。
①电源 a.干电池
b.照明线路中插座
c.乙醇
②电解液 d.KCl溶液
e.硅酸
③电极 f.石英
g.石墨
【答案】①电源——a.干电池
②电解液——d.KCl溶液
③电极——g.石墨
【慎思4】 电解饱和食盐水时阴极区溶液为什么呈碱性?
【答案】电解饱和食盐水过程中,因离子放电顺序为H+>Na+,所以H+在阴极上得电子而生成H2,破坏了水的电离平衡,促进了水的电离;使阴极区溶液中c(OH-)>c(H+),所以阴极区溶液呈碱性。【慎思5】 电镀和电解精炼过程中电解质溶液的变化有何不同?
【答案】(1)电镀时,以镀层金属作阳极时,阳极消耗的金属离子与阴极析出的金属阳离子完全相等,因此电镀液的浓度不变。
(2)电解精炼铜时,以粗铜为材料作阳极属于活性电极,粗铜有杂质(锌、铁、镍、银、金等),当铜不断溶解时,位于金属活动性顺序铜之前的金属如Zn、Fe、Ni等,也会失去电子,如Zn-2e-===Zn2+。但它们的阳离子氧化性比铜弱,并不在阴极析出,而只是留在电解液里。故Cu2+的浓度减小。电解原理2.电极反应式书写
书写电极反应式,判断是关键,“四步法”可帮你确定电极反应式的书写。
第一步:判断阴、阳极。
第二步:判断阴、阳离子的移动,阳离子移向阴极,阴离子移向阳极。
第三步:判断离子(或电极材料)的放电顺序。在第二步中将离子按阴、阳离子分开判断,谁强谁先放电。
第四步:根据得失电子守恒,判断并书写电极反应式。【例1】如下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加,据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________;
③列式计算电极b上生成的气体在标准状态下的体积:____________________________________________________;
④电极c的质量变化是________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化?简述其原因:
甲溶液__________________________________________;
乙溶液_ ________________________________________;
丙溶液__________________________________________。
(2)如果电解过程中铜全部析出,此时电解能否继续进行?为什么? _________________________________________ ____________________________________________________。解析 (1)①乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中电解K2SO4溶液,相当于电解水,设电解的水的质量为x,由电解前后溶质质量相等有:100 g×10.00%=(100 g-x)×10.47%,得x≈4.5 g,故为0.25 mol,整个反应中转移0.5 mol电子,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。 ②甲中相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-===2H2O+O2↑。
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应判断电解后溶液pH的变化,其方法如下:
(1)若电解产物只有H2而无O2,则pH变大;
(2)若电解产物只有O2而无H2,原溶液呈酸性,则pH变小;
(3)若电解产物既有O2又有H2,原溶液呈酸性,则pH变小,原溶液呈碱性,则pH变大,原溶液呈中性,则pH不变。【体验1】下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴紫色石蕊溶液。下列实验现象中,正确的是( )。
A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
【答案】D1.惰性电极电解电解质溶液规律电解规律及其应用2.电化学计算的基本方法
电化学的计算方法可归纳为下列三种:
(1)根据电子守恒法计算:用于串联电路,其依据是电路中转移的电子总数相等。
(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式计算。
(3)根据关系式计算:依据得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。3.电解饱和食盐水、电解精炼铜和电镀铜的比较【例2】电解原理在化学工业中有广泛的应用。下图表示一个电解池,装有电解液a。X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应为____________,在X极附近观察到的现象是_______________________________。
②Y电极上的电极反应为____________,检验该电极反应产物的方法是 _____________________________________。
(2)如果用电解法精炼铜,电解液a选用CuSO4溶液,则:
①X电极的材料是_______________,电极反应为____________________________________。
②Y电极的材料是__________________,电极反应为________________________________________________。
(说明:杂质发生的电极反应不必写出)
解析 (1)用惰性电极电解饱和食盐水时,阳极反应:2Cl--2e-===Cl2↑;阴极反应:2H++2e-===H2↑,与电源正极相连的为阳极,反之为阴极,所以X为阴极,Y为阳极,X极在反应过程中消耗了H2O电离出来的H+,使OH-浓度增大,溶液呈碱性,加入酚酞试液,溶液变成红色;Y极产生Cl2,能使湿润的KI淀粉试纸变为蓝色。
(2)用电解法精炼铜时,用含杂质的Cu作阳极,精Cu作阴极,反应过程中阳极上的Cu以及比Cu活泼的金属失去电子,成为离子,进入溶液,活泼性比Cu差的金属形成阳极泥;在阴极只有Cu2+能得电子成为单质,其他较活泼的金属对应的离子不能得电子。根据装置图,X为阴极,Y为阳极,所以X电极的材料是精铜,电极反应为Cu2++2e-===Cu;Y电极的材料是粗铜,电极反应为Cu-2e-===Cu2+。
答案 (1)①2H++2e-===H2↑ 有气泡冒出,溶液变红 ②2Cl--2e-===Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色
(2)①精铜 Cu2++2e-===Cu ②粗铜 Cu-2e-===Cu2+以惰性电极电解电解质水溶液,分析电解反应的一般方法步骤:
(1)分析电解质水溶液的组成,找全离子并分为阴、阳两组;
(2)对阴、阳离子排出放电顺序,写出两极上的电极反应式;
(3)合并两个电极反应式得出电解反应的总化学方程式或离子方程式。【体验2】关于电解NaCl水溶液,下列叙述正确的是( )
A.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.电解时在阳极得到氯气,在阴极得到金属钠
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
【答案】B【案例】 某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数值,其实验方案的要点为:
①用直流电电解氯化铜溶液,反应仪器如下图。
②在电流为I A,通电时间为t s后,精确测得某电极上析出的铜的质量为m g。实验探究五 利用电解原理进行定量测定的实验设计请回答:
(1)这些仪器的正确连接顺序为(用图中标注仪器接线柱的英文字母表示,下同):
E接________,C接________,______接F。实验线路中的电流方向为______―→________―→________―→_______ ―→________―→________。
(2)写出B电极上发生反应的离子方程式______________,
G试管中淀粉KI溶液变化的现象为______________,相应的离子方程式是______________________________________。(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序是________(填序号)。
①称量电解前电极质量 ②刮下电解后电极上的铜并清洗 ③用蒸馏水清洗电解后电极 ④低温烘干电极后称量 ⑤低温烘干刮下的铜并称量 ⑥再次低温烘干刮下的铜并称量 ⑦再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19库仑。试列出阿伏加德罗常数计算表达式:NA=_________________________________ _________________________________________________________________________________________________。
【解释】(1)G为Cl2的吸收装置,所以B为阳极,A为阴极,则仪器的连接顺序为E接D,C接A,B接F。实验线路中的电流方向与电子流向正好相反,为F→B→A→C→D→E。
(2)B电极产生Cl2,电极反应的离子方程式为2Cl--2e-===Cl2↑,它使淀粉KI溶液变蓝,离子方程式为Cl2+2I-===2Cl-+I2。
