专题1化学反应中的能量变化 第3单元 金属的腐蚀与防护
文档属性
| 名称 | 专题1化学反应中的能量变化 第3单元 金属的腐蚀与防护 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-05-29 00:00:00 | ||
图片预览










文档简介
课件36张PPT。第三单元 金属的腐蚀与防护1.金属的腐蚀
金属腐蚀是金属或合金与周围环境中的物质发生化学反应而腐蚀_____的现象。一般可分为__________和___________。
(1)化学腐蚀:指金属与其他物质________发生氧化还原反应而引起的腐蚀。腐蚀过程中____电流产生。
(2)电化学腐蚀:指不纯的金属或合金发生________反应,使较活泼的金属______电子被______而引起的腐蚀。金属的腐蚀损耗化学腐蚀电化学腐蚀直接接触无原电池失去氧化 2.金属的电化学腐蚀
以钢铁腐蚀为例:
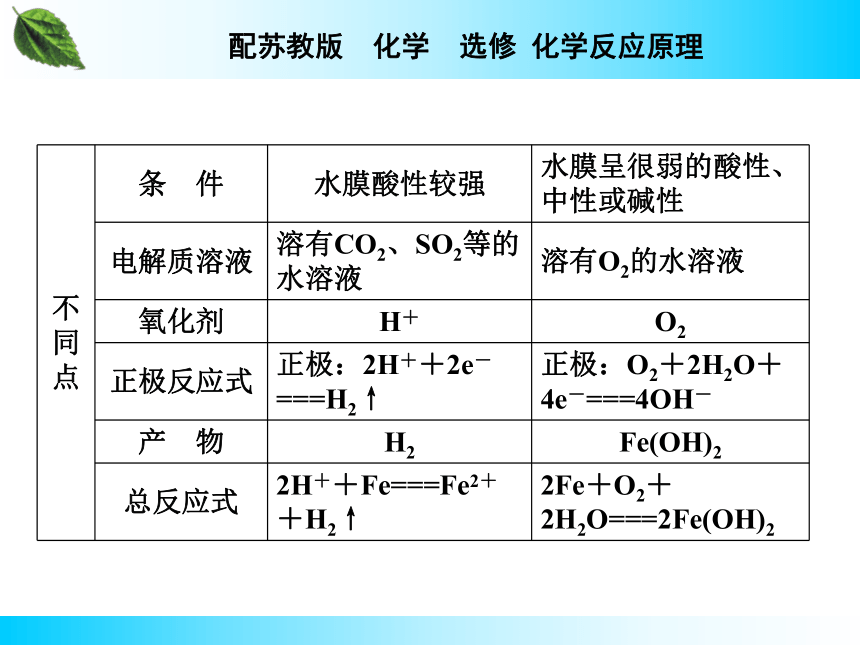
(1)吸氧腐蚀
条件:_______________;
负极:____________________;
正极:____________________________;
总反应式:____________________________。
最终生成铁锈(主要成分为Fe2O3·nH2O),反应如下:
____________________________________,
2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O。弱酸性或中性 2Fe-4e-===2Fe2+ 2H2O+O2+4e-===4OH- 2Fe+O2+2H2O===2Fe(OH)2 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)析氢腐蚀
条件:____________;
负极:_______________________;
正极:________________________;
总反应式:Fe+2H+===Fe2++H2↑。
金属的腐蚀以____________为主。较强酸性 Fe-2e-===Fe2+ 2H++2e-===H2↑ 吸氧腐蚀 1.本质:阻止金属发生________反应。
2.方法
(1)改变金属内部结构,如制成合金等。
(2)加防护层,如在金属表面
_______________________________________等。
(3)原电池原理保护
分为_________的阴极保护法和_____________________。金属的防护氧化 涂油或油漆、覆盖塑料、镀不活泼金属 牺牲阳极 外加电流的阴极保护法 【慎思1】 金属发生电化学腐蚀的原因是什么?
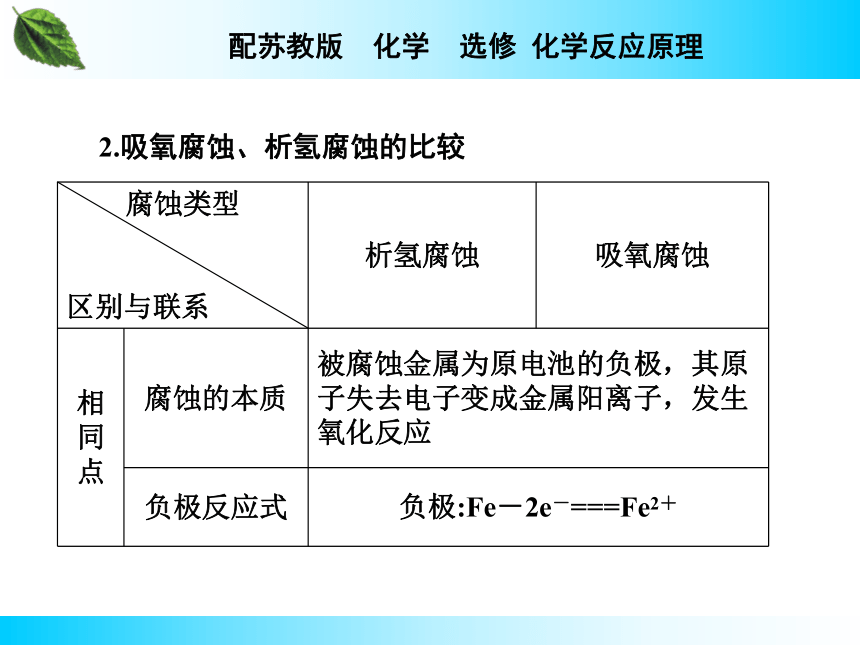
【答案】金属发生电化学腐蚀的根本原因是被腐蚀的金属成为原电池的负极,其原子失去电子变成金属阳离子而溶解。
【慎思2】 生活中金属的电化学腐蚀中析氢腐蚀与吸氧腐蚀哪个更普遍些?为什么?
【答案】吸氧腐蚀。金属活动性顺序表中氢以前的金属是在一些水膜酸性较强的情况下才发生析氢腐蚀的,氢以后的金属只能发生吸氧腐蚀,且生活中金属表面形成的水膜酸性一般较弱甚至呈中性,故以吸氧腐蚀为主。金属的腐蚀2.吸氧腐蚀、析氢腐蚀的比较
说明:(1)由于在通常情况下,金属表面不会遇到酸性较强的溶液,所以吸氧腐蚀是金属腐蚀的主要形式,而且析氢腐蚀最终也会被吸氧腐蚀所代替。
(2)电化学腐蚀中吸氧腐蚀比析氢腐蚀更为普遍,在金属活动顺序表中位于氢前面和氢之后的多数金属都能发生吸氧腐蚀,但只有在金属活动顺序表中位于氢前面的金属才可能发生析氢腐蚀。
【例1】钢铁在潮湿环境中发生电化学腐蚀时,正极所发生的主要反应是( )。
A.Fe-2e-===Fe2+
B.2H++2e-===H2↑
C.2H2O+O2+4e-===4OH-
D.4OH--4e-===2H2O+O2↑解析 钢铁在潮湿的环境中发生电化学腐蚀有两种类型:析氢腐蚀和吸氧腐蚀,在水膜酸性较强时发生析氢腐蚀,水膜呈中性或弱酸性时发生吸氧腐蚀,两者的负极反应相同,只是正极反应不同。在通常情况下,水膜为弱酸性或中性,主要发生的是吸氧腐蚀,故选择吸氧腐蚀的正极反应:2H2O+O2+4e-===4OH-。
答案 C【体验1】关于铜板上铁铆钉处的吸氧腐蚀的下列说法中,不正确的是( )。
A.正极电极反应式为2H++2e-===H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
【答案】A
【解释】铁铆钉发生吸氧腐蚀时,负极为铁,反应为2Fe-4e-===2Fe2+,正极为铜,反应为2H2O+O2+
4e-===4OH-,总反应为2Fe+O2+2H2O===2Fe(OH)2,生成的Fe(OH)2继续被空气中的O2氧化成Fe(OH)3,反应为4Fe(OH)2+O2+2H2O===4Fe(OH)3,反应中电子从负极Fe移向正极Cu,铜不被腐蚀。1.金属的腐蚀快慢和金属的防护方法的优劣
(1)各种腐蚀的程度由大到小的顺序金属的防护 (2)各种防腐蚀措施由好到差的顺序2.两种电化学防腐蚀方法的比较【例2】对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是 _____________________________________
(用离子方程式表示)。
为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________(填字母)。
a.NH3 b.CO2
c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为____________________,取少量废电解液加入NaHCO3溶液后产生气泡和白色沉淀;产生沉淀的原因是______________________________________________。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________________________________。
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。
若X为锌,开关K置于M处,该电化学防护法称为________________________________________________。
(2)电镀时,镀件作阴极,镀层金属作阳极,镀层金属的盐溶液作电解液。(3)X为碳棒,开关K接M时,Fe作负极,被腐蚀;接N时,Fe作阴极,被保护。X为Zn,开关K置于M时,形成原电池,Zn为负极,Fe为正极,属于牺牲阳极的阴极保护法。判断电化学保护法的类型,应分清其基本原理,看是利用电解原理的外加电流的阴极保护法还是应用原电池原理的牺牲阳极的阴极保护法,两者不能混淆。
【体验2】下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面被钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+
【答案】B
【解释】本题考查了金属防护的有关知识。钢管与电源正极连接,钢管作阳极,被腐蚀,A错;钢管与铜管露天堆放在一起,可形成原电池,钢管作负极被腐蚀,C错;铁被腐蚀的负极反应是Fe-2e-===Fe2+,D错。【案例】 某学生在A、B、C、D四个小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(并使铁丝完全浸没在食盐水中)。然后组装成如上图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm):实验探究六 金属腐蚀的速率(1)为什么有的导管中水面会上升?__________________ ___________________________________________________。
(2)上述实验中,铁生锈的速率由大到小的排列顺序为
_____________________(填小烧瓶的字母编号)。
(3)影响铁生锈的因素除氧气外还有___________________ ____________________________________________________。
(4)日常生活中常见的铁制品生成铁锈,试写出铁制品生成铁锈(Fe2O3·xH2O)的化学方程式_________________。
(5)通过上面的研究,你认为在日常生活中应该如何保护铁锅等铁制品_____________________________。
【答案】(1)铁丝发生吸氧腐蚀消耗氧气,使瓶内气体分子数减少,导致瓶内压强减小,因此导气管中水面上升
(2)B>C>A=D
(3)水、电解质(或电解质溶液)、温度等
(4)4Fe+3O2+2xH2O===2Fe2O3·xH2O
(5)洗净、擦干、涂油等
【解释】(1)由于在该反应条件下,铁丝发生的是吸氧腐蚀,O2被消耗,导致气压减小,因此,液面上升。(2)液面上升得越快,说明铁丝被腐蚀得越快。(3)空气湿度、电解质溶液以及温度等均是影响铁生锈快慢的原因。(5)洗净、擦干、涂油等均可起到保护铁制品的目的。
金属腐蚀是金属或合金与周围环境中的物质发生化学反应而腐蚀_____的现象。一般可分为__________和___________。
(1)化学腐蚀:指金属与其他物质________发生氧化还原反应而引起的腐蚀。腐蚀过程中____电流产生。
(2)电化学腐蚀:指不纯的金属或合金发生________反应,使较活泼的金属______电子被______而引起的腐蚀。金属的腐蚀损耗化学腐蚀电化学腐蚀直接接触无原电池失去氧化 2.金属的电化学腐蚀
以钢铁腐蚀为例:
(1)吸氧腐蚀
条件:_______________;
负极:____________________;
正极:____________________________;
总反应式:____________________________。
最终生成铁锈(主要成分为Fe2O3·nH2O),反应如下:
____________________________________,
2Fe(OH)3===Fe2O3·nH2O+(3-n)H2O。弱酸性或中性 2Fe-4e-===2Fe2+ 2H2O+O2+4e-===4OH- 2Fe+O2+2H2O===2Fe(OH)2 4Fe(OH)2+O2+2H2O===4Fe(OH)3 (2)析氢腐蚀
条件:____________;
负极:_______________________;
正极:________________________;
总反应式:Fe+2H+===Fe2++H2↑。
金属的腐蚀以____________为主。较强酸性 Fe-2e-===Fe2+ 2H++2e-===H2↑ 吸氧腐蚀 1.本质:阻止金属发生________反应。
2.方法
(1)改变金属内部结构,如制成合金等。
(2)加防护层,如在金属表面
_______________________________________等。
(3)原电池原理保护
分为_________的阴极保护法和_____________________。金属的防护氧化 涂油或油漆、覆盖塑料、镀不活泼金属 牺牲阳极 外加电流的阴极保护法 【慎思1】 金属发生电化学腐蚀的原因是什么?
【答案】金属发生电化学腐蚀的根本原因是被腐蚀的金属成为原电池的负极,其原子失去电子变成金属阳离子而溶解。
【慎思2】 生活中金属的电化学腐蚀中析氢腐蚀与吸氧腐蚀哪个更普遍些?为什么?
【答案】吸氧腐蚀。金属活动性顺序表中氢以前的金属是在一些水膜酸性较强的情况下才发生析氢腐蚀的,氢以后的金属只能发生吸氧腐蚀,且生活中金属表面形成的水膜酸性一般较弱甚至呈中性,故以吸氧腐蚀为主。金属的腐蚀2.吸氧腐蚀、析氢腐蚀的比较
说明:(1)由于在通常情况下,金属表面不会遇到酸性较强的溶液,所以吸氧腐蚀是金属腐蚀的主要形式,而且析氢腐蚀最终也会被吸氧腐蚀所代替。
(2)电化学腐蚀中吸氧腐蚀比析氢腐蚀更为普遍,在金属活动顺序表中位于氢前面和氢之后的多数金属都能发生吸氧腐蚀,但只有在金属活动顺序表中位于氢前面的金属才可能发生析氢腐蚀。
【例1】钢铁在潮湿环境中发生电化学腐蚀时,正极所发生的主要反应是( )。
A.Fe-2e-===Fe2+
B.2H++2e-===H2↑
C.2H2O+O2+4e-===4OH-
D.4OH--4e-===2H2O+O2↑解析 钢铁在潮湿的环境中发生电化学腐蚀有两种类型:析氢腐蚀和吸氧腐蚀,在水膜酸性较强时发生析氢腐蚀,水膜呈中性或弱酸性时发生吸氧腐蚀,两者的负极反应相同,只是正极反应不同。在通常情况下,水膜为弱酸性或中性,主要发生的是吸氧腐蚀,故选择吸氧腐蚀的正极反应:2H2O+O2+4e-===4OH-。
答案 C【体验1】关于铜板上铁铆钉处的吸氧腐蚀的下列说法中,不正确的是( )。
A.正极电极反应式为2H++2e-===H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
【答案】A
【解释】铁铆钉发生吸氧腐蚀时,负极为铁,反应为2Fe-4e-===2Fe2+,正极为铜,反应为2H2O+O2+
4e-===4OH-,总反应为2Fe+O2+2H2O===2Fe(OH)2,生成的Fe(OH)2继续被空气中的O2氧化成Fe(OH)3,反应为4Fe(OH)2+O2+2H2O===4Fe(OH)3,反应中电子从负极Fe移向正极Cu,铜不被腐蚀。1.金属的腐蚀快慢和金属的防护方法的优劣
(1)各种腐蚀的程度由大到小的顺序金属的防护 (2)各种防腐蚀措施由好到差的顺序2.两种电化学防腐蚀方法的比较【例2】对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法: ①碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,原因是 _____________________________________
(用离子方程式表示)。
为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的________(填字母)。
a.NH3 b.CO2
c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应式为____________________,取少量废电解液加入NaHCO3溶液后产生气泡和白色沉淀;产生沉淀的原因是______________________________________________。 (2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是________________________________。
(3)利用右图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于________处。
若X为锌,开关K置于M处,该电化学防护法称为________________________________________________。
(2)电镀时,镀件作阴极,镀层金属作阳极,镀层金属的盐溶液作电解液。(3)X为碳棒,开关K接M时,Fe作负极,被腐蚀;接N时,Fe作阴极,被保护。X为Zn,开关K置于M时,形成原电池,Zn为负极,Fe为正极,属于牺牲阳极的阴极保护法。判断电化学保护法的类型,应分清其基本原理,看是利用电解原理的外加电流的阴极保护法还是应用原电池原理的牺牲阳极的阴极保护法,两者不能混淆。
【体验2】下列有关钢铁腐蚀与防护的说法正确的是( )
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面被钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+
【答案】B
【解释】本题考查了金属防护的有关知识。钢管与电源正极连接,钢管作阳极,被腐蚀,A错;钢管与铜管露天堆放在一起,可形成原电池,钢管作负极被腐蚀,C错;铁被腐蚀的负极反应是Fe-2e-===Fe2+,D错。【案例】 某学生在A、B、C、D四个小烧瓶中分别放入干燥的细铁丝、浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(并使铁丝完全浸没在食盐水中)。然后组装成如上图所示的四套装置,每隔一段时间测量导管中水面上升的高度,结果如下表(表中所列数据为导管中水面上升的高度/cm):实验探究六 金属腐蚀的速率(1)为什么有的导管中水面会上升?__________________ ___________________________________________________。
(2)上述实验中,铁生锈的速率由大到小的排列顺序为
_____________________(填小烧瓶的字母编号)。
(3)影响铁生锈的因素除氧气外还有___________________ ____________________________________________________。
(4)日常生活中常见的铁制品生成铁锈,试写出铁制品生成铁锈(Fe2O3·xH2O)的化学方程式_________________。
(5)通过上面的研究,你认为在日常生活中应该如何保护铁锅等铁制品_____________________________。
【答案】(1)铁丝发生吸氧腐蚀消耗氧气,使瓶内气体分子数减少,导致瓶内压强减小,因此导气管中水面上升
(2)B>C>A=D
(3)水、电解质(或电解质溶液)、温度等
(4)4Fe+3O2+2xH2O===2Fe2O3·xH2O
(5)洗净、擦干、涂油等
【解释】(1)由于在该反应条件下,铁丝发生的是吸氧腐蚀,O2被消耗,导致气压减小,因此,液面上升。(2)液面上升得越快,说明铁丝被腐蚀得越快。(3)空气湿度、电解质溶液以及温度等均是影响铁生锈快慢的原因。(5)洗净、擦干、涂油等均可起到保护铁制品的目的。
