专题1 化学反应中的能量变化 归纳整合
图片预览











文档简介
课件45张PPT。专 题 归 纳 整 合请分别用一句话表达下列关键词:
反应热 量热计 反应焓变 热化学方程式 盖斯定律
原电池 电池反应 电解 电解池 电极反应 电镀
金属腐蚀 牺牲阳极的阴极保护法提示 反应热:在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为该反应在此温度下的反应热。
量热计:用于测定反应热的仪器。
反应焓变:反应产物的总焓与反应物的总焓的差值。
热化学方程式:能够表示反应热的化学方程式。
盖斯定律:一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。原电池:把化学能转化为电能的装置。
电池反应:原电池的两个电极反应组成电池的总反应。
电解:在直流电作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
电解池:将电能转化为化学能的装置。
电极反应:在电极上进行的半反应。
电镀:应用电解原理,在某些金属或非金属材料表面镀上一薄层其他金属或合金的过程。
金属腐蚀:金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
牺牲阳极的阴极保护法:形成原电池时,被保护金属作正极(阴极),不反应受到保护;活泼金属作负极(阳极),发生反应受到腐蚀。1.如何判断吸热反应和放热反应?
提示 可从以下两个方面判断
(1)物质具有的能量大小
反应物总能量大于生成物总能量,则为放热反应;反应物总能量小于生成物总能量,则为吸热反应。依据能量守恒定律理解,若反应物总能量高于生成物总能量,那么就要放出能量,保证能量守恒,反之亦然。
(2)键能角度
化学键的大小可以粗略地计算化学反应的热效应。ΔE吸收-ΔE放出=反应物的键能总和-生成物的键能总和。若ΔE吸收-ΔE放出>0,则反应为吸热反应;若ΔE吸收-ΔE放出<0,则反应是放热反应。2.常见的吸热反应和放热反应有哪些?
提示 常见的放热反应:(1)所有的燃烧反应;(2)酸碱中和反应;(3)金属与酸反应生成H2的反应;(4)CaO固体溶于水等。
常见的吸热反应:如NH4Cl与Ca(OH)2反应制NH3,H2还原CuO,乙醇制C2H4,浓盐酸制Cl2以及CaCO3、Mg(OH)2等的分解反应。3.书写热化学方程式应注意哪些问题?
提示 (1)要在反应物和生成物的化学式后面用括号注明各物质的聚集状态。一般用英文字母g、l和s分别表示气态、液态和固态,水溶液中的溶质则用aq表示。
(2)在ΔH后要注明反应温度,因为同一反应在不同温度下进行时,其焓变是不同的,对于298 K时进行的反应,可以不注明温度。
(3)ΔH的单位是J·mol-1或kJ·mol-1。
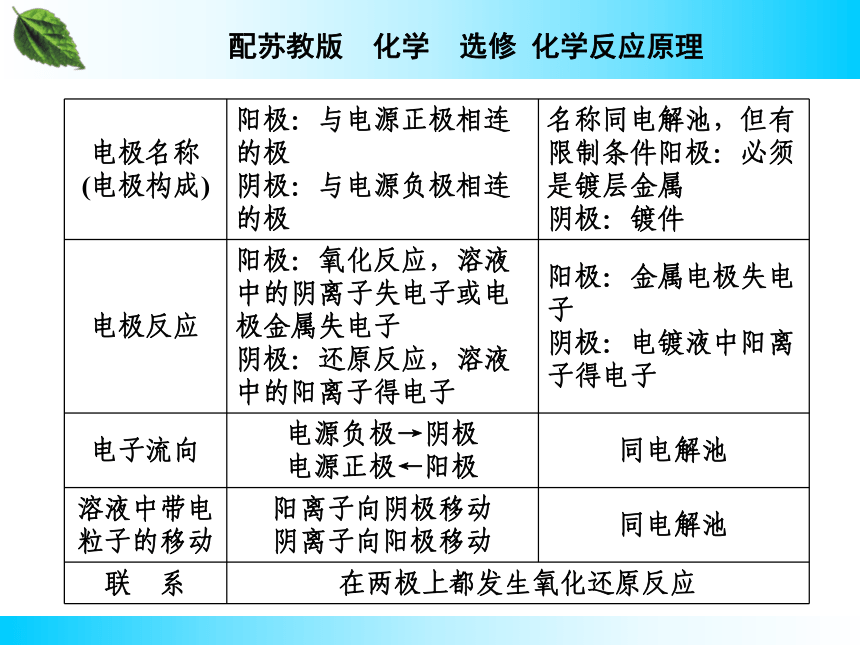
(4)根据焓的性质,若化学方程式中各物质的系数加倍,则ΔH数值的绝对值也加倍;若反应逆向进行,则ΔH的数值改变符号,但绝对值不变。4.电镀池与电解池的区别与联系?
提示 5.铜的精炼与电镀铜的主要区别是什么?
提示 6.金属腐蚀的类型有哪些?1.书写热化学方程式有什么防错诀窍?
提示 热化学方程式书写时常有以下错误:
(1)漏写反应物或生成物的聚集状态,产生此错误的原因是没有认识到反应热与物质的聚集状态有关。
(2)将ΔH的正、负混淆,其关键是没有理解“+”“-”所表示的意义。(3)未注意到化学计量数不同,其反应热的数值也不同。反应热的单位是kJ·mol-1,为每摩尔反应的热效应,故化学计量数不同时,每摩尔反应所消耗的反应物的物质的量不同,所以热效应不同。
(4)未看清题目要求。写热化学方程式,答案不是唯一的,根据化学计量数的不同,ΔH也不同;写表示燃烧热的热化学方程式,可燃物的化学计量数必须为1,答案是唯一的。2.燃烧热和中和热有什么异同?
提示 3.有关电解问题的解题步骤是怎样的?
提示 (1)明确电极反应规律
①阴极:得电子,还原反应。
(一般)电极本身不参加反应,一定是电解质溶液中阳离子“争”得电子。
②阳极:失电子,氧化反应。
若为活性电极,则电极本身参加反应;若为惰性电极,则电解质溶液中阴离子失电子而被氧化。
(3)联系分析电解问题的基本思路模式
①通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-。
②通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁先放电。
③写电极反应,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的变化、pH的变化等。
(4)判断电解后溶液pH变化的方法
根据原溶液的酸、碱性和电极产物即可对电解后溶液pH的变化作出正确的判断,其方法如下:
①若电极产物只有H2而无O2,则pH变大。
②若电极产物只有O2而无H2,则pH变小。
③若电极产物既有O2又有H2,原溶液呈酸性则pH变小,原溶液呈碱性则pH变大,原溶液呈中性则pH不变。 4.电化学中的计算有哪几种情况?
提示 (1)原电池和电解池的计算常涉及的问题
①两极产物的定量计算。
②溶液pH的计算[pH=-lg c(H+)]。
③相对原子质量的计算和阿伏加德罗常数的值的测定。
④根据转移电子的量求产物的量或根据产物的量求转移电子的量。
(2)常用的三种方法
①根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等。
②根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)步骤
①根据现象或其他条件(如果是电解池,可以根据与电源正负极的连接情况),准确判定电极上发生氧化还原反应的类型和电极名称。
②准确写出电极反应式。
③根据题目所给条件和所要求解的问题,使用上述合适的方法建立等量关系求解。学科思想培养一
新型化学电源的命题角度及解题指导
我们见到的新型电池有“氢镍电池”“高铁电池”“锌—锰碱性电池”、我国首创的“海洋电池”“燃料电池”(如新型细菌燃料电池、氢氧燃料电池、丁烷燃料电池、甲醇质子交换膜燃料电池、CO燃料电池、镁燃料电池)、“锂离子电池”“银锌电池”“纽扣电池”等。这些电池一般具有高能环保、经久耐用、电压稳定、比能量(单位质量释放的能量)高等特点。
取材于这些知识点的试题,由于题材广、信息新、陌生度大,所以大多数学生对这类试题感到难,而难在何处又十分迷茫。实际上这些题目主要考查的是学生迁移应用的能力。具体有以下几种考查角度。【知识基础】 在Zn—Cu原电池中,较活泼的金属材料作负极,较不活泼的金属材料或非金属材料作正极。
负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。方向一 新型电池“放电”时正极、负极的判断【解题指导】 【例1】被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O==ZnO+2MnOOH。下列说法正确的是 ( )
A.该电池的正极为锌?
B.该电池反应中二氧化锰起催化剂作用?
C.当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023??
D.电池正极反应式为2MnO2+2e-+2H2O==2MnOOH+
2OH-解析 由总反应式可知,二氧化锰为氧化剂而不是催化剂,锌为还原剂,应为原电池的负极,A、B错;电子只能经外电路流动,而不能在电解液中流动,电解液内电流的形成是由于阴、阳离子的定向移动,C错;电池负极反应式为Zn-2e-+H2O==ZnO+2H+,用总反应式减去负极反应式得正极反应式为2MnO2+2e-+2H2O==2MnOOH+2OH-。
答案 D方向二 新型电池“放电”时正极、负极上电极反应式的书写【解题指导】
首先分析物质得失电子的情况,然后再考虑电极反应生成的物质是否跟电解质溶液中的离子发生反应。对于较为复杂的电极反应,可以利用总反应减去较简单一极的电极反应式,等于较复杂一极的电极反应式的方法解决。 【例2】结合图示判断,下列叙述正确的是( )
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6] 溶液,均有蓝色沉淀
解析 本题考查原电池的工作原理,意在考查考生对原电池的工作原理的掌握情况。活泼金属作负极,失去电子,正极金属被保护,A选项正确;Ⅰ中锌作负极、Ⅱ中铁作负极,电极反应不同,B选项错误;Ⅰ中发生吸氧腐蚀,正极有OH-生成,Ⅱ中发生析氢腐蚀,正极有H2生成,C选项错误;Ⅰ中无铁离子,D选项错误。
答案 A【知识基础】 充电的实质就是把放电时发生的变化再复原的过程。如铅蓄电池:方向三 新型电池“充电”时阴极、阳极的判断
【解题指导】
首先应搞明白原电池放电时的正、负极,再根据电池充电时,阳极接正极,阴极接负极的原理,进行分析。【例3】铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O解析 本题考查充电电池的有关知识,意在考查考生对充电电池正、负极的判断及书写电极反应的能力。在铁镍蓄电池中,Fe是负极,Ni2O3是正极,由于生成Fe(OH)2,则电解液为碱性溶液,故A正确;电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2,故B正确;电池充电时,阴极反应式为Fe(OH)2+2e-===Fe+2OH-,阴极附近溶液pH升高,故C错误;由充电时的总反应式减去阴极反应式,可得到阳极反应式,故D正确。
答案 C【知识基础】 原电池中,阳离子移向正极,阴离子移向负极,如Zn—Cu(稀H2SO4)电池中,H+移向Cu极,SO移向Zn极。电解池中,阳离子移向阴极,阴离子移向阳极,符合带电微粒在电场中的运动规律。
【解题指导】
首先应分清电池是放电还是充电;再判断出正、负极或阴、阳极,进而即可确定离子的移动方向。方向四 新型电池充、放电时,电解质溶液中离子移动方向 的判断【例4】研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂?
B.放电时正极上有氢气生成?
C.放电时OH-向正极移动?
D.总反应为2Li+2H2O === 2LiOH+H2↑解析 本题考查原电池工作原理及考生解决新情境中实际问题的能力。该电池的负极是锂,氧化剂水在正极上得到电子生成氢气,电解质是LiOH,故A、B、D项正确;原电池中OH-向负极移动,故C项错误。
答案 C
反应热 量热计 反应焓变 热化学方程式 盖斯定律
原电池 电池反应 电解 电解池 电极反应 电镀
金属腐蚀 牺牲阳极的阴极保护法提示 反应热:在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为该反应在此温度下的反应热。
量热计:用于测定反应热的仪器。
反应焓变:反应产物的总焓与反应物的总焓的差值。
热化学方程式:能够表示反应热的化学方程式。
盖斯定律:一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。原电池:把化学能转化为电能的装置。
电池反应:原电池的两个电极反应组成电池的总反应。
电解:在直流电作用下,电解质在两个电极上分别发生氧化反应和还原反应的过程。
电解池:将电能转化为化学能的装置。
电极反应:在电极上进行的半反应。
电镀:应用电解原理,在某些金属或非金属材料表面镀上一薄层其他金属或合金的过程。
金属腐蚀:金属或合金与周围环境中的物质发生化学反应而腐蚀损耗的现象。
牺牲阳极的阴极保护法:形成原电池时,被保护金属作正极(阴极),不反应受到保护;活泼金属作负极(阳极),发生反应受到腐蚀。1.如何判断吸热反应和放热反应?
提示 可从以下两个方面判断
(1)物质具有的能量大小
反应物总能量大于生成物总能量,则为放热反应;反应物总能量小于生成物总能量,则为吸热反应。依据能量守恒定律理解,若反应物总能量高于生成物总能量,那么就要放出能量,保证能量守恒,反之亦然。
(2)键能角度
化学键的大小可以粗略地计算化学反应的热效应。ΔE吸收-ΔE放出=反应物的键能总和-生成物的键能总和。若ΔE吸收-ΔE放出>0,则反应为吸热反应;若ΔE吸收-ΔE放出<0,则反应是放热反应。2.常见的吸热反应和放热反应有哪些?
提示 常见的放热反应:(1)所有的燃烧反应;(2)酸碱中和反应;(3)金属与酸反应生成H2的反应;(4)CaO固体溶于水等。
常见的吸热反应:如NH4Cl与Ca(OH)2反应制NH3,H2还原CuO,乙醇制C2H4,浓盐酸制Cl2以及CaCO3、Mg(OH)2等的分解反应。3.书写热化学方程式应注意哪些问题?
提示 (1)要在反应物和生成物的化学式后面用括号注明各物质的聚集状态。一般用英文字母g、l和s分别表示气态、液态和固态,水溶液中的溶质则用aq表示。
(2)在ΔH后要注明反应温度,因为同一反应在不同温度下进行时,其焓变是不同的,对于298 K时进行的反应,可以不注明温度。
(3)ΔH的单位是J·mol-1或kJ·mol-1。
(4)根据焓的性质,若化学方程式中各物质的系数加倍,则ΔH数值的绝对值也加倍;若反应逆向进行,则ΔH的数值改变符号,但绝对值不变。4.电镀池与电解池的区别与联系?
提示 5.铜的精炼与电镀铜的主要区别是什么?
提示 6.金属腐蚀的类型有哪些?1.书写热化学方程式有什么防错诀窍?
提示 热化学方程式书写时常有以下错误:
(1)漏写反应物或生成物的聚集状态,产生此错误的原因是没有认识到反应热与物质的聚集状态有关。
(2)将ΔH的正、负混淆,其关键是没有理解“+”“-”所表示的意义。(3)未注意到化学计量数不同,其反应热的数值也不同。反应热的单位是kJ·mol-1,为每摩尔反应的热效应,故化学计量数不同时,每摩尔反应所消耗的反应物的物质的量不同,所以热效应不同。
(4)未看清题目要求。写热化学方程式,答案不是唯一的,根据化学计量数的不同,ΔH也不同;写表示燃烧热的热化学方程式,可燃物的化学计量数必须为1,答案是唯一的。2.燃烧热和中和热有什么异同?
提示 3.有关电解问题的解题步骤是怎样的?
提示 (1)明确电极反应规律
①阴极:得电子,还原反应。
(一般)电极本身不参加反应,一定是电解质溶液中阳离子“争”得电子。
②阳极:失电子,氧化反应。
若为活性电极,则电极本身参加反应;若为惰性电极,则电解质溶液中阴离子失电子而被氧化。
(3)联系分析电解问题的基本思路模式
①通电前:电解质溶液中含有哪些阴、阳离子(包括水电离出的H+和OH-。
②通电时:阴离子移向阳极,阳离子移向阴极,结合放电顺序分析谁先放电。
③写电极反应,并结合题目要求分析电解结果,如两极现象、水的电离平衡移动、离子浓度的变化、pH的变化等。
(4)判断电解后溶液pH变化的方法
根据原溶液的酸、碱性和电极产物即可对电解后溶液pH的变化作出正确的判断,其方法如下:
①若电极产物只有H2而无O2,则pH变大。
②若电极产物只有O2而无H2,则pH变小。
③若电极产物既有O2又有H2,原溶液呈酸性则pH变小,原溶液呈碱性则pH变大,原溶液呈中性则pH不变。 4.电化学中的计算有哪几种情况?
提示 (1)原电池和电解池的计算常涉及的问题
①两极产物的定量计算。
②溶液pH的计算[pH=-lg c(H+)]。
③相对原子质量的计算和阿伏加德罗常数的值的测定。
④根据转移电子的量求产物的量或根据产物的量求转移电子的量。
(2)常用的三种方法
①根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是电路上转移的电子数相等。
②根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)步骤
①根据现象或其他条件(如果是电解池,可以根据与电源正负极的连接情况),准确判定电极上发生氧化还原反应的类型和电极名称。
②准确写出电极反应式。
③根据题目所给条件和所要求解的问题,使用上述合适的方法建立等量关系求解。学科思想培养一
新型化学电源的命题角度及解题指导
我们见到的新型电池有“氢镍电池”“高铁电池”“锌—锰碱性电池”、我国首创的“海洋电池”“燃料电池”(如新型细菌燃料电池、氢氧燃料电池、丁烷燃料电池、甲醇质子交换膜燃料电池、CO燃料电池、镁燃料电池)、“锂离子电池”“银锌电池”“纽扣电池”等。这些电池一般具有高能环保、经久耐用、电压稳定、比能量(单位质量释放的能量)高等特点。
取材于这些知识点的试题,由于题材广、信息新、陌生度大,所以大多数学生对这类试题感到难,而难在何处又十分迷茫。实际上这些题目主要考查的是学生迁移应用的能力。具体有以下几种考查角度。【知识基础】 在Zn—Cu原电池中,较活泼的金属材料作负极,较不活泼的金属材料或非金属材料作正极。
负极:Zn-2e-===Zn2+;正极:2H++2e-===H2↑。方向一 新型电池“放电”时正极、负极的判断【解题指导】 【例1】被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为Zn+2MnO2+H2O==ZnO+2MnOOH。下列说法正确的是 ( )
A.该电池的正极为锌?
B.该电池反应中二氧化锰起催化剂作用?
C.当0.1 mol Zn完全溶解时,流经电解液的电子个数为1.204×1023??
D.电池正极反应式为2MnO2+2e-+2H2O==2MnOOH+
2OH-解析 由总反应式可知,二氧化锰为氧化剂而不是催化剂,锌为还原剂,应为原电池的负极,A、B错;电子只能经外电路流动,而不能在电解液中流动,电解液内电流的形成是由于阴、阳离子的定向移动,C错;电池负极反应式为Zn-2e-+H2O==ZnO+2H+,用总反应式减去负极反应式得正极反应式为2MnO2+2e-+2H2O==2MnOOH+2OH-。
答案 D方向二 新型电池“放电”时正极、负极上电极反应式的书写【解题指导】
首先分析物质得失电子的情况,然后再考虑电极反应生成的物质是否跟电解质溶液中的离子发生反应。对于较为复杂的电极反应,可以利用总反应减去较简单一极的电极反应式,等于较复杂一极的电极反应式的方法解决。 【例2】结合图示判断,下列叙述正确的是( )
A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6] 溶液,均有蓝色沉淀
解析 本题考查原电池的工作原理,意在考查考生对原电池的工作原理的掌握情况。活泼金属作负极,失去电子,正极金属被保护,A选项正确;Ⅰ中锌作负极、Ⅱ中铁作负极,电极反应不同,B选项错误;Ⅰ中发生吸氧腐蚀,正极有OH-生成,Ⅱ中发生析氢腐蚀,正极有H2生成,C选项错误;Ⅰ中无铁离子,D选项错误。
答案 A【知识基础】 充电的实质就是把放电时发生的变化再复原的过程。如铅蓄电池:方向三 新型电池“充电”时阴极、阳极的判断
【解题指导】
首先应搞明白原电池放电时的正、负极,再根据电池充电时,阳极接正极,阴极接负极的原理,进行分析。【例3】铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2O===Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O解析 本题考查充电电池的有关知识,意在考查考生对充电电池正、负极的判断及书写电极反应的能力。在铁镍蓄电池中,Fe是负极,Ni2O3是正极,由于生成Fe(OH)2,则电解液为碱性溶液,故A正确;电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2,故B正确;电池充电时,阴极反应式为Fe(OH)2+2e-===Fe+2OH-,阴极附近溶液pH升高,故C错误;由充电时的总反应式减去阴极反应式,可得到阳极反应式,故D正确。
答案 C【知识基础】 原电池中,阳离子移向正极,阴离子移向负极,如Zn—Cu(稀H2SO4)电池中,H+移向Cu极,SO移向Zn极。电解池中,阳离子移向阴极,阴离子移向阳极,符合带电微粒在电场中的运动规律。
【解题指导】
首先应分清电池是放电还是充电;再判断出正、负极或阴、阳极,进而即可确定离子的移动方向。方向四 新型电池充、放电时,电解质溶液中离子移动方向 的判断【例4】研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A.水既是氧化剂又是溶剂?
B.放电时正极上有氢气生成?
C.放电时OH-向正极移动?
D.总反应为2Li+2H2O === 2LiOH+H2↑解析 本题考查原电池工作原理及考生解决新情境中实际问题的能力。该电池的负极是锂,氧化剂水在正极上得到电子生成氢气,电解质是LiOH,故A、B、D项正确;原电池中OH-向负极移动,故C项错误。
答案 C
