第3单元《物质构成的奥秘》复习课件(共58张PPT)
文档属性
| 名称 | 第3单元《物质构成的奥秘》复习课件(共58张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-06-03 00:00:00 | ||
图片预览







文档简介
课件58张PPT。第三单元 物质构成的奥秘复习课题一 分子和原子(一)学习目标1、了解物质是由分子、原子等微粒构成的;
2、学会用微粒的性质解释日常生活中的现象。一、肉眼看不见的分子有何特点?我们知道:
1、花香能闻到,但却看不到。
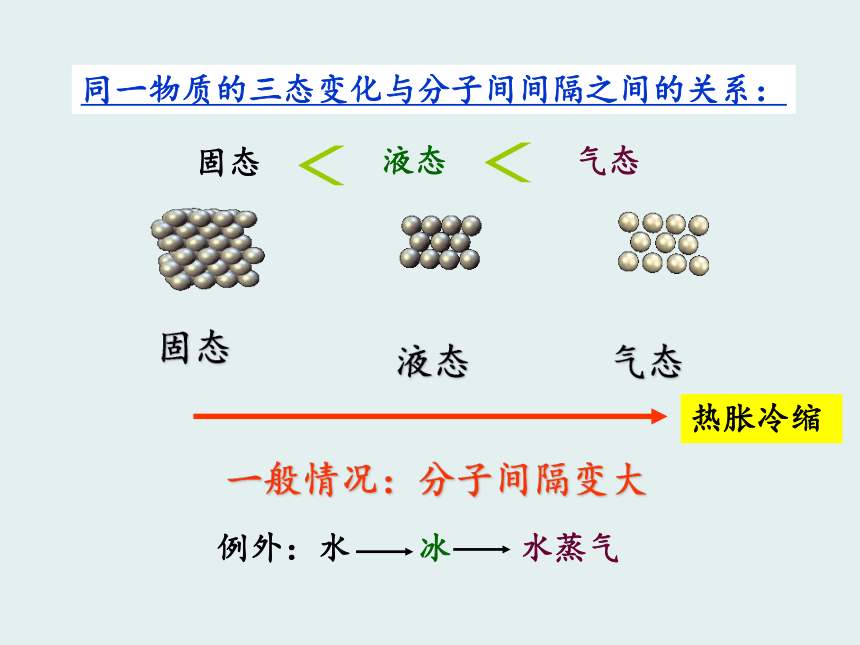
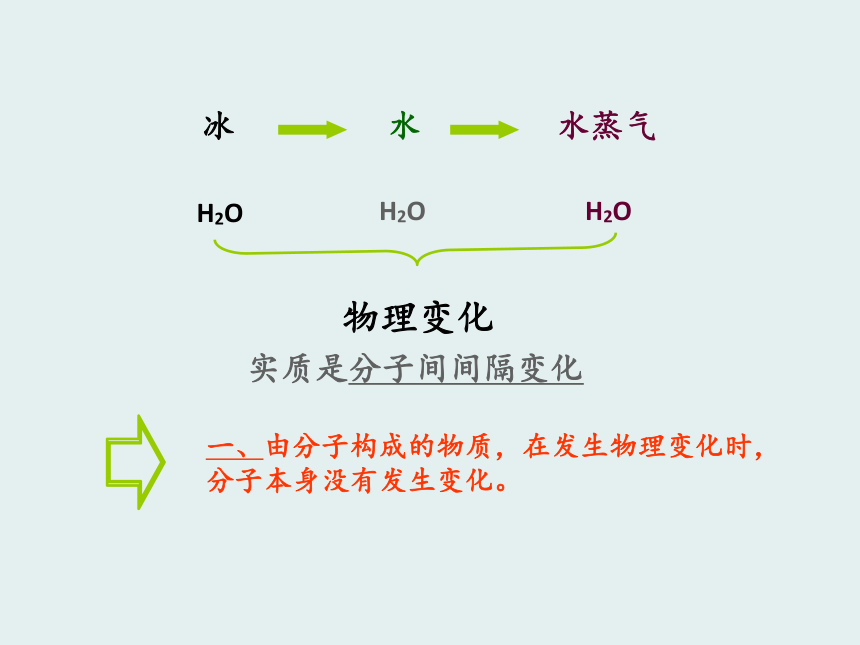
2、能看到整块糖,却看不到溶解后的糖。分子的特性之一:体积很小、质量很轻。2、分子是不断运动的,温度升高,分子能量增大,运动速率加快。分子的特性之二:分子在不断运动。实验:在不同温度的水中墨水的扩散问题:1.为什么注射器中的气体可以被压缩?3.为什么物质有三态的变化?2.为什么50ml的水和50ml的酒精两者混合后体积是否等于100毫升?3、分子的特性之三:分子间有间隔。同一物质的三态变化与分子间间隔之间的关系:固态液态气态一般情况:分子间隔变大热胀冷缩3、分子的特性之三:分子间有间隔。2、分子的特性之二:分子在不断运动。1、分子的特性之一:体积很小、质量很轻。我们学到的课题一 分子和原子(二)学习目标1、分子和原子的定义;
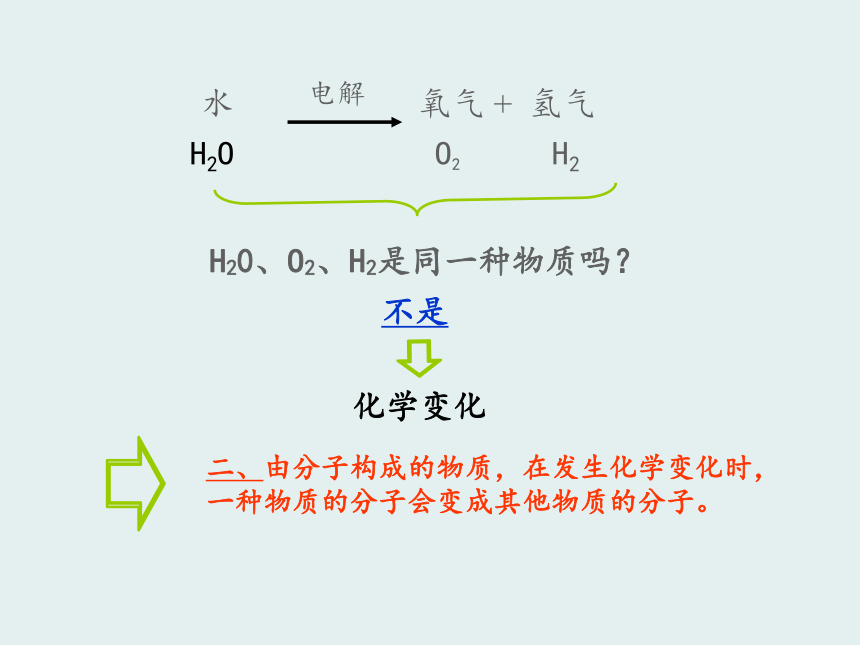
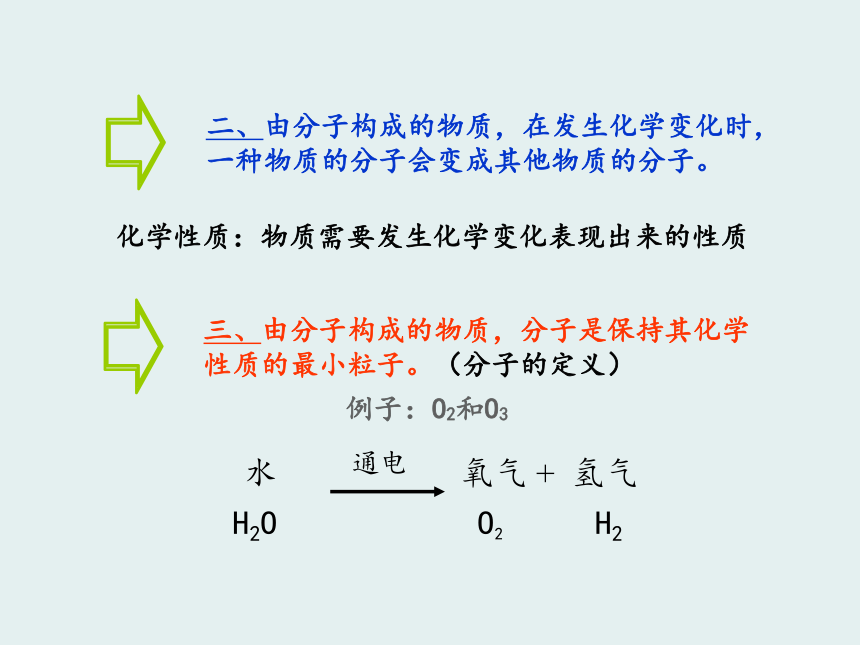
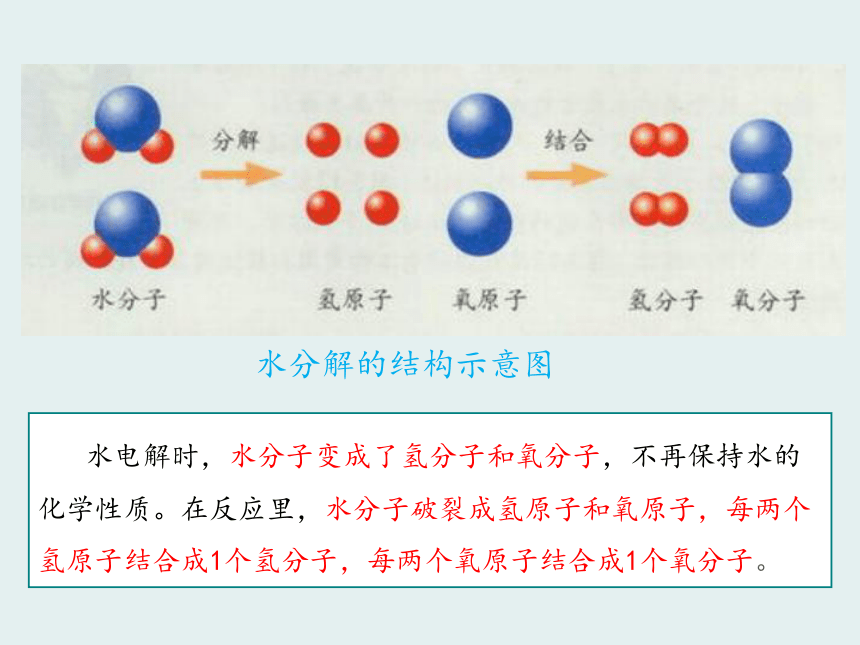
2、用分子和原子的观点解释物理变化和化学变化。 H2O O2 H2H20、O2、H2是同一种物质吗?不是化学变化化学性质:物质需要发生化学变化表现出来的性质例子:O2和O3 H2O O2 H2 水电解时,水分子变成了氢分子和氧分子,不再保持水的化学性质。在反应里,水分子破裂成氢原子和氧原子,每两个氢原子结合成1个氢分子,每两个氧原子结合成1个氧分子。在化学变化中,原子的种类发生了变化吗?没有分子是由原子构成的O2H2O由同种原子构成由不同原子构成如何描述分子由原子构成? H2O O2 H2由同种分子构成的物质是纯净物;
由多种分子构成的物质是混合物。【讨论】运用分子的概念区分纯净物和混合物1、判断下列物质是纯净物还是混合物? 纯净物 纯净物 混合物 纯净物A.分子在化学变化中不可分
B.反应后生成了两种新的化合物
C.该反应属于分解反应
D.该反应属于化合反应 2、下图是两种气体发生反应的微观示意图,其中相同的球代表同种原子。下列说法正确的是( )D你学到了什么?思考1、物质三态的体积为何不一样?为什么气体容易压缩,液体、固体不容易压缩?2、物体为何都有热胀冷缩现象?答:因为它们分子间的间隔不同。气体分子间的
间隔大,液体、固体间的间隔小。答:因为受热时分子间的间隔变大,遇冷时
分子间的间隔变小。3、湿衣服凉在太阳的地方比阴凉的地方干得快,为什么?答:因为阳光照射下,气温较高,水分子运动的速率更快,水分就更容易蒸发进入空气。4、固态酒精、液态酒精、气态酒精都能燃烧,而水不能燃烧,这一实验现象说明了什么?答:同种分子性质相同,不同种分子性质不相同。同学们,请你们数一数,图中一共有多少个分子?一共有多少种分子?3、对下列实验现象的解释错误的是( )C复习 1、在电解水的实验中,水 分解为氧 和氢 ,每 个氧原子重新组合一个氧 ,每两个氢原子重新组合一个氢 。
由此可知:分子是由 构成的,分子在化学反应中可以再分成 ,而原子在化学变化中却 ,即原子是 。分子 原子 两分子 分子 原子 化学变化中的最小的粒子原子 不可再分原子 一、原子的构成原 子(带正电)(带正电)(带负电)(不带电)(不带电)每个质子带一个
单位正电荷每个电子带一个
单位负电荷观察表格(表3-1) ,你又能获得哪些信息?1、构成原子的粒子一般是质子、中子、电子2.在原子中,质子数=电子数3.质子数和中子数不一定相等,但很接近。4.不同种类的原子, 质子数不相同,核外电子数也不相同。=核电荷数不是所有的原子都有中子,氢原子的中子数为0。=原子序数将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是___________
(6)原子中数目一定相等的粒子是_______________①②③④⑤①②④③①③⑤ 离子二、相对原子质量(Ar) 相对原子质量就是以一种 的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的 。 碳原子质量的1/12Ar=注意:“相对原子质量”是一个比值,没有“克、千克……等质量单位。其国际单位为一,一般不写出来。根据定义能不能写出相对原子质量的数学计算式?碳原子质量比(定义式) 已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg, 求出氧原子的相对原子质量?有没有其它求相对原子质量的比较简单的方法呢?相对原子质量(约)=质子数+中子数原子 原子核蚂蚁 5 mm200 m注意:原子核很小,但是原子质量集中在原子核内。核外电子是分层排布的:
电子层:1 2 3 4 5 6 7
K L M N O P Q
离核:近 远
能量:低 高能量低的在离核近的区域运动,能量高的在离核远的区域运动下图是1-18号元素的原子结构示意图,看图你能找出什么规律吗?核外电子的排布规律⑴ 先排满内层,后排满外层;
⑵ 第一层上最多排2个电子;
⑶ 第二层上最多排8个电子;
⑷ 最外层上最多排8个电子. 注意:‘288’规则只适用于前三层2、认识原子结构示意图圆圈表示原子核圈内数字表示核电荷数(即质子数)弧线表示电子层弧线上的数字表示该层的电子数最外层电子数=8(He为2)相对稳定结构
不易得失电子一般<4易失电子形成稳定结构一般≥4元素的化学性质与最外层电子数关系密切结构性质易得电子形成稳定结构根据下列结构示意图判断ABCDFE其中属于稀有气体的是________属于金属元素的是______,属于非金属元素的是_______D FB CA E
1、磷原子的结构示意图为:
(1)磷原子核内有 个质子。共有____个电子层,最外层上有____电子。
(2)铝原子核外电子层数与磷原子的电子层数相同,但最外层电子数比磷原子最外层电子数少2个,则铝原子结构示意图为 。
1535DNaCl的形成Na失去1个e-,
Cl得到1个e-1、离子:带电荷的原子或原子团离子阳离子:带正电荷的原子叫做阳离子。
如: H+ 、Na+、 Mg2+ 、Al3+阴离子:带负电荷的原子叫做阴离子。
如: O2- 、S2-、 F- 、Cl-写法:先写元素符号,再在元素符号右上角标所带电荷数及电性.例: 注意:只有1个电荷时,1省略不写S2-Cl-Mg2+2、离子所带电荷数由该元素原子得失电子决定。 表示镁离子右上角“2+”的意义:镁离子带2个单位的正电荷你能说出4Mg2+的意义吗?4个镁离子考考你例如:带3个正电荷的铁离子_____
4O2-表示 _______ ,7个钠离子_____Fe3+4个氧离子7Na+3、离子符号的意义[例1] 六种粒子结构示意图分别为:
(1)A、B、C、D、E、F共表示 种元素。
(2)表示原子的粒子是__________(填序号,下同)。
(3)表示阳离子的粒子是 。
(4)表示阴离子的是___________。ACF D E B四 [2]某粒子结构示意图为 (1)x表示 ,该粒子有___个电子层,y与粒子的__________关系非常密切。
(2)当x=10+Y,该粒子为_______(填类别)。
(3)y=8时,该粒子带有2个单位的负电荷,该粒子的符号为 。
(4)NaCl是由_____________构成。 核内的质子数 3 化学性质 原子 S2- Na+和Cl-(4)下列各对微粒中,质子数相同,电子数也相同的是( )
A.S和S2- B.F-和Mg2+
C.Ne和H2O D.Na和Na+ C (5)原子得到或失去电子后形成离子。某离子的结构示意图为
①当a= 时,该粒子是原子。
②当a=8时,该粒子是__________(填“原子”、“阳离子”或“阴离子”),其符号为 。原子离子10阴离子O2-一、元素元素是质子数(即核电荷数)相同的一类原子的总称。1.概念它们的质子数都是1,属于氢元素(1)元素是原子的集合体,是一个宏观的概念;例:“一个氧元素”这句话对吗?错水由________________构成;
一个水分子由________________________构成;
水由________________组成;水分子一个氧原子和两个氢原子氢元素和氧元素请思考原子可以构成分子,也可以直接构成物质,元素组成物质;水由________________构成;
一个水分子由________________________构成;
水由________________组成;水分子一个氧原子和两个氢原子氢元素和氧元素请思考(2)化学反应前后,分子种类发生了变化,元素种类没有发生变化。分析讨论:下述化学反应中:分子和元素的种类是否发生了改变反应前后,分子和元素,哪个发生了变化?2.元素的分布(1)元素在地壳中的含量分布(按质量计)注意:
a、地壳中含量前五的元素为氧(O)、硅(Si)、铝(Al)、铁(Fe)、钙(Ca);
b、地壳中含量前二的金属元素和非金属元素分别是氧和硅、铝和铁。记忆方法:氧硅铝,我铁了心。
(养闺女,我铁了心)2.元素的分布(2)元素在生物体中的含量分布(按质量计)排名前三的元素氧(O)、碳(C)、氢(H)。空气中含量最多的元素:氮(N)海水中含量前四位的元素:氧(O)、氢(H)、氯(Cl)、钠(Na)补充:元素金属元素:非金属元素:3.元素分类目前已发现112种元素(一直在更新)汉字特点:带“钅”旁,“金”和“汞”例外稀有气体元素:带“石”旁 固态非金属 带“气”旁 气态非金属带“氵”旁 液态非金属 氦、氖、氩、氪、氙国际规定:用元素拉丁文名称的第一个字母大写来表示该元素,第一个字母重复的,加上第二个字母的小写。如:氢(H),氦(He)。元素符号来历元素符号书写原则“一大,二小”⑴由一个字母表示的元素符号要大写。
⑵由两个字母表示的元素符号,第一个字母大写,第二个字母小写。O C H N S 氧 碳 氢 氮 硫Fe Cu Al Mg Hg铁 铜 铝 镁 汞1、Co和CO
2、Ca和Cu
3、Ag和Hg
元素符号表示什么?宏观意义:表示氧元素微观意义:表示一个氧原子作业:指出下列各符号中“2”所表示的含义:
2H 。
2H+_____________________。
2H2O_________________;
H2O中______________________________________。
2S2-系数“2”表示:____________________。
S2-____________________________________。
2H2______________________________________。
H2______________________________________。表示2个氢原子表示2个氢离子表示2个水分子表示2个硫离子表示1个硫离子带2个单位负电荷表示2个氢原子和1个氧原子构成一个水分子表示2个氢分子表示一个氢分子由两个氢原子组成1.周期:每一横行叫一周期,共7个周期。
2.族:每一纵行叫一族(其中8、9、10三个纵行共同组成一个族)
3.元素周期表的起始:稀有气体元素4.原子序数=核电荷数=核内质子数=核外电子数金属元素非金属元素关于周期表砷74.92原子序数相对原子质量元素符号元素名称元素周期表中元素所在表格信息As33【典例1】下列关于元素的叙述中,正确的是( )
A.同种原子的统称叫元素
B.同种元素的原子结构和质量完全相同
C.元素的种类取决于该元素的核外电子数
D.不同种类元素的根本区别是核内质子数不同D知识点一、元素2.长期饮用奶制品,体内就不会缺钙。这里的“钙”是
指( )CA.钙这种金属 B.钙原子
C.钙元素 D.钙分子【典例3】(2010·南京中考)中国志愿者王跃参加了人类首次模拟火星载人航天飞行试验。有探测资料表明,火星上存在丰富的镁资源。在元素周期表中,镁元素的某些信息如图所示,下列说法不正确的是( )
A.镁元素属于非金属元素
B.镁元素原子的核电荷数为12
C.镁元素原子的核外电子数为12
D.镁元素的相对原子质量为24.31知识点三、元素周期表A 12 Mg
镁
24.31谢谢欣赏
2、学会用微粒的性质解释日常生活中的现象。一、肉眼看不见的分子有何特点?我们知道:
1、花香能闻到,但却看不到。
2、能看到整块糖,却看不到溶解后的糖。分子的特性之一:体积很小、质量很轻。2、分子是不断运动的,温度升高,分子能量增大,运动速率加快。分子的特性之二:分子在不断运动。实验:在不同温度的水中墨水的扩散问题:1.为什么注射器中的气体可以被压缩?3.为什么物质有三态的变化?2.为什么50ml的水和50ml的酒精两者混合后体积是否等于100毫升?3、分子的特性之三:分子间有间隔。同一物质的三态变化与分子间间隔之间的关系:固态液态气态一般情况:分子间隔变大热胀冷缩3、分子的特性之三:分子间有间隔。2、分子的特性之二:分子在不断运动。1、分子的特性之一:体积很小、质量很轻。我们学到的课题一 分子和原子(二)学习目标1、分子和原子的定义;
2、用分子和原子的观点解释物理变化和化学变化。 H2O O2 H2H20、O2、H2是同一种物质吗?不是化学变化化学性质:物质需要发生化学变化表现出来的性质例子:O2和O3 H2O O2 H2 水电解时,水分子变成了氢分子和氧分子,不再保持水的化学性质。在反应里,水分子破裂成氢原子和氧原子,每两个氢原子结合成1个氢分子,每两个氧原子结合成1个氧分子。在化学变化中,原子的种类发生了变化吗?没有分子是由原子构成的O2H2O由同种原子构成由不同原子构成如何描述分子由原子构成? H2O O2 H2由同种分子构成的物质是纯净物;
由多种分子构成的物质是混合物。【讨论】运用分子的概念区分纯净物和混合物1、判断下列物质是纯净物还是混合物? 纯净物 纯净物 混合物 纯净物A.分子在化学变化中不可分
B.反应后生成了两种新的化合物
C.该反应属于分解反应
D.该反应属于化合反应 2、下图是两种气体发生反应的微观示意图,其中相同的球代表同种原子。下列说法正确的是( )D你学到了什么?思考1、物质三态的体积为何不一样?为什么气体容易压缩,液体、固体不容易压缩?2、物体为何都有热胀冷缩现象?答:因为它们分子间的间隔不同。气体分子间的
间隔大,液体、固体间的间隔小。答:因为受热时分子间的间隔变大,遇冷时
分子间的间隔变小。3、湿衣服凉在太阳的地方比阴凉的地方干得快,为什么?答:因为阳光照射下,气温较高,水分子运动的速率更快,水分就更容易蒸发进入空气。4、固态酒精、液态酒精、气态酒精都能燃烧,而水不能燃烧,这一实验现象说明了什么?答:同种分子性质相同,不同种分子性质不相同。同学们,请你们数一数,图中一共有多少个分子?一共有多少种分子?3、对下列实验现象的解释错误的是( )C复习 1、在电解水的实验中,水 分解为氧 和氢 ,每 个氧原子重新组合一个氧 ,每两个氢原子重新组合一个氢 。
由此可知:分子是由 构成的,分子在化学反应中可以再分成 ,而原子在化学变化中却 ,即原子是 。分子 原子 两分子 分子 原子 化学变化中的最小的粒子原子 不可再分原子 一、原子的构成原 子(带正电)(带正电)(带负电)(不带电)(不带电)每个质子带一个
单位正电荷每个电子带一个
单位负电荷观察表格(表3-1) ,你又能获得哪些信息?1、构成原子的粒子一般是质子、中子、电子2.在原子中,质子数=电子数3.质子数和中子数不一定相等,但很接近。4.不同种类的原子, 质子数不相同,核外电子数也不相同。=核电荷数不是所有的原子都有中子,氢原子的中子数为0。=原子序数将①分子②原子③质子④中子⑤电子等粒子用序号分别填入下列适当空格中:
(1)构成物质的基本粒子是________________
(2)构成原子的基本粒子是________________
(3)显示电中性的粒子是________________
(4)带正电的粒子是________________
(5)参加化学反应一定发生变化的粒子是___________
(6)原子中数目一定相等的粒子是_______________①②③④⑤①②④③①③⑤ 离子二、相对原子质量(Ar) 相对原子质量就是以一种 的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的 。 碳原子质量的1/12Ar=注意:“相对原子质量”是一个比值,没有“克、千克……等质量单位。其国际单位为一,一般不写出来。根据定义能不能写出相对原子质量的数学计算式?碳原子质量比(定义式) 已知1个碳原子的质量是1.993×10-26Kg,一个氧原子的质量是2.657×10-26Kg, 求出氧原子的相对原子质量?有没有其它求相对原子质量的比较简单的方法呢?相对原子质量(约)=质子数+中子数原子 原子核蚂蚁 5 mm200 m注意:原子核很小,但是原子质量集中在原子核内。核外电子是分层排布的:
电子层:1 2 3 4 5 6 7
K L M N O P Q
离核:近 远
能量:低 高能量低的在离核近的区域运动,能量高的在离核远的区域运动下图是1-18号元素的原子结构示意图,看图你能找出什么规律吗?核外电子的排布规律⑴ 先排满内层,后排满外层;
⑵ 第一层上最多排2个电子;
⑶ 第二层上最多排8个电子;
⑷ 最外层上最多排8个电子. 注意:‘288’规则只适用于前三层2、认识原子结构示意图圆圈表示原子核圈内数字表示核电荷数(即质子数)弧线表示电子层弧线上的数字表示该层的电子数最外层电子数=8(He为2)相对稳定结构
不易得失电子一般<4易失电子形成稳定结构一般≥4元素的化学性质与最外层电子数关系密切结构性质易得电子形成稳定结构根据下列结构示意图判断ABCDFE其中属于稀有气体的是________属于金属元素的是______,属于非金属元素的是_______D FB CA E
1、磷原子的结构示意图为:
(1)磷原子核内有 个质子。共有____个电子层,最外层上有____电子。
(2)铝原子核外电子层数与磷原子的电子层数相同,但最外层电子数比磷原子最外层电子数少2个,则铝原子结构示意图为 。
1535DNaCl的形成Na失去1个e-,
Cl得到1个e-1、离子:带电荷的原子或原子团离子阳离子:带正电荷的原子叫做阳离子。
如: H+ 、Na+、 Mg2+ 、Al3+阴离子:带负电荷的原子叫做阴离子。
如: O2- 、S2-、 F- 、Cl-写法:先写元素符号,再在元素符号右上角标所带电荷数及电性.例: 注意:只有1个电荷时,1省略不写S2-Cl-Mg2+2、离子所带电荷数由该元素原子得失电子决定。 表示镁离子右上角“2+”的意义:镁离子带2个单位的正电荷你能说出4Mg2+的意义吗?4个镁离子考考你例如:带3个正电荷的铁离子_____
4O2-表示 _______ ,7个钠离子_____Fe3+4个氧离子7Na+3、离子符号的意义[例1] 六种粒子结构示意图分别为:
(1)A、B、C、D、E、F共表示 种元素。
(2)表示原子的粒子是__________(填序号,下同)。
(3)表示阳离子的粒子是 。
(4)表示阴离子的是___________。ACF D E B四 [2]某粒子结构示意图为 (1)x表示 ,该粒子有___个电子层,y与粒子的__________关系非常密切。
(2)当x=10+Y,该粒子为_______(填类别)。
(3)y=8时,该粒子带有2个单位的负电荷,该粒子的符号为 。
(4)NaCl是由_____________构成。 核内的质子数 3 化学性质 原子 S2- Na+和Cl-(4)下列各对微粒中,质子数相同,电子数也相同的是( )
A.S和S2- B.F-和Mg2+
C.Ne和H2O D.Na和Na+ C (5)原子得到或失去电子后形成离子。某离子的结构示意图为
①当a= 时,该粒子是原子。
②当a=8时,该粒子是__________(填“原子”、“阳离子”或“阴离子”),其符号为 。原子离子10阴离子O2-一、元素元素是质子数(即核电荷数)相同的一类原子的总称。1.概念它们的质子数都是1,属于氢元素(1)元素是原子的集合体,是一个宏观的概念;例:“一个氧元素”这句话对吗?错水由________________构成;
一个水分子由________________________构成;
水由________________组成;水分子一个氧原子和两个氢原子氢元素和氧元素请思考原子可以构成分子,也可以直接构成物质,元素组成物质;水由________________构成;
一个水分子由________________________构成;
水由________________组成;水分子一个氧原子和两个氢原子氢元素和氧元素请思考(2)化学反应前后,分子种类发生了变化,元素种类没有发生变化。分析讨论:下述化学反应中:分子和元素的种类是否发生了改变反应前后,分子和元素,哪个发生了变化?2.元素的分布(1)元素在地壳中的含量分布(按质量计)注意:
a、地壳中含量前五的元素为氧(O)、硅(Si)、铝(Al)、铁(Fe)、钙(Ca);
b、地壳中含量前二的金属元素和非金属元素分别是氧和硅、铝和铁。记忆方法:氧硅铝,我铁了心。
(养闺女,我铁了心)2.元素的分布(2)元素在生物体中的含量分布(按质量计)排名前三的元素氧(O)、碳(C)、氢(H)。空气中含量最多的元素:氮(N)海水中含量前四位的元素:氧(O)、氢(H)、氯(Cl)、钠(Na)补充:元素金属元素:非金属元素:3.元素分类目前已发现112种元素(一直在更新)汉字特点:带“钅”旁,“金”和“汞”例外稀有气体元素:带“石”旁 固态非金属 带“气”旁 气态非金属带“氵”旁 液态非金属 氦、氖、氩、氪、氙国际规定:用元素拉丁文名称的第一个字母大写来表示该元素,第一个字母重复的,加上第二个字母的小写。如:氢(H),氦(He)。元素符号来历元素符号书写原则“一大,二小”⑴由一个字母表示的元素符号要大写。
⑵由两个字母表示的元素符号,第一个字母大写,第二个字母小写。O C H N S 氧 碳 氢 氮 硫Fe Cu Al Mg Hg铁 铜 铝 镁 汞1、Co和CO
2、Ca和Cu
3、Ag和Hg
元素符号表示什么?宏观意义:表示氧元素微观意义:表示一个氧原子作业:指出下列各符号中“2”所表示的含义:
2H 。
2H+_____________________。
2H2O_________________;
H2O中______________________________________。
2S2-系数“2”表示:____________________。
S2-____________________________________。
2H2______________________________________。
H2______________________________________。表示2个氢原子表示2个氢离子表示2个水分子表示2个硫离子表示1个硫离子带2个单位负电荷表示2个氢原子和1个氧原子构成一个水分子表示2个氢分子表示一个氢分子由两个氢原子组成1.周期:每一横行叫一周期,共7个周期。
2.族:每一纵行叫一族(其中8、9、10三个纵行共同组成一个族)
3.元素周期表的起始:稀有气体元素4.原子序数=核电荷数=核内质子数=核外电子数金属元素非金属元素关于周期表砷74.92原子序数相对原子质量元素符号元素名称元素周期表中元素所在表格信息As33【典例1】下列关于元素的叙述中,正确的是( )
A.同种原子的统称叫元素
B.同种元素的原子结构和质量完全相同
C.元素的种类取决于该元素的核外电子数
D.不同种类元素的根本区别是核内质子数不同D知识点一、元素2.长期饮用奶制品,体内就不会缺钙。这里的“钙”是
指( )CA.钙这种金属 B.钙原子
C.钙元素 D.钙分子【典例3】(2010·南京中考)中国志愿者王跃参加了人类首次模拟火星载人航天飞行试验。有探测资料表明,火星上存在丰富的镁资源。在元素周期表中,镁元素的某些信息如图所示,下列说法不正确的是( )
A.镁元素属于非金属元素
B.镁元素原子的核电荷数为12
C.镁元素原子的核外电子数为12
D.镁元素的相对原子质量为24.31知识点三、元素周期表A 12 Mg
镁
24.31谢谢欣赏
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
