2016-2017学年高一化学精品课件:第1章+章末复习方案与全优评估《从实验学化学》(人教版必修1)
文档属性
| 名称 | 2016-2017学年高一化学精品课件:第1章+章末复习方案与全优评估《从实验学化学》(人教版必修1) | 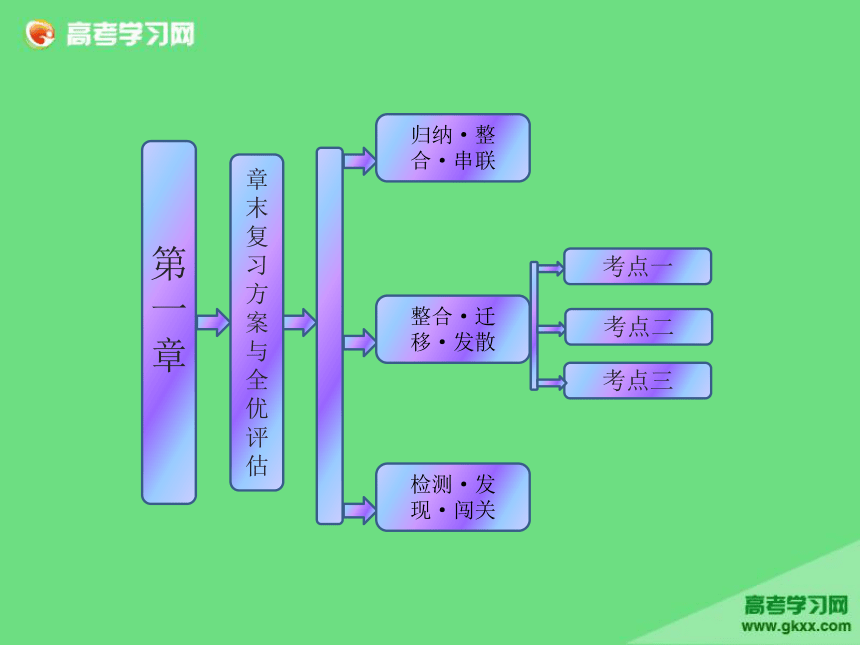 | |
| 格式 | zip | ||
| 文件大小 | 887.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-06-05 09:38:07 | ||
图片预览











文档简介
课件30张PPT。考点三第一章
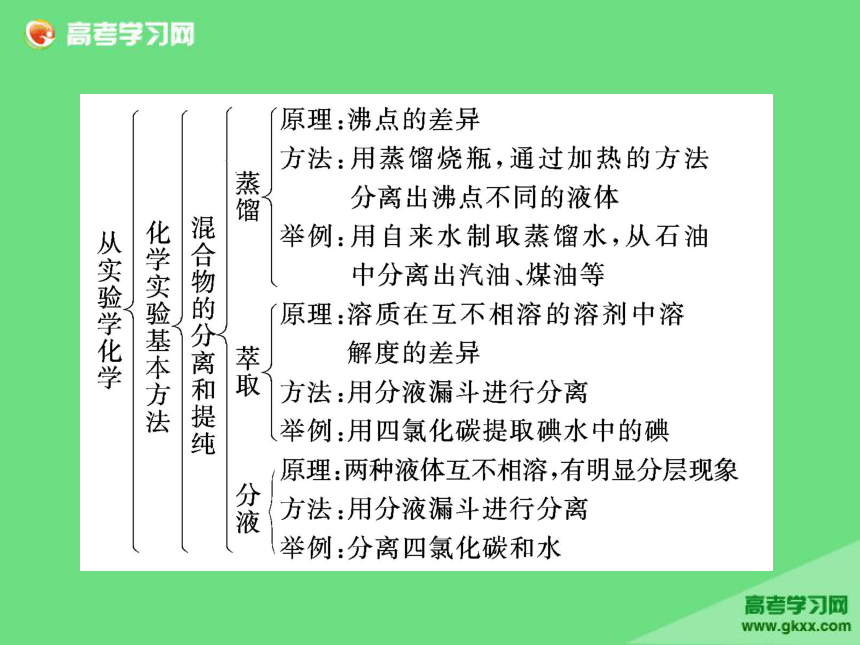
章末复习方案与全优评估归纳·整合·串联整合·迁移·发散考点一检测·发现·闯关考点二物质的分离和提纯 物质的分离与提纯,从高考的内容和形式上看,主要特点有三个:一是选取适当的试剂及其分离方法,除去被提纯物质中指定的杂质;二是确定除去被提纯物质中指定杂质所需加入试剂的先后顺序;三是将分离提纯与物质制备、混合物成分的确定等内容融为一体,形成综合实验题。解答该类题目要注意以下几个方面:(1)了解常见物质分离和提纯的方法;
(2)了解分离方法的适用范围和注意事项;
(3)能设计和评价简单的分离提纯实验方案。[考题印证]1.下列除去杂质的实验方法正确的是 ( )
A.除去CO中少量O2:通过灼热的铜网后再收集气体
B.除去CuO固体中少量Cu:置于坩埚中加热
C.除去NaCl中少量Na2CO3:加入适量的稀硝酸
D.除去生石灰中少量的石灰石:加入稍过量的稀盐酸
解析:A项,CO和O2会发生反应生成CO2;C项,引入杂质离子NO;D项,生石灰和稀盐酸发生反应。
答案:B2.某同学设计如下实验方案,以分离KCl和BaCl2两种固
体混合物: 试回答下列问题:
(1)B物质的化学式为________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步正确的方案应是________________
_______________________________________________。
(3)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____________________的质量。解析:(1)据已设计的分离路线知,加入过量K2CO3溶液使BaCl2中的Ba2+完全转化成BaCO3沉淀。将沉淀洗涤后与盐酸反应,经蒸发干燥得到固体B为BaCl2。
(2)加入过量K2CO3溶液后所得的滤液中有KCl和K2CO3,直接加热蒸发、结晶所得的固体C中有KCl和少量的K2CO3,因此步骤⑥之前应先在滤液中加入过量盐酸,使K2CO3转化为KCl后,再蒸发、结晶得到纯净的KCl。(3)固体B(BaCl2)中的所有钡离子全部来源于原混合物,因此只要测得固体B或沉淀A′的质量,据“钡量”守恒可确定BaCl2的质量分数。
答案:(1)BaCl2 (2)步骤⑥之前应先在滤液中加过量盐酸,然后再蒸发、结晶得固体C
(3)沉淀A′或固体B阿伏加德罗常数及其应用 对阿伏加德罗常数的考查是高考考查物质的量的“主题”,命题形式以选择题为主。该类题目涵盖的知识面较广,常与气体摩尔体积的使用条件、氧化还原反应中电子转移数目等问题联系在一起,可以说一直是高考的热点,也是考生易错的地方。但是,只要仔细审题,理解阿伏加德罗常数的含义,经常进行强化训练并注意挖掘题目的
“隐含条件”,就能轻松作答。[考题印证]3.[双选题]设NA代表阿伏加德罗常数,下列说法正确的
是 ( )
A.9.8 g H2SO4和9.8 g H3PO4含有相同的分子数和原
子数
B.2 g氢气所含原子数目为NA
C.3.01×1023个氮分子所含的原子数目在数值上与
NA近似相等
D.17 g氨气所含原子数目为4NA解析:H2SO4和H3PO4的摩尔质量相同,等质量的H2SO4和H3PO4的物质的量相等,但原子数不相等,故A错;B中H2为双原子分子,2 g氢气即1 mol H2,应含有2 mol H,原子个数为2NA,故B错;C中N2为双原子分子,3.01×1023个氮分子所含原子数应为2×3.01×1023,在数值上与NA近似相等,故C正确;D中17 g NH3的物质的量为1 mol,含4 mol原子,原子数目为4NA。
答案:CD4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下0.1NA个水分子所占的体积约是2.24 L
B.11.2 L CO2的物质的量为0.5 mol
C.NH3的摩尔质量等于NA个氨分子的相对分子质量之和
D.101 kPa、4℃时,18 mL 水和202 kPa、27℃时32 g
O2所含分子数均为NA解析:在标准状况下水不是气体,不能用气体摩尔体积来计算,A不正确。题中没有指明温度、压强,因此不能确定题给11.2 L CO2物质的量就是0.5 mol,B不正确。NH3的相对分子质量为17,其摩尔质量为17 g/mol,NA个NH3分子的质量之和为17 g,三者在数值上相同,C不正确。4℃时,18 mL水就是18 g水,其物质的量为1 mol,含有NA个水分子;32 g O2的物质的量是1 mol,不管在什么温度和压强下,1 mol O2都含有NA个O2分子。
答案:D以物质的量为中心的相关计算 物质的量是七大基本物理量之一,是贯穿整个中学化学的重要基本概念。在高考中,虽然对计算能力的要求有所降低,但对物质的量及其相关计算的考查每年必不可少,它以各种形式渗透到各种题型中,与多方面的知识融合在一起进行考查。顺利解答关于物质的量的化学计算,需明确物质的量与其他化学计量之间的联系,并注意构建网络化体系。[考题印证]5.有硫酸镁溶液500 mL,它的密度是1.20 g/cm3,其中镁
离子的质量分数是4.8%,则有关该溶液的说法不正确的是 ( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4 mol/L
C.溶质和溶剂的物质的量之比是1∶40
D.硫酸根离子的质量分数是19.2%答案:C6.根据下列各题所给出的数据,可分别求出其“溶质的质量
分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有n个OH-,则可求出此溶液中______为_______。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中_________________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中_______为________。
章末复习方案与全优评估归纳·整合·串联整合·迁移·发散考点一检测·发现·闯关考点二物质的分离和提纯 物质的分离与提纯,从高考的内容和形式上看,主要特点有三个:一是选取适当的试剂及其分离方法,除去被提纯物质中指定的杂质;二是确定除去被提纯物质中指定杂质所需加入试剂的先后顺序;三是将分离提纯与物质制备、混合物成分的确定等内容融为一体,形成综合实验题。解答该类题目要注意以下几个方面:(1)了解常见物质分离和提纯的方法;
(2)了解分离方法的适用范围和注意事项;
(3)能设计和评价简单的分离提纯实验方案。[考题印证]1.下列除去杂质的实验方法正确的是 ( )
A.除去CO中少量O2:通过灼热的铜网后再收集气体
B.除去CuO固体中少量Cu:置于坩埚中加热
C.除去NaCl中少量Na2CO3:加入适量的稀硝酸
D.除去生石灰中少量的石灰石:加入稍过量的稀盐酸
解析:A项,CO和O2会发生反应生成CO2;C项,引入杂质离子NO;D项,生石灰和稀盐酸发生反应。
答案:B2.某同学设计如下实验方案,以分离KCl和BaCl2两种固
体混合物: 试回答下列问题:
(1)B物质的化学式为________。
(2)该方案的明显失误是因某一步设计不当而使分离产物不纯,该步正确的方案应是________________
_______________________________________________。
(3)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____________________的质量。解析:(1)据已设计的分离路线知,加入过量K2CO3溶液使BaCl2中的Ba2+完全转化成BaCO3沉淀。将沉淀洗涤后与盐酸反应,经蒸发干燥得到固体B为BaCl2。
(2)加入过量K2CO3溶液后所得的滤液中有KCl和K2CO3,直接加热蒸发、结晶所得的固体C中有KCl和少量的K2CO3,因此步骤⑥之前应先在滤液中加入过量盐酸,使K2CO3转化为KCl后,再蒸发、结晶得到纯净的KCl。(3)固体B(BaCl2)中的所有钡离子全部来源于原混合物,因此只要测得固体B或沉淀A′的质量,据“钡量”守恒可确定BaCl2的质量分数。
答案:(1)BaCl2 (2)步骤⑥之前应先在滤液中加过量盐酸,然后再蒸发、结晶得固体C
(3)沉淀A′或固体B阿伏加德罗常数及其应用 对阿伏加德罗常数的考查是高考考查物质的量的“主题”,命题形式以选择题为主。该类题目涵盖的知识面较广,常与气体摩尔体积的使用条件、氧化还原反应中电子转移数目等问题联系在一起,可以说一直是高考的热点,也是考生易错的地方。但是,只要仔细审题,理解阿伏加德罗常数的含义,经常进行强化训练并注意挖掘题目的
“隐含条件”,就能轻松作答。[考题印证]3.[双选题]设NA代表阿伏加德罗常数,下列说法正确的
是 ( )
A.9.8 g H2SO4和9.8 g H3PO4含有相同的分子数和原
子数
B.2 g氢气所含原子数目为NA
C.3.01×1023个氮分子所含的原子数目在数值上与
NA近似相等
D.17 g氨气所含原子数目为4NA解析:H2SO4和H3PO4的摩尔质量相同,等质量的H2SO4和H3PO4的物质的量相等,但原子数不相等,故A错;B中H2为双原子分子,2 g氢气即1 mol H2,应含有2 mol H,原子个数为2NA,故B错;C中N2为双原子分子,3.01×1023个氮分子所含原子数应为2×3.01×1023,在数值上与NA近似相等,故C正确;D中17 g NH3的物质的量为1 mol,含4 mol原子,原子数目为4NA。
答案:CD4.NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下0.1NA个水分子所占的体积约是2.24 L
B.11.2 L CO2的物质的量为0.5 mol
C.NH3的摩尔质量等于NA个氨分子的相对分子质量之和
D.101 kPa、4℃时,18 mL 水和202 kPa、27℃时32 g
O2所含分子数均为NA解析:在标准状况下水不是气体,不能用气体摩尔体积来计算,A不正确。题中没有指明温度、压强,因此不能确定题给11.2 L CO2物质的量就是0.5 mol,B不正确。NH3的相对分子质量为17,其摩尔质量为17 g/mol,NA个NH3分子的质量之和为17 g,三者在数值上相同,C不正确。4℃时,18 mL水就是18 g水,其物质的量为1 mol,含有NA个水分子;32 g O2的物质的量是1 mol,不管在什么温度和压强下,1 mol O2都含有NA个O2分子。
答案:D以物质的量为中心的相关计算 物质的量是七大基本物理量之一,是贯穿整个中学化学的重要基本概念。在高考中,虽然对计算能力的要求有所降低,但对物质的量及其相关计算的考查每年必不可少,它以各种形式渗透到各种题型中,与多方面的知识融合在一起进行考查。顺利解答关于物质的量的化学计算,需明确物质的量与其他化学计量之间的联系,并注意构建网络化体系。[考题印证]5.有硫酸镁溶液500 mL,它的密度是1.20 g/cm3,其中镁
离子的质量分数是4.8%,则有关该溶液的说法不正确的是 ( )
A.溶质的质量分数是24.0%
B.溶液的物质的量浓度是2.4 mol/L
C.溶质和溶剂的物质的量之比是1∶40
D.硫酸根离子的质量分数是19.2%答案:C6.根据下列各题所给出的数据,可分别求出其“溶质的质量
分数”或“溶质的物质的量浓度”,试判断并求解。
(1)设NA表示阿伏加德罗常数的数值,若某氢氧化钠溶液V L中含有n个OH-,则可求出此溶液中______为_______。
(2)已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中_________________为________。
(3)已知标准状况下1体积水能溶解500体积的氯化氢,则可求出标准状况下氯化氢饱和溶液中_______为________。
