2017年高考真题——理综化学(全国III卷)word解析版
文档属性
| 名称 | 2017年高考真题——理综化学(全国III卷)word解析版 |  | |
| 格式 | zip | ||
| 文件大小 | 799.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-06-08 18:00:35 | ||
图片预览



文档简介
2017年高考新课标3卷理综化学
参考解析
7.化学与生活密切相关。下列说法错误的是
A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.天然气和液化石油气是我国目前推广使用的清洁燃料
【参考答案】C
【参考解析】CaCO3受热分解,燃煤中加入CaO不能减小温室气体CO2的排放,故选C。
8.下列说法正确的是
A.植物油氢化过程中发生了加成反应
B.淀粉和纤维素互为同分异构体
C.环己烷与苯可用酸性KMnO4溶液鉴别
D.水可以用来分离溴苯和苯的混合物
【参考答案】A
【参考解析】A.植物没氢化过程发生油脂与
( http: / / www.21cnjy.com )氢气的加成反应,故A正确;B.淀粉和纤维素的聚合度不同,造成它们的分子式不同,所以不是同分异构体,故B错误;C.环己烷与苯都不与酸性KMnO4溶液反应,所以不能用该方法鉴别环己烷与苯,故C错误;D.溴苯与苯互溶,不能用水分离溴苯和苯的混合物,故D错误;答案为A。
9.下列实验操作规范且能达到目的的是
目的
操作
A.
取20.00
mL盐酸
在50
mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010的KMnO4溶液
称取KMnO4固体0.158
g,放入100
mL容量瓶中,加水溶解并稀释至刻度
【参考答案】B
( http: / / www.21cnjy.com )10.为阿伏加德罗常数的值。下列说法正确的是
A.0.1
mol
的中,含有个中子
B.pH=1的H3PO4溶液中,含有个
C.2.24L(标准状况)苯在O2中完全燃烧,得到个CO2分子
D.密闭容器中1
mol
PCl3与1
mol
Cl2反应制备
PCl5(g),增加个P-Cl键
【参考答案】A
【参考解析】A、11B中含有6个中子,0.
( http: / / www.21cnjy.com )1mol
11B含有6NA个中子,A正确;B、溶液体积未定,不能计算氢离子个数,B错误;C、标准状况下苯是液体,不能利用气体摩尔体积计算22.4L苯完全燃烧产生的CO2分子数目,C错误;D、PCl3与Cl2反应生成PCl5的反应是可逆反应,所以1molPCl3与1molCl2反应制备PCl5,增加的P-Cl键的数目小于2NA个,D错误,答案选A。
11.全固态锂硫电池能量密度高、成本低,其
( http: / / www.21cnjy.com )工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
( http: / / www.21cnjy.com )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02
mol电子,负极材料减重0.14
g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的Li2S2量越多
【参考答案】A
【参考解析】A.原电池工作
( http: / / www.21cnjy.com )时,Li+向正极移动,则a为正极,正极上发生还原反应,电极反应为xS8+2e-+2Li+=Li2S8,故A错误;B.原电池工作时,转移0.02mol电子时,氧化Li的物质的量为0.02mol,质量为0.14g,故B正确;C.石墨能导电,利用石墨烯作电极,可提高电极a的导电性,故C正确;D.电池充电时间越长,转移电子数越多,生成的Li越多,则生成Li2S2的量越多,故D正确;答案为A。
12..短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数纸盒为21。下列关系正确的是
W
X
Y
Z
A.氢化物沸点:WB.氧化物对应水化物的酸性:Y>W
C.化合物熔点:Y2X3D.简单离子的半径:Y【参考答案】D
【参考解析】由图表可知,W为N元素、X
( http: / / www.21cnjy.com )为O元素、Y为Al元素、Z为Cl元素;A.NH3分子间有氢键,其沸点比HCl高,故A错误;B.Al(OH)3显两性,N元素的氧化物对应的水化物HNO3、HNO2均显酸性,故B错误;C.Al2O3是离子晶体,高熔点,而AlCl3是分子晶体,熔点低,故C错误;D.Al3+和O2-离子结构相同,核电荷数大,离子半径小,故D正确;答案为D。
13.在湿法炼锌的电解循环溶液中,较高浓度的会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去。根据溶液中平衡时相关离子浓度的关系图&,下列说法错误的是
( http: / / www.21cnjy.com )
A.的数量级为
B.除反应为Cu+Cu2++2=2CuCl
C.加入Cu越多,Cu+浓度越高,除效果越好
D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
【参考答案】C
( http: / / www.21cnjy.com )
26.(14分)
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加
( http: / / www.21cnjy.com )水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石
( http: / / www.21cnjy.com )英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1
g。将样品装入石英玻璃管中,再次将装置A称重,记为
m2
g。按下图连接好装置进行实验。
( http: / / www.21cnjy.com )
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3
g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x
( http: / / www.21cnjy.com )=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
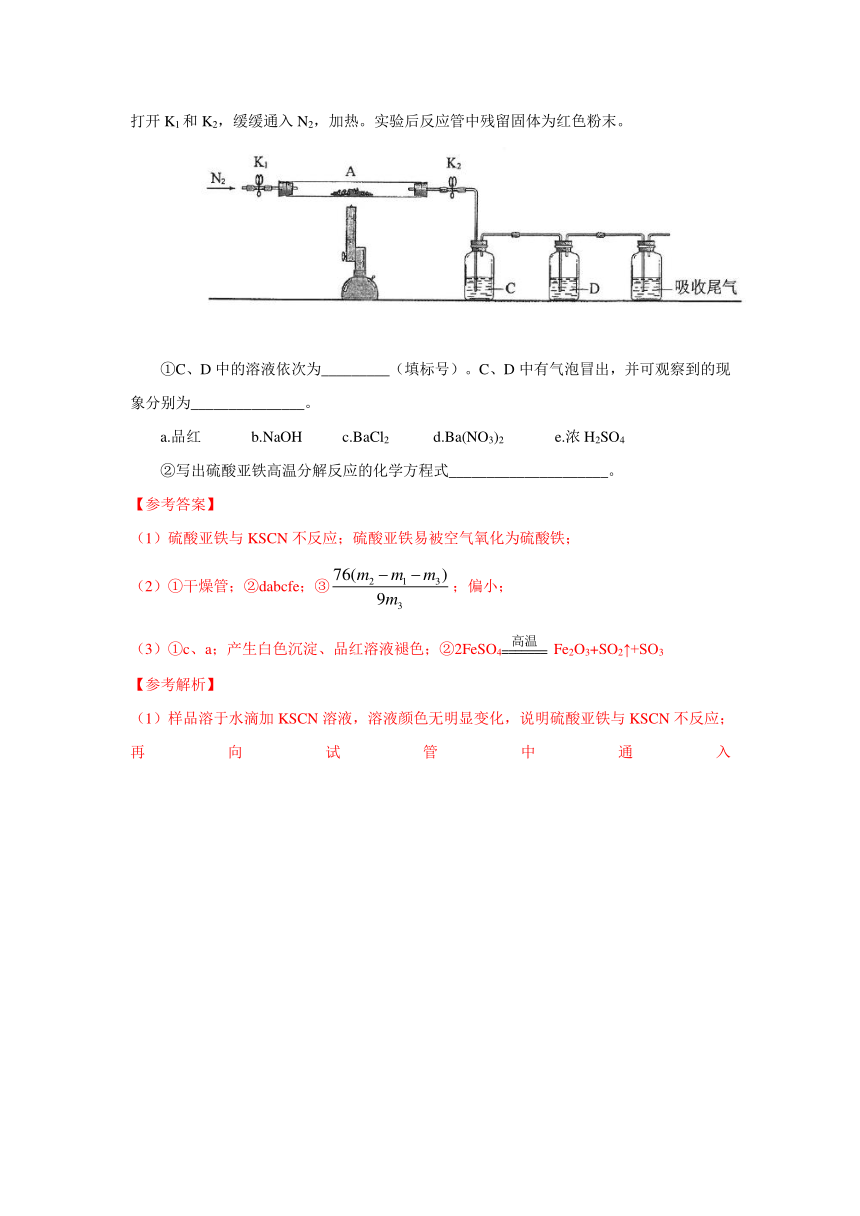
(3)为探究硫酸亚铁的分解
( http: / / www.21cnjy.com )产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
( http: / / www.21cnjy.com )
①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红
b.NaOH
c.BaCl2
d.Ba(NO3)2
e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
【参考答案】
(1)硫酸亚铁与KSCN不反应;硫酸亚铁易被空气氧化为硫酸铁;
(2)①干燥管;②dabcfe;③;偏小;
(3)①c、a;产生白色沉淀、品红溶液褪色;②2FeSO4Fe2O3+SO2↑+SO3
【参考解析】
(1)样品溶于水滴加KSCN溶液,溶液颜色无明显变化,说明硫酸亚铁与KSCN不反应;再向试管中通入
( http: / / www.21cnjy.com )
27.(15分)
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
( http: / / www.21cnjy.com )
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3
Na2CrO4+
Fe2O3+CO2+
NaNO2
上述反应配平后FeO·C
( http: / / www.21cnjy.com )r2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH使之变___
( http: / / www.21cnjy.com )_________________(填“大”或“小”),原因是_________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤
( http: / / www.21cnjy.com )液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________________(填标号)得到的K2Cr2O7固体产品最多。
( http: / / www.21cnjy.com )
a.80℃
b.60℃
c.40℃
d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1
kg
铬铁矿粉(含Cr2O3
40%)制备K2Cr2O7,最终得到产品
m2
kg,产率为_____________。
【答案】(1)2:7
高温下Na2CO3能与SiO2反应生成硅酸钠和CO2;
(2)铁
Al(OH)3
(3)小
增大溶液中H+,促进平衡2CrO42-+2H+Cr2O72-+H2O正向移动
(4)c
复分解反应
(5)m1×40%÷152g/mol×294g/mol÷m2×100%=%。
( http: / / www.21cnjy.com )(5)样品中Cr2O3的质量为m1×40%Kg,则生成K2Cr2O7的理论质量为m1×40%Kg×,则所得产品的产率为(m1×40%Kg×)÷m2Kg×100%=%。
28.(14分)
砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分
( http: / / www.21cnjy.com )为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+H2(g)+2O2(g)=H3AsO4(s)
ΔH1
H2(g)+O2(g)=H2O(l)
ΔH2
2As(s)+O2(g)
=As2O5(s)
ΔH3
则反应As2O5(s)
+3H2O(l)=
2H3AsO4(s)的ΔH
=_________。
(4)298
K时,将20
mL
3x
mol·L 1
Na3AsO3、20
mL
3x
mol·L 1
I2和20
mL
NaOH溶液混合,发生反应:AsO33 (aq)+I2(aq)+2OH
AsO43 (aq)+2I (aq)+
H2O(l)。溶液中c(AsO43 )与反应时间(t)的关系如图所示。
( http: / / www.21cnjy.com )
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I )=2v(AsO33 )
c.
c
(AsO43 )/c
(AsO33 )不再变化
d.
c(I )=y
mol·L 1
②tm时,v正_____
v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____
tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
【参考答案】
(1)。(2)2As2S3+5O2+6H2O=4H3AsO4+6S、
加压能加快化学反应速率,并能够促使平衡正向移动,能够有效提高As2S3的转化率。(3)2△H1-3△H2-△H3。(4)ACD、大于、
小于、
tm时AsO43-浓度更小,反应速率更慢、K=。
( http: / / www.21cnjy.com )
35.[化学——选修3:物质结构与性质](15分)
研究发现,在CO2低压合成甲醇反应(CO
( http: / / www.21cnjy.com )2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_
( http: / / www.21cnjy.com )____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的
( http: / / www.21cnjy.com )4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构
( http: / / www.21cnjy.com )(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a'
=0.448
nm,则r(Mn2+)为________nm。
( http: / / www.21cnjy.com )
【参考答案】
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2
O,Mn
(2)sp
,sp3
(3)H2O>CH3OH>CO2>H2
( http: / / www.21cnjy.com ),常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
(4)π键、离子键
(5)
【参考解析】
(1)Co是27号元素,位于元素周期表第4
( http: / / www.21cnjy.com )周期第VIII族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。元素Mn与O中,由于O元素是非金属性而Mn是过渡元素,所以第一电离能较大的是O。O基态原子价电子为2s22p4,所以其核外未成对电子数是2,而Mn基态原子价电子排布为3d54s2,所以其核外未成对电子数是5,因此核外未成对电子数较多的是Mn。
(2)CO2和CH3OH的中心原子C原子的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3。
(3)在CO2低压合成甲醇反
( http: / / www.21cnjy.com )应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2,原因是常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子形成
3个σ键,硝酸根中有一个氮氧双键,所以还存在π键。
(5)
因为O2-是面心立方最密堆积方式,面对角线是O2-半径的4倍,即4r=a,解得r=nm;MnO也属于NaCl型结构,根据晶胞的结构,Mn2+构成的是体心立方堆积,体对角线是Mn2+半径的4倍,面上相邻的两个Mn2+距离是此晶胞的一半,因此有。
36.[化学——选修5:有机化学基础](15分)
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
( http: / / www.21cnjy.com )
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺()是重要的精细化工中间体,写出由苯甲醚()制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
【参考答案】
(1),三氟甲苯;(2)浓硝酸、浓硫酸,并加热,反应类型是取代反应;(3)反应⑤的化学方程式为:
( http: / / www.21cnjy.com )
,吡啶的作用是防止氨基被氧化;(4)C11H11O3NF3;(5)9种;(6)
( http: / / www.21cnjy.com )
作用下-NO2转化成-NH2,最后在吡啶作用下与CH3COCl反应生成目标产物,合成路线是:
—CH3
参考解析
7.化学与生活密切相关。下列说法错误的是
A.PM2.5是指粒径不大于2.5μm的可吸入悬浮颗粒物
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.天然气和液化石油气是我国目前推广使用的清洁燃料
【参考答案】C
【参考解析】CaCO3受热分解,燃煤中加入CaO不能减小温室气体CO2的排放,故选C。
8.下列说法正确的是
A.植物油氢化过程中发生了加成反应
B.淀粉和纤维素互为同分异构体
C.环己烷与苯可用酸性KMnO4溶液鉴别
D.水可以用来分离溴苯和苯的混合物
【参考答案】A
【参考解析】A.植物没氢化过程发生油脂与
( http: / / www.21cnjy.com )氢气的加成反应,故A正确;B.淀粉和纤维素的聚合度不同,造成它们的分子式不同,所以不是同分异构体,故B错误;C.环己烷与苯都不与酸性KMnO4溶液反应,所以不能用该方法鉴别环己烷与苯,故C错误;D.溴苯与苯互溶,不能用水分离溴苯和苯的混合物,故D错误;答案为A。
9.下列实验操作规范且能达到目的的是
目的
操作
A.
取20.00
mL盐酸
在50
mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B.
清洗碘升华实验所用试管
先用酒精清洗,再用水清洗
C.
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
D.
配制浓度为0.010的KMnO4溶液
称取KMnO4固体0.158
g,放入100
mL容量瓶中,加水溶解并稀释至刻度
【参考答案】B
( http: / / www.21cnjy.com )10.为阿伏加德罗常数的值。下列说法正确的是
A.0.1
mol
的中,含有个中子
B.pH=1的H3PO4溶液中,含有个
C.2.24L(标准状况)苯在O2中完全燃烧,得到个CO2分子
D.密闭容器中1
mol
PCl3与1
mol
Cl2反应制备
PCl5(g),增加个P-Cl键
【参考答案】A
【参考解析】A、11B中含有6个中子,0.
( http: / / www.21cnjy.com )1mol
11B含有6NA个中子,A正确;B、溶液体积未定,不能计算氢离子个数,B错误;C、标准状况下苯是液体,不能利用气体摩尔体积计算22.4L苯完全燃烧产生的CO2分子数目,C错误;D、PCl3与Cl2反应生成PCl5的反应是可逆反应,所以1molPCl3与1molCl2反应制备PCl5,增加的P-Cl键的数目小于2NA个,D错误,答案选A。
11.全固态锂硫电池能量密度高、成本低,其
( http: / / www.21cnjy.com )工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
( http: / / www.21cnjy.com )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B.电池工作时,外电路中流过0.02
mol电子,负极材料减重0.14
g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的Li2S2量越多
【参考答案】A
【参考解析】A.原电池工作
( http: / / www.21cnjy.com )时,Li+向正极移动,则a为正极,正极上发生还原反应,电极反应为xS8+2e-+2Li+=Li2S8,故A错误;B.原电池工作时,转移0.02mol电子时,氧化Li的物质的量为0.02mol,质量为0.14g,故B正确;C.石墨能导电,利用石墨烯作电极,可提高电极a的导电性,故C正确;D.电池充电时间越长,转移电子数越多,生成的Li越多,则生成Li2S2的量越多,故D正确;答案为A。
12..短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外电子数纸盒为21。下列关系正确的是
W
X
Y
Z
A.氢化物沸点:W
C.化合物熔点:Y2X3
【参考解析】由图表可知,W为N元素、X
( http: / / www.21cnjy.com )为O元素、Y为Al元素、Z为Cl元素;A.NH3分子间有氢键,其沸点比HCl高,故A错误;B.Al(OH)3显两性,N元素的氧化物对应的水化物HNO3、HNO2均显酸性,故B错误;C.Al2O3是离子晶体,高熔点,而AlCl3是分子晶体,熔点低,故C错误;D.Al3+和O2-离子结构相同,核电荷数大,离子半径小,故D正确;答案为D。
13.在湿法炼锌的电解循环溶液中,较高浓度的会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去。根据溶液中平衡时相关离子浓度的关系图&,下列说法错误的是
( http: / / www.21cnjy.com )
A.的数量级为
B.除反应为Cu+Cu2++2=2CuCl
C.加入Cu越多,Cu+浓度越高,除效果越好
D.2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
【参考答案】C
( http: / / www.21cnjy.com )
26.(14分)
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加
( http: / / www.21cnjy.com )水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石
( http: / / www.21cnjy.com )英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1
g。将样品装入石英玻璃管中,再次将装置A称重,记为
m2
g。按下图连接好装置进行实验。
( http: / / www.21cnjy.com )
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3
g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x
( http: / / www.21cnjy.com )=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解
( http: / / www.21cnjy.com )产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
( http: / / www.21cnjy.com )
①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红
b.NaOH
c.BaCl2
d.Ba(NO3)2
e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
【参考答案】
(1)硫酸亚铁与KSCN不反应;硫酸亚铁易被空气氧化为硫酸铁;
(2)①干燥管;②dabcfe;③;偏小;
(3)①c、a;产生白色沉淀、品红溶液褪色;②2FeSO4Fe2O3+SO2↑+SO3
【参考解析】
(1)样品溶于水滴加KSCN溶液,溶液颜色无明显变化,说明硫酸亚铁与KSCN不反应;再向试管中通入
( http: / / www.21cnjy.com )
27.(15分)
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
( http: / / www.21cnjy.com )
回答下列问题:
(1)步骤①的主要反应为:
FeO·Cr2O3+Na2CO3+NaNO3
Na2CrO4+
Fe2O3+CO2+
NaNO2
上述反应配平后FeO·C
( http: / / www.21cnjy.com )r2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_______________及含硅杂质。
(3)步骤④调滤液2的pH使之变___
( http: / / www.21cnjy.com )_________________(填“大”或“小”),原因是_________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤
( http: / / www.21cnjy.com )液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________________(填标号)得到的K2Cr2O7固体产品最多。
( http: / / www.21cnjy.com )
a.80℃
b.60℃
c.40℃
d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1
kg
铬铁矿粉(含Cr2O3
40%)制备K2Cr2O7,最终得到产品
m2
kg,产率为_____________。
【答案】(1)2:7
高温下Na2CO3能与SiO2反应生成硅酸钠和CO2;
(2)铁
Al(OH)3
(3)小
增大溶液中H+,促进平衡2CrO42-+2H+Cr2O72-+H2O正向移动
(4)c
复分解反应
(5)m1×40%÷152g/mol×294g/mol÷m2×100%=%。
( http: / / www.21cnjy.com )(5)样品中Cr2O3的质量为m1×40%Kg,则生成K2Cr2O7的理论质量为m1×40%Kg×,则所得产品的产率为(m1×40%Kg×)÷m2Kg×100%=%。
28.(14分)
砷(As)是第四周期ⅤA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________。
(2)工业上常将含砷废渣(主要成分
( http: / / www.21cnjy.com )为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________。该反应需要在加压下进行,原因是________。
(3)已知:As(s)+H2(g)+2O2(g)=H3AsO4(s)
ΔH1
H2(g)+O2(g)=H2O(l)
ΔH2
2As(s)+O2(g)
=As2O5(s)
ΔH3
则反应As2O5(s)
+3H2O(l)=
2H3AsO4(s)的ΔH
=_________。
(4)298
K时,将20
mL
3x
mol·L 1
Na3AsO3、20
mL
3x
mol·L 1
I2和20
mL
NaOH溶液混合,发生反应:AsO33 (aq)+I2(aq)+2OH
AsO43 (aq)+2I (aq)+
H2O(l)。溶液中c(AsO43 )与反应时间(t)的关系如图所示。
( http: / / www.21cnjy.com )
①下列可判断反应达到平衡的是__________(填标号)。
a.溶液的pH不再变化
b.v(I )=2v(AsO33 )
c.
c
(AsO43 )/c
(AsO33 )不再变化
d.
c(I )=y
mol·L 1
②tm时,v正_____
v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____
tn时v逆(填“大于”“小于”或“等于”),理由是_____________。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________。
【参考答案】
(1)。(2)2As2S3+5O2+6H2O=4H3AsO4+6S、
加压能加快化学反应速率,并能够促使平衡正向移动,能够有效提高As2S3的转化率。(3)2△H1-3△H2-△H3。(4)ACD、大于、
小于、
tm时AsO43-浓度更小,反应速率更慢、K=。
( http: / / www.21cnjy.com )
35.[化学——选修3:物质结构与性质](15分)
研究发现,在CO2低压合成甲醇反应(CO
( http: / / www.21cnjy.com )2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_
( http: / / www.21cnjy.com )____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的
( http: / / www.21cnjy.com )4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构
( http: / / www.21cnjy.com )(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a'
=0.448
nm,则r(Mn2+)为________nm。
( http: / / www.21cnjy.com )
【参考答案】
(1)1s22s22p63s23p63d74s2或[Ar]3d74s2
O,Mn
(2)sp
,sp3
(3)H2O>CH3OH>CO2>H2
( http: / / www.21cnjy.com ),常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
(4)π键、离子键
(5)
【参考解析】
(1)Co是27号元素,位于元素周期表第4
( http: / / www.21cnjy.com )周期第VIII族,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2。元素Mn与O中,由于O元素是非金属性而Mn是过渡元素,所以第一电离能较大的是O。O基态原子价电子为2s22p4,所以其核外未成对电子数是2,而Mn基态原子价电子排布为3d54s2,所以其核外未成对电子数是5,因此核外未成对电子数较多的是Mn。
(2)CO2和CH3OH的中心原子C原子的价层电子对数分别为2和4,所以CO2和CH3OH分子中C原子的杂化形式分别为sp和sp3。
(3)在CO2低压合成甲醇反
( http: / / www.21cnjy.com )应所涉及的4种物质中,沸点从高到低的顺序为H2O>CH3OH>CO2>H2,原因是常温下水和甲醇是液体而二氧化碳和氢气是气体,液体的沸点高于气体;水分子中有两个氢原子都可以参与形成分子间氢键,而甲醇分子中只有一个羟基上的氢原子可用于形成分子间氢键,所以水的沸点高于甲醇;二氧化碳的相对分子质量比氢气大,所以二氧化碳分子间作用力较大、沸点较高。
(4)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中N原子与3个氧原子形成
3个σ键,硝酸根中有一个氮氧双键,所以还存在π键。
(5)
因为O2-是面心立方最密堆积方式,面对角线是O2-半径的4倍,即4r=a,解得r=nm;MnO也属于NaCl型结构,根据晶胞的结构,Mn2+构成的是体心立方堆积,体对角线是Mn2+半径的4倍,面上相邻的两个Mn2+距离是此晶胞的一半,因此有。
36.[化学——选修5:有机化学基础](15分)
氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
( http: / / www.21cnjy.com )
回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺()是重要的精细化工中间体,写出由苯甲醚()制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
【参考答案】
(1),三氟甲苯;(2)浓硝酸、浓硫酸,并加热,反应类型是取代反应;(3)反应⑤的化学方程式为:
( http: / / www.21cnjy.com )
,吡啶的作用是防止氨基被氧化;(4)C11H11O3NF3;(5)9种;(6)
( http: / / www.21cnjy.com )
作用下-NO2转化成-NH2,最后在吡啶作用下与CH3COCl反应生成目标产物,合成路线是:
—CH3
同课章节目录
