8.2金属的化学性质 课件 (共66张PPT)
文档属性
| 名称 | 8.2金属的化学性质 课件 (共66张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-06-15 09:08:16 | ||
图片预览











文档简介
课件66张PPT。第八单元 金属和金属材料课题2:金属的化学性质 英国业余探宝者发现撒克逊宝藏 从地里出土的金属文物中,金器总是保存得基本完好,铜器表面有锈迹,而铁器出土很少且锈迹斑斑。这是为什么呢? 一.金属与氧气的反应 1、是不是所有金属都能与氧气发生反应?
2、金属与氧气反应的难易和剧烈程度是否 相同?阅读课本P9金属与氧气的反应①镁、铝在常温下就与氧气反应
②铁.铜可与氧气反应
③金在高温时也不与氧气反应 大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。一、金属与氧气的反应4Al+3O2═2Al2O3 ;2Mg+O2═2MgO 4Fe+3O2═2Fe3O4 ; 2Cu+O2═2CuO 点燃△ “真金不怕火炼”的涵义:金很不活泼即使在高温下也不与氧气反应。
分析与讨论为什么不同的金属与氧气反应时的难易程度和剧烈程度会不同呢?不同的金属活泼程度(即金属活动性)不一样。越活泼的金属越容易与别的物质起反应,且反应现象越剧烈。活动性:镁、铝 > 铁、铜 > 金判断金属活动性的方法一:
金属与氧气反应的难易和剧烈程度 镁和铝在常温下可与氧气反应,
为什么铝会具有很好的抗腐蚀性呢? 思考:(1)为什么铝制品不容易生锈?
铝常温与氧气反应,生成一层致密的氧化铝薄膜,阻止铝进一步氧化。(2)生活中铝制品能否用钢刷、沙擦洗?不能。钢刷、沙等破坏表面致密的保护膜温馨提示:铝会损害神经系统,有可能导致老年痴呆症,对其他器官也有损害。所以国家对于食品添加剂中的铝含量制定了相关标准 二、金属与酸的反应实验探究:
1.在4只试管里分别放入一小块镁、锌、铁、铜,再分别加入约5mL稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断反应后生成了什么气体?
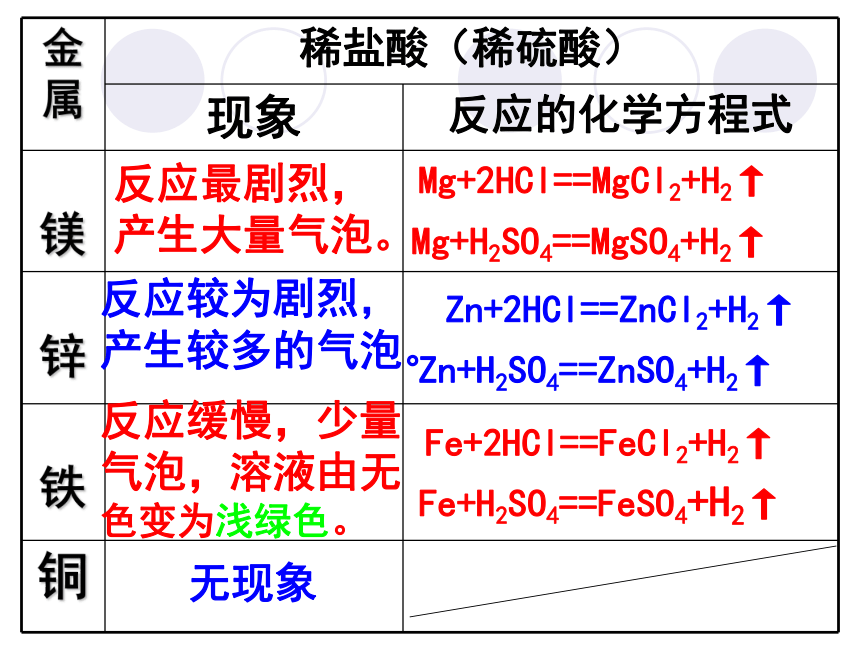
2. 用稀硫酸代替稀盐酸进行实验,并比较发生的现象。 友情提示:实验操作要规范,取用稀盐酸 和稀硫酸一定要小心奥! 无现象反应最剧烈,
产生大量气泡。反应较为剧烈,产生较多的气泡。反应缓慢,少量气泡,溶液由无
色变为浅绿色。Mg+2HCl==MgCl2+H2↑Mg+H2SO4==MgSO4+H2↑Zn+2HCl==ZnCl2+H2↑Zn+H2SO4==ZnSO4+H2↑Fe+H2SO4==FeSO4+H2↑Fe+2HCl==FeCl2+H2↑1、哪些金属与盐酸反应?
哪些不与盐酸反应?2、根据是否与酸反应,可把这四种金属分成几类?3、与酸反应的剧烈程度如何?谁最活泼?我最活泼!
我的金属活动性最强God Save Me!为什么受伤总是我!无所谓,我无所谓
我得意的笑
又得意的笑金属活动性顺序:Mg﹥Zn ﹥Fe ﹥Cu2、判断金属活动性的方法二:
根据金属是否与酸反应及反应的剧烈程度判断金属的活动性强弱; 分析镁、锌、铁和盐酸、稀硫酸的反应,从反应物和生成物的物质类别(如单质、化合物)的角度分析,这些反应有什么特点?和我们学过的化合反应、分解反应一样吗?Mg + 2 HCl = MgCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
单质化合物化合物单质置换反应 由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。1、概念:2、表达式:A+BC→B+AC 化合反应:
分解反应:
置换反应:3、特点:一换一4.基本
反应
类型A+B→AB 多变一AB → A+B 一变多A+BC→B+AC一换一小试牛刀试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应(1)2Al+6HCl=2AlCl3+3H2↑ ( )(2)H2CO3=CO2↑+H2O ( )(3)Fe+CuSO4=FeSO4+Cu ( )(4)CaO+H2O=Ca(OH)2 ( )CBCA
不是是Al + H2SO4 = Al2 (SO4)3 + H2↑Al + HCl = AlCl3 + H2↑判断下面化学反应属于置换反应吗? 是是2623233是1、铝是一种应用广泛的金属,下列有关铝的描述中,正确的是( )。
A.铝是地壳中含量最高的元素
B.镁铝合金可用于制造飞机
C.铝的化学性质不如铁活泼
D.铝制容器的表面有一层氧化物保护膜,可以用来盛装盐酸
2、“真金不怕火炼”的化学含义是( )
A.金的熔点低 B.金的导电性强
C.金是贵重金属 D.金的化学性质稳定
BD3、下列化合物中,不能通过金属与酸反应而得到的是( )
A.MgSO4 B.CuCl2
C.FeSO4 D.FeCl2
B4、以铁、水、稀盐酸、氧气、稀硫酸为原料,根据下列化学反应类型,写出相应的化学方程式。 (1)化合反应__________________ (2)分解反应___________________ (3)置换反应__________________ 3Fe + 2O2 == Fe3O42H2O == 2H2↑+ O2↑点燃通电Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑5、金属与酸反应的剧烈程度,可以反映金属的活动性如图是甲、乙、丙、丁四种金属与盐酸反应的漫画,周围的小黑点表示反应生成的气体,则这四种金属的活动性由强到弱的顺序为________。若甲为镁,生成的气体是氢气(H2),则反应的化学方程式为____________,反应类型是________(填“置换反应”“分解反应”或“化合反应”),该反应由一种________和一种________反应,生成另一种________和另一种________。甲 乙 丙丁Mg + 2HCl = MgCl2 + H2↑置换反应单质化合物单质化合物三、金属与金属化合物溶液反应(即金属与盐溶液的反应)实验探究
1.把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会观察有什么现象?
2.把一根洁净的铜丝浸入硝酸银溶液中,过一会观察有什么现象发生?
3.把一根用砂纸打磨过的铁丝浸入硫酸铜溶液中,过一会观察有什么现象?
4.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会观察有什么现象发生?铝丝表面覆盖一层紫红色物质,溶液由蓝色逐渐变为无色。2Al + 3CuSO4= Al2(SO4)3 + 3CuCu +2Ag NO3 =Cu(NO3)2 + 2Ag铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色。铁丝表面覆盖一层紫红色物质,溶液由蓝色逐渐变为浅绿色。Fe + CuSO4= FeSO4 + Cu无现象Al Cu Ag金属活动性由强减弱?2、通过上述探究,你能得出铝、铜、银的金属活动性顺序吗?1、上述能发生反应的化学方程式的特点是什么?它们属于那种反应类型?一种单质与一种化合物反应生成另一种单质和另一种化合物。置换反应3、你能从上述实验找出判断金属活动性的方法吗?判断金属活动性的方法三:
金属能否把另一种金属从其盐溶液中置换出来
1.大多数金属能与氧气反应2.大多数金属能与盐酸或稀硫酸反应3.部分金属能与金属化合物的溶液反应金属活动性反应越容易,越剧烈,金属越活泼参加反应的金属比置换出的金属活泼小结:金属的化学性质四、金属在溶液中的活动性顺序: k Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾 钙 钠 镁 铝, 锌 铁 锡 铅 (氢), 铜 汞 银 铂 金.?
金属活动性由强逐渐减弱这是重点!应用依据:
1、在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2、在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3、在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。①酸:是指稀硫酸、盐酸,不是浓硫酸和硝酸(金属与浓硫酸和硝酸等反应时,不产生氢气)(2)判断金属跟酸反应时的要点(3)判断金属跟金属化合物溶液反应时要点①前换后,盐是可溶,②金属不用K、Ca、Na等。(这些金属常温
下和水发生应,而不能置换金属化合物溶液
的金属。)(1)适用范围
金属活动性顺序仅适用于在水溶液中的反应。③铁参加置换反应,生成亚铁盐?1.判断下列物质能否发生反应?若能,写出相关化学方程式。
1)银与稀盐酸 2)锌与硫酸铜溶液 3)铜与硫酸锌溶液 4)铝与硝酸银溶液
5)银与氯化铜溶液 6)镁与硫酸亚铁溶液解答:可发生反应的:(2)(4)(6)(2)Zn + CuSO4 = Cu + ZnSO4(4)Al +3AgNO3 = Al(NO3)3 + 3Ag(6)Mg + FeSO4 = MgSO4 +Fe四、金属活动性顺序的应用: 应用1判断溶液中的置换反应能否发生及反应现象2、不能由金属跟盐酸直接反应制得的物质是( ? )
?A.MgCl2??? B.FeCl3???C.CuCl2?? D.ZnCl2
?3、在盛有硫酸亚铁溶液的试管里,浸入一根洁净的铜丝,过一段时间后,取出铜丝观察,铜丝表面 。在盛有硫酸铜溶液的试管里,浸入一块铁丝,过一会儿取出,观察到的现象为 。在
盛有硝酸银溶液的试管里,浸入一跟洁净的铜丝,观察到的现象为 ,
化学方程式为 。 无现象BC 铁丝表面有红色物质析出,溶液由蓝色变为浅绿色铜丝表面有银白色物质析出,溶液由无色变为蓝色Cu +2AgNO3 =Cu(NO3)2 + 2Ag 4、下列置换反应的化学方程式正确的是 ( )
A.2Fe+3CuCl2 = 2FeCl3 +3Cu
B. 2Na+CuSO4 = Cu+Na2SO4
C. Zn +2AgNO3 =2Ag + Zn(NO3)2
D. Cu+ 2AgCl= CuCl2 + 2AgCK Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属与盐发生置换反应,盐必须是可溶的3.Fe + CuSO4= FeSO4 + CuFe + 2HCl = FeCl2 + H2 ↑ 化合反应 化合反应 置换反应 置换反应 1、铝制品表面有一层致密的氧化铝薄膜,阻碍铝进一步被氧化。若用钢刷、沙等来擦洗铝制品,容易把氧化铝薄膜除掉,从而起不到保护作用。2、铁和硫酸铜反应生成硫酸亚铁和铜,会造成波尔多液变质,容器被腐蚀3Fe+2O2===Fe3O4点燃化合反应4.Mg + 2HCl ==MgCl2 + H2↑置换反应 化合反应 化合反应 Zn + CuSO4= ZnSO4 + Cu5.Al +3Ag NO3 =Al(NO3)3 + 3Ag置换反应 置换反应 .欲除去铜粉中的铁粉有多种方法,请举例几种:加入足量的稀盐酸中,当反应至没有
气泡时,过滤。加入足量的硫酸铜溶液中,至铁完全反应。用磁铁吸引铁粉达到分离的目的。6、填写下列表格(括号内为杂质)Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+Cu 溶解、过滤、洗涤溶解、过滤练习:下列除去杂质的方法中,错误的是D 7.有X Y Z三种金属,如果把X和Y分别放入稀硫酸中, X 溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化.根据以上事实,判断X Y Z的金属活动顺序. X>Y>Z2、X、Y、Z三种金属及化合物间发生如下化学反应Y+ZCl2===Z+YCl2?? X+ZCl2===Z+XCl2
Y+2HCl===YCl2+H2↑? X与稀盐酸不反应。
则X、Y、Z三种金属的活动性由强到弱的顺序(? )
A.Z>Y>X??B.X>Y>Z C.Y>X>Z??D.Y>Z>XC应用2:比较金属活动性强弱 3、若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A. Mn+2HCl ==MnC12+H2↑
B. Mg +MnSO4== MgSO4+Mn
C. Mn+Cu(NO3)2===Mn(NO3)2+Cu
D. Fe+MnSO4 ==FeSO4+Mn D4、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mn、Mg、Cu B.Mg、Mn、Cu
C.Cu、Mg、Mn D.Cu、Mn、MgB8.镁,锌,铁三种金属各30g,分别投入足量的稀盐酸中,生成氢气的质量各是多少?等质量金属与足量的酸反应,产生氢气的质量由大到小的顺序为 :铝﹥镁﹥铁﹥锌例:镁,锌,铁三种金属分别投入足量的稀硫酸中,求产生30gH2分别消耗的金属镁,锌,铁各多少克?产生相同的氢气时,消耗的金属的质量由大到小的顺序为:锌 ﹥铁﹥镁﹥铝验证三种金属活动性顺序的方法1、前后金属单质,中间盐溶液2、中间金属单质,前后盐溶液4、前两种金属单质,后两种金属的可溶性盐3、前两种金属单质,一种酸,后金属的可溶性盐如:证明Zn>Cu>AgZn、Ag、CuSO4溶液Cu、ZnSO4溶液、AgNO3溶液Zn 、 Cu、Cu SO4溶液、 AgNO3溶液Cu、 Zn、 HCl 、 AgNO3溶液试剂Zn AgZn AgZn (H)Cu Ag(H) Cu Zn CuZn (H)Zn CuZn (H)(H) Cu
(H) Ag 多余B1、某研究性学习小组的成员为了验证锌、铜、银三种金属的活动性顺序,设计了如下方案,其中可行的是( )
A、Cu、 Zn(NO3)2溶液、 Ag
B、稀硫酸、 Zn、Cu、AgNO3溶液
C、稀盐酸、 Zn 、Cu(NO3)2溶液
D、Zn、稀硫酸、 Cu、Ag应用四 判断金属跟混合盐溶液反应的反应。 反应的先后次序是:在金属活动性顺序表里,排在越后面的金属,越易从它们的盐溶液里被置换出来。或者说:金属活动性相差越大,置换反应越易发生。[例1]将一定质量的铁粉放入足量相同质量分数的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是( )A FeB. CuC.AgC1、向含AgNO3、 Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入过量的锌粉,充分反应后过滤,则滤出的固体中一定有 ( ) A. Ag、Cu和Mg B. Cu、Mg和Zn
C. Ag、Cu和Zn D. Ag 、Mg和Zn C练习2、将一定质量的锌粉放入Cu(NO3)2 和 AgNO3的混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是 , 变式训练:1.如果在滤渣中加入稀盐酸,发现有气体生成,则滤液中一定不存在的物质是 ,硝酸银、硝酸铜
2.如果在滤液中有硝酸银存在,则在滤渣中一定不存在的物质是 .铜 和 锌
银3、在FeCl2 和CuCl2的混合溶液中加入镁粉,下面说法中错误的是 ( )
A、当镁粉无剩余时,溶液中若有Cu2+,则必定有Fe2+
B、当镁粉无剩余时,溶液中一定有Mg2+,可能有Cu2+和 Fe2+
C、当镁粉有剩余时,溶液中只有Fe2+,而无Mg2+和Cu2+
D、当镁粉有剩余时,溶液中只有Mg2+,而无Cu2+和Fe2+C判断金属与酸发生置换反应的速率大小及产生氢气的质量 应用5: 将等质量的铝、镁、铁、锌、铜分别投入到溶质质量分数相同且足量的盐酸中,请思考下列问题: (1)反应速率(2)生成氢气的质量Al>Mg > Fe >Zn Cu不反应 知识的回顾Mg >Al>Zn >Fe Cu不反应1、今有等质量铝、镁、铁、锌四种金属与足量的溶质质量分数相同稀盐酸反应(如图所示),用A、B、C、D代表这四种金属,则A、B、C、D分别是:铝:
镁:
铁:锌:典型例题K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au镁锌铝铁等质量的铝、镁、铁、锌分别与质量相同,质量分数也相同的稀硫酸充分反应放出氢气的情况如图所示,请完成下列问题:⑴则A、B、C、D
分别表示________
⑵反应不再发生时,
一定用完的物质是____Mg、Al、Zn、Fe稀硫酸Mg Al Zn Fe习题精选t1 1、 相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
abcMgFeZn2.将质量相同A、B、C的三种金属,同时放入三份溶质质量分数相同且足量的稀盐酸中,反应生成氢气的质量与反应的时间关系如图所示。根据图中所提示的信息,得出的结论正确的是 ( )
(已知A、B、C三种金属都是+2价)A、放出H2的质量是A>B>C
B、金属活动性顺序是A>B>C
C、反应速率最大的是A
D、相对原子质量是C>A> BA3、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。
下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C 4.(2012.青岛市)现有镁、铝两种金属分别跟稀盐酸充分反应,生成相同质量的氢气。则可能的情况有 ( )
A.足量的稀盐酸与等质量的镁、铝发生反应
B.足量的稀盐酸与质量比为4:3的镁、铝发生反应
C.足量的稀盐酸与质量比为8:9的镁、铝发生反应
D.等质量、等溶质质量分数的稀盐酸与过量的镁、铝发生反应BD练习5:相同质量的Na,Mg,Al与过量的盐酸
反应,在相同的条件下,放出氢气的质量比是:(A)1:2:3 (B)9:12:23
(C)23:12:9 (D)36:69:92答案:()D练习6:将6克某些金属的混合物与足量的盐酸反应,得0.2克氢气,则该混合物的可能组成是: (A) Mg , Al (B) Cu , Zn
(C) Zn , Fe (D) Na , Mg 答案:()C 11.将铁片分别放入下列溶液中充分反应,反应后能使铁片质量增重的物质是:A. H2SO4 B. FeSO4 C. HCl D. CuSO4Fe + 2HCl = FeCl2 + H2↑Fe + H2SO4 = FeSO4 + H2 ↑Fe + CuSO4= FeSO4 + Cu5664 1.将铁片分别放入下列溶液中充分反应,反应后溶液质量比反应前增重的是:A. H2SO4 B. FeSO4 C. HCl D. CuSO4Fe + 2HCl = FeCl2 + H2↑Fe + H2SO4 = FeSO4 + H2 ↑Fe + CuSO4= FeSO4 + Cu5664562 562 3、下列反应属于置换反应的是( )
①H2+CuO==Cu+H2O
②2CO+O2==2CO2
③Zn+2HCl==ZnCl2+H2↑
④Fe2O3+3CO==2Fe+3CO2
A、①④ B、②③ C、①③ D、②④ ΔΔC 10.商代的司母戊方鼎标志着我国在3000多年前青器铸造已达到一个较高的水平。西汉时期,我国首开“湿法炼铜”之先河,西汉刘安所著的《淮南万毕术》中已有“曾青得铁化为铜”的记载。试回答下列问题;
(1)青铜属于 (填“单质”、“化合物”、
、“合金”中之一)
(2)“湿法炼铜”的原理可用一个化学方程式表示为:
(3)上述化学反应属于 反应。合金Fe + CuSO4= FeSO4 + Cu置换反应 5.黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全反应,产生氢气0.1g。试求:
(1)该黄铜样品中锌的质量。
(2)该黄铜样品中铜的质量分数。
7、为了测定某铁粉中杂质的含量,取该铁粉样品20克,放到盛有200克稀盐酸的烧杯中,反应后烧杯中物质总质量变成219.4克.
求:铁粉中纯铁的质量分数.解:由题意可知,铁粉中铁与稀硫酸反应生成的H2的质量为(200+20)-219.4=0.6g.
设铁粉中纯铁的质量为x,Fe + H2SO4== FeSO4 + H2↑5620.6gxx=16.8g所以,铁粉中纯铁的质量分数为:答:铁粉中纯铁的质量分数为84%。金属活动性顺序表反应条件反应次序 由金属活动性顺序的内容可知:活动性最强的金属是K,活动性最弱的金属是Au,能跟酸发生置换反应的金属的化学活动性比氢(H)强,能把另一金属从其可溶性盐溶液中置换出来的金属的活动性比盐中金属的活动性强。总结一、理解一个内涵
金属活动性顺序的内容: 1、金属与酸发生置换反应产生氢气应具备的条件是:
(1)金属的位置:在金属活动性顺序中,金属的位置要在氢(H)的前面;
(2)酸要用无氧化性的酸:如盐酸、稀硫酸等
(3)硝酸具有氧化性,与金属反应时一般生成水而不生成氢气,因而不发生置换反应;
(4)铁与酸发生置换反应生成氢气时,生成的是+2价的亚铁盐。 总结二、熟记两个条件 2、金属与盐溶液发生置换反应的条件是:
(1)金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;
(2)特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3)盐必须溶于水;
(4)铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时要用+2价的亚铁盐。 总结 三、把握三个规律
1、金属与盐溶液的反应规律:不同金属与盐溶液反应时,活动性强的金属先与盐反应;同一金属与不同的盐溶液反应时,该金属先与活动性较弱的金属所组成的盐反应。 三、把握三个规律
2、用实验方法验证金属的活动性顺序的解题规律是:
(1)首先将金属按其活动性由强到弱的顺序进行排列;
(2)试剂的选择:①选取中间的金属,两端的金属用其可溶性盐的溶液。②选取两端的金属,中间的金属用其可溶性盐的溶液;
(3)选取铁盐时应用可溶性的+2价的亚铁盐。 三、把握三个规律
3、金属与酸(或盐溶液)发生置换反应后溶液质量的变化规律是:只要比较反应前后溶液中溶质的相对分子质量与相应计量数的积的大小即可:若反应后的溶液中溶质的相对分子质量与相应计量数的积变小,则反应后溶液的质量减小,否则增大。
2、金属与氧气反应的难易和剧烈程度是否 相同?阅读课本P9金属与氧气的反应①镁、铝在常温下就与氧气反应
②铁.铜可与氧气反应
③金在高温时也不与氧气反应 大多数金属都能与氧气发生反应,但反应的难易和剧烈程度是不同的。一、金属与氧气的反应4Al+3O2═2Al2O3 ;2Mg+O2═2MgO 4Fe+3O2═2Fe3O4 ; 2Cu+O2═2CuO 点燃△ “真金不怕火炼”的涵义:金很不活泼即使在高温下也不与氧气反应。
分析与讨论为什么不同的金属与氧气反应时的难易程度和剧烈程度会不同呢?不同的金属活泼程度(即金属活动性)不一样。越活泼的金属越容易与别的物质起反应,且反应现象越剧烈。活动性:镁、铝 > 铁、铜 > 金判断金属活动性的方法一:
金属与氧气反应的难易和剧烈程度 镁和铝在常温下可与氧气反应,
为什么铝会具有很好的抗腐蚀性呢? 思考:(1)为什么铝制品不容易生锈?
铝常温与氧气反应,生成一层致密的氧化铝薄膜,阻止铝进一步氧化。(2)生活中铝制品能否用钢刷、沙擦洗?不能。钢刷、沙等破坏表面致密的保护膜温馨提示:铝会损害神经系统,有可能导致老年痴呆症,对其他器官也有损害。所以国家对于食品添加剂中的铝含量制定了相关标准 二、金属与酸的反应实验探究:
1.在4只试管里分别放入一小块镁、锌、铁、铜,再分别加入约5mL稀盐酸,观察现象,比较反应的剧烈程度。如果有气体生成,判断反应后生成了什么气体?
2. 用稀硫酸代替稀盐酸进行实验,并比较发生的现象。 友情提示:实验操作要规范,取用稀盐酸 和稀硫酸一定要小心奥! 无现象反应最剧烈,
产生大量气泡。反应较为剧烈,产生较多的气泡。反应缓慢,少量气泡,溶液由无
色变为浅绿色。Mg+2HCl==MgCl2+H2↑Mg+H2SO4==MgSO4+H2↑Zn+2HCl==ZnCl2+H2↑Zn+H2SO4==ZnSO4+H2↑Fe+H2SO4==FeSO4+H2↑Fe+2HCl==FeCl2+H2↑1、哪些金属与盐酸反应?
哪些不与盐酸反应?2、根据是否与酸反应,可把这四种金属分成几类?3、与酸反应的剧烈程度如何?谁最活泼?我最活泼!
我的金属活动性最强God Save Me!为什么受伤总是我!无所谓,我无所谓
我得意的笑
又得意的笑金属活动性顺序:Mg﹥Zn ﹥Fe ﹥Cu2、判断金属活动性的方法二:
根据金属是否与酸反应及反应的剧烈程度判断金属的活动性强弱; 分析镁、锌、铁和盐酸、稀硫酸的反应,从反应物和生成物的物质类别(如单质、化合物)的角度分析,这些反应有什么特点?和我们学过的化合反应、分解反应一样吗?Mg + 2 HCl = MgCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
单质化合物化合物单质置换反应 由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。1、概念:2、表达式:A+BC→B+AC 化合反应:
分解反应:
置换反应:3、特点:一换一4.基本
反应
类型A+B→AB 多变一AB → A+B 一变多A+BC→B+AC一换一小试牛刀试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应(1)2Al+6HCl=2AlCl3+3H2↑ ( )(2)H2CO3=CO2↑+H2O ( )(3)Fe+CuSO4=FeSO4+Cu ( )(4)CaO+H2O=Ca(OH)2 ( )CBCA
不是是Al + H2SO4 = Al2 (SO4)3 + H2↑Al + HCl = AlCl3 + H2↑判断下面化学反应属于置换反应吗? 是是2623233是1、铝是一种应用广泛的金属,下列有关铝的描述中,正确的是( )。
A.铝是地壳中含量最高的元素
B.镁铝合金可用于制造飞机
C.铝的化学性质不如铁活泼
D.铝制容器的表面有一层氧化物保护膜,可以用来盛装盐酸
2、“真金不怕火炼”的化学含义是( )
A.金的熔点低 B.金的导电性强
C.金是贵重金属 D.金的化学性质稳定
BD3、下列化合物中,不能通过金属与酸反应而得到的是( )
A.MgSO4 B.CuCl2
C.FeSO4 D.FeCl2
B4、以铁、水、稀盐酸、氧气、稀硫酸为原料,根据下列化学反应类型,写出相应的化学方程式。 (1)化合反应__________________ (2)分解反应___________________ (3)置换反应__________________ 3Fe + 2O2 == Fe3O42H2O == 2H2↑+ O2↑点燃通电Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑5、金属与酸反应的剧烈程度,可以反映金属的活动性如图是甲、乙、丙、丁四种金属与盐酸反应的漫画,周围的小黑点表示反应生成的气体,则这四种金属的活动性由强到弱的顺序为________。若甲为镁,生成的气体是氢气(H2),则反应的化学方程式为____________,反应类型是________(填“置换反应”“分解反应”或“化合反应”),该反应由一种________和一种________反应,生成另一种________和另一种________。甲 乙 丙丁Mg + 2HCl = MgCl2 + H2↑置换反应单质化合物单质化合物三、金属与金属化合物溶液反应(即金属与盐溶液的反应)实验探究
1.把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过一会观察有什么现象?
2.把一根洁净的铜丝浸入硝酸银溶液中,过一会观察有什么现象发生?
3.把一根用砂纸打磨过的铁丝浸入硫酸铜溶液中,过一会观察有什么现象?
4.把另一根洁净的铜丝浸入硫酸铝溶液中,过一会观察有什么现象发生?铝丝表面覆盖一层紫红色物质,溶液由蓝色逐渐变为无色。2Al + 3CuSO4= Al2(SO4)3 + 3CuCu +2Ag NO3 =Cu(NO3)2 + 2Ag铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色。铁丝表面覆盖一层紫红色物质,溶液由蓝色逐渐变为浅绿色。Fe + CuSO4= FeSO4 + Cu无现象Al Cu Ag金属活动性由强减弱?2、通过上述探究,你能得出铝、铜、银的金属活动性顺序吗?1、上述能发生反应的化学方程式的特点是什么?它们属于那种反应类型?一种单质与一种化合物反应生成另一种单质和另一种化合物。置换反应3、你能从上述实验找出判断金属活动性的方法吗?判断金属活动性的方法三:
金属能否把另一种金属从其盐溶液中置换出来
1.大多数金属能与氧气反应2.大多数金属能与盐酸或稀硫酸反应3.部分金属能与金属化合物的溶液反应金属活动性反应越容易,越剧烈,金属越活泼参加反应的金属比置换出的金属活泼小结:金属的化学性质四、金属在溶液中的活动性顺序: k Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
钾 钙 钠 镁 铝, 锌 铁 锡 铅 (氢), 铜 汞 银 铂 金.?
金属活动性由强逐渐减弱这是重点!应用依据:
1、在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2、在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3、在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。①酸:是指稀硫酸、盐酸,不是浓硫酸和硝酸(金属与浓硫酸和硝酸等反应时,不产生氢气)(2)判断金属跟酸反应时的要点(3)判断金属跟金属化合物溶液反应时要点①前换后,盐是可溶,②金属不用K、Ca、Na等。(这些金属常温
下和水发生应,而不能置换金属化合物溶液
的金属。)(1)适用范围
金属活动性顺序仅适用于在水溶液中的反应。③铁参加置换反应,生成亚铁盐?1.判断下列物质能否发生反应?若能,写出相关化学方程式。
1)银与稀盐酸 2)锌与硫酸铜溶液 3)铜与硫酸锌溶液 4)铝与硝酸银溶液
5)银与氯化铜溶液 6)镁与硫酸亚铁溶液解答:可发生反应的:(2)(4)(6)(2)Zn + CuSO4 = Cu + ZnSO4(4)Al +3AgNO3 = Al(NO3)3 + 3Ag(6)Mg + FeSO4 = MgSO4 +Fe四、金属活动性顺序的应用: 应用1判断溶液中的置换反应能否发生及反应现象2、不能由金属跟盐酸直接反应制得的物质是( ? )
?A.MgCl2??? B.FeCl3???C.CuCl2?? D.ZnCl2
?3、在盛有硫酸亚铁溶液的试管里,浸入一根洁净的铜丝,过一段时间后,取出铜丝观察,铜丝表面 。在盛有硫酸铜溶液的试管里,浸入一块铁丝,过一会儿取出,观察到的现象为 。在
盛有硝酸银溶液的试管里,浸入一跟洁净的铜丝,观察到的现象为 ,
化学方程式为 。 无现象BC 铁丝表面有红色物质析出,溶液由蓝色变为浅绿色铜丝表面有银白色物质析出,溶液由无色变为蓝色Cu +2AgNO3 =Cu(NO3)2 + 2Ag 4、下列置换反应的化学方程式正确的是 ( )
A.2Fe+3CuCl2 = 2FeCl3 +3Cu
B. 2Na+CuSO4 = Cu+Na2SO4
C. Zn +2AgNO3 =2Ag + Zn(NO3)2
D. Cu+ 2AgCl= CuCl2 + 2AgCK Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属与盐发生置换反应,盐必须是可溶的3.Fe + CuSO4= FeSO4 + CuFe + 2HCl = FeCl2 + H2 ↑ 化合反应 化合反应 置换反应 置换反应 1、铝制品表面有一层致密的氧化铝薄膜,阻碍铝进一步被氧化。若用钢刷、沙等来擦洗铝制品,容易把氧化铝薄膜除掉,从而起不到保护作用。2、铁和硫酸铜反应生成硫酸亚铁和铜,会造成波尔多液变质,容器被腐蚀3Fe+2O2===Fe3O4点燃化合反应4.Mg + 2HCl ==MgCl2 + H2↑置换反应 化合反应 化合反应 Zn + CuSO4= ZnSO4 + Cu5.Al +3Ag NO3 =Al(NO3)3 + 3Ag置换反应 置换反应 .欲除去铜粉中的铁粉有多种方法,请举例几种:加入足量的稀盐酸中,当反应至没有
气泡时,过滤。加入足量的硫酸铜溶液中,至铁完全反应。用磁铁吸引铁粉达到分离的目的。6、填写下列表格(括号内为杂质)Fe+2HCl=FeCl2+H2↑Fe+CuCl2=FeCl2+Cu 溶解、过滤、洗涤溶解、过滤练习:下列除去杂质的方法中,错误的是D 7.有X Y Z三种金属,如果把X和Y分别放入稀硫酸中, X 溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化.根据以上事实,判断X Y Z的金属活动顺序. X>Y>Z2、X、Y、Z三种金属及化合物间发生如下化学反应Y+ZCl2===Z+YCl2?? X+ZCl2===Z+XCl2
Y+2HCl===YCl2+H2↑? X与稀盐酸不反应。
则X、Y、Z三种金属的活动性由强到弱的顺序(? )
A.Z>Y>X??B.X>Y>Z C.Y>X>Z??D.Y>Z>XC应用2:比较金属活动性强弱 3、若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是( )
A. Mn+2HCl ==MnC12+H2↑
B. Mg +MnSO4== MgSO4+Mn
C. Mn+Cu(NO3)2===Mn(NO3)2+Cu
D. Fe+MnSO4 ==FeSO4+Mn D4、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是( )
A.Mn、Mg、Cu B.Mg、Mn、Cu
C.Cu、Mg、Mn D.Cu、Mn、MgB8.镁,锌,铁三种金属各30g,分别投入足量的稀盐酸中,生成氢气的质量各是多少?等质量金属与足量的酸反应,产生氢气的质量由大到小的顺序为 :铝﹥镁﹥铁﹥锌例:镁,锌,铁三种金属分别投入足量的稀硫酸中,求产生30gH2分别消耗的金属镁,锌,铁各多少克?产生相同的氢气时,消耗的金属的质量由大到小的顺序为:锌 ﹥铁﹥镁﹥铝验证三种金属活动性顺序的方法1、前后金属单质,中间盐溶液2、中间金属单质,前后盐溶液4、前两种金属单质,后两种金属的可溶性盐3、前两种金属单质,一种酸,后金属的可溶性盐如:证明Zn>Cu>AgZn、Ag、CuSO4溶液Cu、ZnSO4溶液、AgNO3溶液Zn 、 Cu、Cu SO4溶液、 AgNO3溶液Cu、 Zn、 HCl 、 AgNO3溶液试剂Zn AgZn AgZn (H)Cu Ag(H) Cu Zn CuZn (H)Zn CuZn (H)(H) Cu
(H) Ag 多余B1、某研究性学习小组的成员为了验证锌、铜、银三种金属的活动性顺序,设计了如下方案,其中可行的是( )
A、Cu、 Zn(NO3)2溶液、 Ag
B、稀硫酸、 Zn、Cu、AgNO3溶液
C、稀盐酸、 Zn 、Cu(NO3)2溶液
D、Zn、稀硫酸、 Cu、Ag应用四 判断金属跟混合盐溶液反应的反应。 反应的先后次序是:在金属活动性顺序表里,排在越后面的金属,越易从它们的盐溶液里被置换出来。或者说:金属活动性相差越大,置换反应越易发生。[例1]将一定质量的铁粉放入足量相同质量分数的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是( )A FeB. CuC.AgC1、向含AgNO3、 Cu(NO3)2、Mg(NO3)2 的混合溶液中,加入过量的锌粉,充分反应后过滤,则滤出的固体中一定有 ( ) A. Ag、Cu和Mg B. Cu、Mg和Zn
C. Ag、Cu和Zn D. Ag 、Mg和Zn C练习2、将一定质量的锌粉放入Cu(NO3)2 和 AgNO3的混合溶液中,充分反应后过滤,测得滤渣中只含一种金属,该金属是 , 变式训练:1.如果在滤渣中加入稀盐酸,发现有气体生成,则滤液中一定不存在的物质是 ,硝酸银、硝酸铜
2.如果在滤液中有硝酸银存在,则在滤渣中一定不存在的物质是 .铜 和 锌
银3、在FeCl2 和CuCl2的混合溶液中加入镁粉,下面说法中错误的是 ( )
A、当镁粉无剩余时,溶液中若有Cu2+,则必定有Fe2+
B、当镁粉无剩余时,溶液中一定有Mg2+,可能有Cu2+和 Fe2+
C、当镁粉有剩余时,溶液中只有Fe2+,而无Mg2+和Cu2+
D、当镁粉有剩余时,溶液中只有Mg2+,而无Cu2+和Fe2+C判断金属与酸发生置换反应的速率大小及产生氢气的质量 应用5: 将等质量的铝、镁、铁、锌、铜分别投入到溶质质量分数相同且足量的盐酸中,请思考下列问题: (1)反应速率(2)生成氢气的质量Al>Mg > Fe >Zn Cu不反应 知识的回顾Mg >Al>Zn >Fe Cu不反应1、今有等质量铝、镁、铁、锌四种金属与足量的溶质质量分数相同稀盐酸反应(如图所示),用A、B、C、D代表这四种金属,则A、B、C、D分别是:铝:
镁:
铁:锌:典型例题K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au镁锌铝铁等质量的铝、镁、铁、锌分别与质量相同,质量分数也相同的稀硫酸充分反应放出氢气的情况如图所示,请完成下列问题:⑴则A、B、C、D
分别表示________
⑵反应不再发生时,
一定用完的物质是____Mg、Al、Zn、Fe稀硫酸Mg Al Zn Fe习题精选t1 1、 相同质量的Mg、Zn、Fe和足量的稀硫酸反应,产生氢气的总质量(m)随时间(t)变化的关系如下图,则下图中a、b、c表示的金属分别为:a 、 b 、c 。
abcMgFeZn2.将质量相同A、B、C的三种金属,同时放入三份溶质质量分数相同且足量的稀盐酸中,反应生成氢气的质量与反应的时间关系如图所示。根据图中所提示的信息,得出的结论正确的是 ( )
(已知A、B、C三种金属都是+2价)A、放出H2的质量是A>B>C
B、金属活动性顺序是A>B>C
C、反应速率最大的是A
D、相对原子质量是C>A> BA3、相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。
下列叙述正确的是 ( )
A.金属的活泼性N>M
B.两个反应生成H2的体积相等
C.相对原子质量N>M
D.两个反应消耗盐酸的质量一定相等 C 4.(2012.青岛市)现有镁、铝两种金属分别跟稀盐酸充分反应,生成相同质量的氢气。则可能的情况有 ( )
A.足量的稀盐酸与等质量的镁、铝发生反应
B.足量的稀盐酸与质量比为4:3的镁、铝发生反应
C.足量的稀盐酸与质量比为8:9的镁、铝发生反应
D.等质量、等溶质质量分数的稀盐酸与过量的镁、铝发生反应BD练习5:相同质量的Na,Mg,Al与过量的盐酸
反应,在相同的条件下,放出氢气的质量比是:(A)1:2:3 (B)9:12:23
(C)23:12:9 (D)36:69:92答案:()D练习6:将6克某些金属的混合物与足量的盐酸反应,得0.2克氢气,则该混合物的可能组成是: (A) Mg , Al (B) Cu , Zn
(C) Zn , Fe (D) Na , Mg 答案:()C 11.将铁片分别放入下列溶液中充分反应,反应后能使铁片质量增重的物质是:A. H2SO4 B. FeSO4 C. HCl D. CuSO4Fe + 2HCl = FeCl2 + H2↑Fe + H2SO4 = FeSO4 + H2 ↑Fe + CuSO4= FeSO4 + Cu5664 1.将铁片分别放入下列溶液中充分反应,反应后溶液质量比反应前增重的是:A. H2SO4 B. FeSO4 C. HCl D. CuSO4Fe + 2HCl = FeCl2 + H2↑Fe + H2SO4 = FeSO4 + H2 ↑Fe + CuSO4= FeSO4 + Cu5664562 562 3、下列反应属于置换反应的是( )
①H2+CuO==Cu+H2O
②2CO+O2==2CO2
③Zn+2HCl==ZnCl2+H2↑
④Fe2O3+3CO==2Fe+3CO2
A、①④ B、②③ C、①③ D、②④ ΔΔC 10.商代的司母戊方鼎标志着我国在3000多年前青器铸造已达到一个较高的水平。西汉时期,我国首开“湿法炼铜”之先河,西汉刘安所著的《淮南万毕术》中已有“曾青得铁化为铜”的记载。试回答下列问题;
(1)青铜属于 (填“单质”、“化合物”、
、“合金”中之一)
(2)“湿法炼铜”的原理可用一个化学方程式表示为:
(3)上述化学反应属于 反应。合金Fe + CuSO4= FeSO4 + Cu置换反应 5.黄铜是铜、锌合金,它用于制造机器、电器零件等。为测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全反应,产生氢气0.1g。试求:
(1)该黄铜样品中锌的质量。
(2)该黄铜样品中铜的质量分数。
7、为了测定某铁粉中杂质的含量,取该铁粉样品20克,放到盛有200克稀盐酸的烧杯中,反应后烧杯中物质总质量变成219.4克.
求:铁粉中纯铁的质量分数.解:由题意可知,铁粉中铁与稀硫酸反应生成的H2的质量为(200+20)-219.4=0.6g.
设铁粉中纯铁的质量为x,Fe + H2SO4== FeSO4 + H2↑5620.6gxx=16.8g所以,铁粉中纯铁的质量分数为:答:铁粉中纯铁的质量分数为84%。金属活动性顺序表反应条件反应次序 由金属活动性顺序的内容可知:活动性最强的金属是K,活动性最弱的金属是Au,能跟酸发生置换反应的金属的化学活动性比氢(H)强,能把另一金属从其可溶性盐溶液中置换出来的金属的活动性比盐中金属的活动性强。总结一、理解一个内涵
金属活动性顺序的内容: 1、金属与酸发生置换反应产生氢气应具备的条件是:
(1)金属的位置:在金属活动性顺序中,金属的位置要在氢(H)的前面;
(2)酸要用无氧化性的酸:如盐酸、稀硫酸等
(3)硝酸具有氧化性,与金属反应时一般生成水而不生成氢气,因而不发生置换反应;
(4)铁与酸发生置换反应生成氢气时,生成的是+2价的亚铁盐。 总结二、熟记两个条件 2、金属与盐溶液发生置换反应的条件是:
(1)金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;
(2)特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3)盐必须溶于水;
(4)铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时要用+2价的亚铁盐。 总结 三、把握三个规律
1、金属与盐溶液的反应规律:不同金属与盐溶液反应时,活动性强的金属先与盐反应;同一金属与不同的盐溶液反应时,该金属先与活动性较弱的金属所组成的盐反应。 三、把握三个规律
2、用实验方法验证金属的活动性顺序的解题规律是:
(1)首先将金属按其活动性由强到弱的顺序进行排列;
(2)试剂的选择:①选取中间的金属,两端的金属用其可溶性盐的溶液。②选取两端的金属,中间的金属用其可溶性盐的溶液;
(3)选取铁盐时应用可溶性的+2价的亚铁盐。 三、把握三个规律
3、金属与酸(或盐溶液)发生置换反应后溶液质量的变化规律是:只要比较反应前后溶液中溶质的相对分子质量与相应计量数的积的大小即可:若反应后的溶液中溶质的相对分子质量与相应计量数的积变小,则反应后溶液的质量减小,否则增大。
同课章节目录
