4.4 化学式与化合价(45张ppt)
文档属性
| 名称 | 4.4 化学式与化合价(45张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 967.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-06-15 00:00:00 | ||
图片预览









文档简介
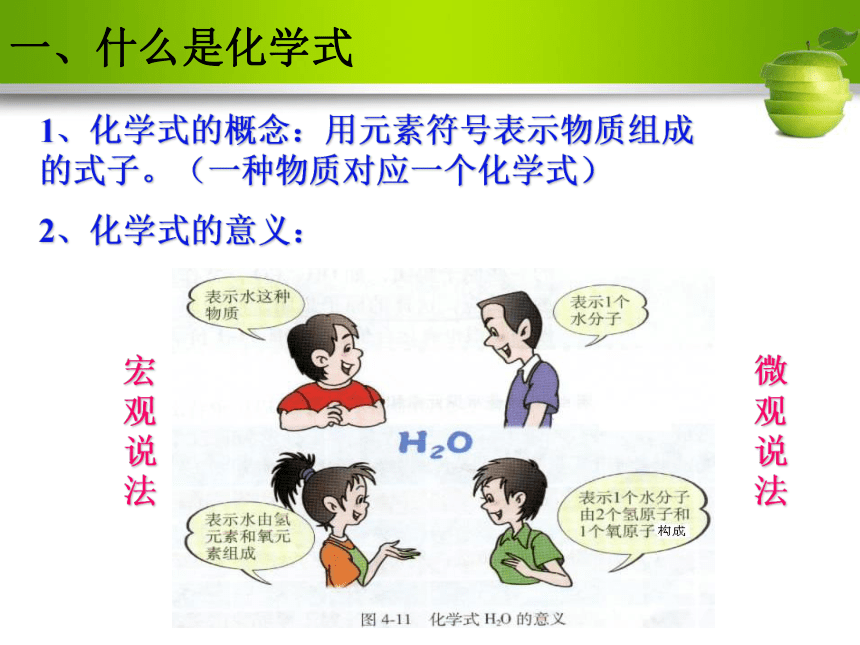
课件45张PPT。课题4 化学式与化合价By teacher zhou一、什么是化学式1、化学式的概念:用元素符号表示物质组成的式子。(一种物质对应一个化学式)
2、化学式的意义:宏观说法微观说法1、化学式的意义(1)表示一种物质(2)表示该物质的元素组成(3)表示物质的一个分子(4)表示物质的分子构成宏观微观指出下列符号的意义:
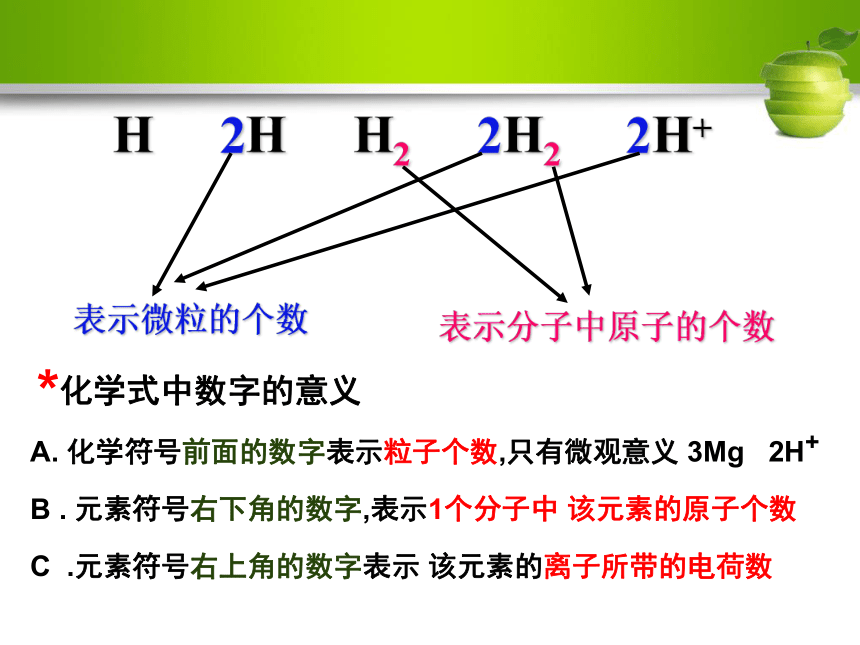
H
2H
H2
2H2
2H+氢元素 或 1个氢原子2个氢原子氢气 氢气由氢元素组成 1个氢分子 1个分子由2个氢原子构成2个氢分子2个氢离子*化学式中数字的意义A. 化学符号前面的数字表示粒子个数,只有微观意义 3Mg 2H+B . 元素符号右下角的数字,表示1个分子中 该元素的原子个数C .元素符号右上角的数字表示 该元素的离子所带的电荷数H 2H H2 2H2 2H+表示微粒的个数表示分子中原子的个数练习1:说出化学式CO2表示的意义 表示二氧化碳这种物质
表示二氧化碳由碳元素和氧元素组成
表示1个二氧化碳分子
表示1 个二氧化碳分子由1个碳原子和2个氧 原子构成练习2:
2个二氧化碳分子:_______________;
2O2:______ (3)a个氢分子:________
(4)二氧化硫:______
(5) He:______,_______,___________。2CO2两个氧分子氦元素SO2a H2一个氦原子氦气1.化合价是元素的原子相互化合时的数目一.什么是化合价?化合价有正负之分判断下列说法是否正确:1、显正价的一定是金属元素。2、非金属元素一定显负价。3一种元素只能显一种化合价。①在化合物里,正负化合价的代数和为零。
②在化合物里氢通常显+1价,氧通常显-2价。
③金属元素通常显正价,非金属元素通常显负价。
④一些元素在不同的物质中可显不同的化合价,如: FeO、Fe2O3
⑤单质里元素的化合价为0价。2.化合价的有关规律化合物都有固定的组成,如:+1-2-1+1-1-2+1+1+3-2化合物中元素化合价的代数和为零3.化合价的书写:
正二价的镁元素:+2Mg规则:先写元素符号,然后在元素
符号的正上方写上+、 —号,再写数字!+1+2+3-1-2离子符号和化合价的表示方法不同:
离子:数字在前“+” “-”号在后;写在右上角。
化合价:数字在后“+” “-” 号在前;写上方。化合价数值 与离子所带电荷 数值 相同4.化合价和离子符号的比较观察
与思考化合价与离子符号表示意义的区别2:2+:表示在氧化镁中镁元素的化合价为+2价表示2个镁离子表示每个镁离子带两个单位的正电荷一价 钾 钠 氯 银 氢
二价 氧 钙 钡 镁 锌
三铝 四 硅 五 氮 磷
二三 铁 二四 碳
二四六硫 都齐全
铜汞二价 最常见化合价口决原子团( 根 ):
常见原子团 OH-、 NO3-、SO42-、CO32-、NH4+
化合价分别为 –1、 -1、 -2 、 -2、 +1 价。原子团的化合价等于它的电荷数 原子团(根)
负一氢氧、硝酸根
负二硫酸、碳酸根
还有负三磷酸根
只有正一是铵根 说明下列化学元素用语各表示的意义
Mg (2) 2Mg
(3) Mg2+ (4) 2Mg2+
(5) Mg (6) MgO
课堂练习:+2+2(1)、根据化学式确定元素的化合价:例1、标出化学式中各元素的化合价氯化锌 金属锌 氢氧化钠 ZnCl2 Zn NaOH+2-10+1-2+1注意:化合价标在相应元素符号的正上方二、化合价的运用:例2、试确定氯酸钾中氯元素的化合价【思路】先写出化学式KClO3设未知数解:设KClO3中Cl的化合价为X 列等式
(正负化合价总和为0) 1+X+(-2)×3=0解答 X=+5
答:氯酸钾中氯元素的化合价为+5价+ 5(2)、根据元素的化合价确定化学式:例3、已知某种磷的氧化物中磷的化合价为+3,写出这种磷的氧化物的化学式【思路】(1)先写元素符号(正左负右)(2)标出各元素的化合价(正上方)(3)把化合价数值交叉写出(4)将数字化为最简
(除以最大公约数)P OP O+ 3 -2P2O 3省略+ 3 -2P2O3十字交叉法假如为1,省略不写根据元素的化合价写出下列物质的化学式 1.氧化铁 2.硫酸铝 3.氧化铜 书写方法
正左负右,
标价交叉,
约简复查。Fe O+3 -2 23验证:(+3)×2 +(-2)×3 = 0Al SO4Cu O+3 - 22( )验证:(+3)×2 + (-2)×3 = 0+2 -2 验证:(+2) +(-2)= 03练一练1、已知在H3RO4中,氢元素为+1价,氧为-2价,则其中R的化合价为( )
A、+3 B、+4 C、+5 D、+6
2、下列化合物中,氮元素为+5价的是( )
A、N0 B、NO2 C、HNO2 D、KNO3
3、元素R的氧化物的化学式为R2O3,则R元素与OH-组成的物质的化学式为( )
A、ROH B、R(OH)2 C、R(OH)3 D、R(OH)4CDC堂堂清4、说出下列物质中硫元素的化合价
H2S S H2SO3 H2SO4
5、试确定下列化合物中原子团的化合价
KOH Mg(NO3)2 BaSO4 Na2CO3 Na3PO4-20+4+6-1-1-2-2-36、下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ______, 氯化铁 FeCl2 ______,
氯化锌 ZnCl ______, 硫化铝 Al3S2 ______,
氢氧化铜CuOH ________,氯化钠ClNa ____CaOFeCl3Al2S3Cu(OH)2NaClZnCl27. 已知铁元素有+3和+2二种化合价,分别写出铁元素同硫酸根(SO42-)化合的化合物的化学式。
硫酸铝的化学式又怎样呢?
硫酸铁:Fe2(SO4)3硫酸亚铁:FeSO4硫酸铝:Al2(SO4)3三、化学式的写法1、单质的写法:
a、金属和稀有气体及大多数固态非金属单质直接用元素符号表示如 C、S、 P、Si。 b、气态非金属单质,用元素符号和数字表示如:
O2、H2 、N2 、 Cl2、O3
2、化合物的写法① 氧化物:氧元素写在右边,其它元素写在左边,
CO2、P2O5、Fe3O4、H2O、 MgO、HgO 金属化合物: 把金属元素写在左边,其它元素写在右边
NaCl,Ca(OH)2,KOH, FeCl3、CuSO4a.金属氧化物:读作“氧化某”如 HgO,读作
氧化汞 四、化学式的读法: (1) 单质 a.固态 直接读元素名称b.气态 读“某气”(2) 氧化物b.非金属氧化物:读作“几氧化几某” 如 P2O5读作 五氧化二磷 酸:氢元素+酸根 某酸
H2SO4 硫酸 H2CO3 碳酸碱: 金属元素+氢氧根 氢氧化某
NaOH 氢氧化钠 Ca(OH)2 氢氧化钙盐: 金属元素+酸 根 某酸某
Na2SO4 硫酸钠 AgNO3 硝酸银(3) 两种元素组成的化合物如:读作“某化某” 如ZnS读作硫化锌。(4)酸碱盐某化某:指该物质中含两种元素
某酸某:指该物质中含“某酸根”原子团
氢氧化某:指该物质中含“氢氧根”原子团
某化亚某:
某酸亚某:
氢氧化亚某:注意规律:顺写反读指该物质中正价元素有两种化合价,且取该元素较低的化合价。4、化学式的读法:Al2O3请分别写出氧化铝和硫酸铝的化学式 一写
二标
三约分交叉Al OAl O +3 -2Al SO4Al SO4+3 -2Al2(SO4)3练习1:写出下列物质的化学式。 氧化钾
氧化钙
氧化铁氯化钾
氯化钙
氯化亚铁氢氧化钾
氢氧化钙
氢氧化铁硫酸钾
硫酸钙
硫酸铁K2OCaCl2KClKOHK2SO4CaOCa(OH)2Ca SO4Fe2O3FeCl2Fe(OH)3
Fe 2 (SO4) 3
填空:
下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ______, 氯化铁 FeCl2 ______,
氯化锌 ZnCl ______, 硫化铝 Al3S2 ______,
氧化钠NaO2 ____, 氯化钠ClNa ______。CaOFeCl3ZnCl2Al2S3Na2ONaCl练习:1、下列物质的名称与化学式相符合的是( )A 氢气( H ) B 氯化钾(KCIO3)
C 氧化钙 Oca D 五氧化二磷(P2O5)D2个铁原子2个水分子,1个水分子中含有2个氢原子1 个镁离子带
2个单位的正电荷1个氢分子中
含有2个氢原子2个碳酸根离子,1个碳酸根
离子带 2个单位的负电荷 1个锰酸钾分子中含有 2个钾原子 练习3:如图是四位同学对某化学式的描述,
他们描述的是( )A:CO, B:O2, C:Ne, D:H2OB定义: 化学式中各原子的相对原子质量总和
单位为1,一般省略不写, 符号为Mr 一.相对分子质量∴H2O的相对分子质量 = 1×2+16 =18H2O的意义:一个水分子是由两个氢原子和一个氧原子构成的。真实质量:一个水分子的质量=两个氢原子质量+一个氧原子的质量相对质量:一个水分子的相对分子质量=两个氢原子相对原子质量+一个氧原子的相对原子质量二、有关相对分子质量的计算想一想就知道了氢的相对原子质量氢原子的个数氧的相对原子质量1.计算相对分子质量 [例题1]:计算下列物质的相对分子质量 。
N2 的相对分子质量=
H2SO4的相对分子质量=
Cu(OH)2的相对分子质量=
Mr ( NH4NO3) =
Mr (C6H12O6) = 14× 2 = 281× 2 + 32 + 16 × 4= 9864 +(16+1)×2 = 9814+1× 4 + 14 + 16 × 3= 8012× 6+ 1 ×12 + 16 × 6= 1802.计算物质组成元素的质量比 [例题2]:计算下列物质中各元素的质量比。
H2O
CO2
NH4NO3
CO(NH2)2 m(H) : m(O) =(1× 2) :16 = 1 : 8m(C) : m(O) = 12 :(16 × 2) = 3 : 8m(N) : m(H) : m(O) =(14 × 2):(1×4 ): (16 ×3)
= 7 : 1 : 12 m(C) : m(O) : m(N) : m(H)
= 12 : 16 : (14×2) : (1×4)
= 3 : 4 : 7 : 13.计算物质中某元素的质量分数 [例题3]:(1)计算氮肥NH4NO3中氮元素的质量分数。
(2)若测得某种NH4NO3的含氮量为18%,判断该物质是否纯净? NH4NO3中氮元素的质量分数:NH4NO3的相对分子质量N的相对原子质量×N的原子数8014 ×2 ×100%×100%=35%解:=(1)NH4NO3的相对分子质量 =14+1×4 + 14+ 16×3
=80=因为18%<35%, 所以该物质不纯净.答:略4.计算物质中某元素的质量[例题4]: 60 Kg NH4NO3中含氮元素多少Kg ? [例题5]:某化合物的化学式为RO2 ,其中氧元素的质量分数为50%,求R的相对原子质量并确定R为何种元素?5.综合应用 8014 ×2 ×100% = 60Kg× 35% = 21 Kg解:60Kg ×答:略NH4NO3的相对分子质量 =14+1×4 + 14+ 16×3
=80m(N)=1.右图是某厂生产的葡萄糖酸锌口服液的标签,每
支口服液含葡萄糖酸锌45.5mg,标签中____上的数
据是多少?××牌口服液
主要成份:葡萄糖酸锌
化学式:C12H22O14Zn
含锌量:每支口服液
含锌_____mg
××制药厂解:葡萄糖酸锌的相对分子质量=
12×12+1×22+16×14+65=455
葡萄糖酸锌中含锌的质量=
45.5mg×14.3%=6.5mg课堂练习2,鱼油中富含的DHA( C22H32O2 )是大脑细胞形成和发育不可
缺少的物质,K下列关于DHA的叙述中不正确的是( )
A DHA由三种元素组成, B DHA是氧化物
C DHA 中碳.氢.氧元素的质量比为33:4:4
D. DHA中氢元素的质量分数最大B D3,丁酸丁酯(C6H12O2)是一种无色无味的液体,下列叙述中.正确的是( )
A.丁酸丁酯是由20个原子构成,
B.丁酸丁酯的相对原子质量为116g
C.丁酸丁酯中C.H.O元素的质量比为3:6:1
D.丁酸丁酯中C.H.O元素的质量比为18:3:8D4,味精是常用的调味品,它的主要成分是“谷氨酸钠”,它的化学式为(C6H8NO4Na)。某市生产的味精包装上标注:每包净重10g,谷氨酸钠含量≧85%。问:
(1)谷氨酸钠中含有________种元素。
(2)谷氨酸钠的相对分子质量为_______。
(3)每一包味精最少含有多少克钠元素(计算结果精确到小数点后一 位)?5181解:每包味精至少含谷氨酸钠为10×85%=8.5(g)
m(Na)=8.5×Na%=8.5×23181×100%=1.1g。 注意:
元素的质量一定是纯净物的质量×元素的质量分数经分析某硝酸铵样品中,氮元素的质量分数为38%,这种
氮肥中可能混入的杂质是( )
A NH4HCO3 B NH4Cl
C CO(NH2)2 D ( NH4)2SO4解: NH4NO3中N%=35%
经计算,
NH4Cl 中 N% = 21.2%
NH4HCO3中 N% = 17.7%
( NH4)2SO4中 N% = 29.2% 均<35%
CO(NH2)2中 N% = 46.7%>38%
所以杂质中N%>38% 选C 变式题1. 求49克硫酸中含硫的质量2: 多少克碳酸氢铵(NH4HCO3)与40g
硝酸铵(NH4NO3)含氮元素质量相等?公式巩固练习3,丙氨酸是一种氨基酸,其相对分子质量89,其中
氮元素的质量分数为15.8%,则每个丙氨酸分子中含
氮原子的个数为 ( )
A 4 B 3 C 2 D 1
2、化学式的意义:宏观说法微观说法1、化学式的意义(1)表示一种物质(2)表示该物质的元素组成(3)表示物质的一个分子(4)表示物质的分子构成宏观微观指出下列符号的意义:
H
2H
H2
2H2
2H+氢元素 或 1个氢原子2个氢原子氢气 氢气由氢元素组成 1个氢分子 1个分子由2个氢原子构成2个氢分子2个氢离子*化学式中数字的意义A. 化学符号前面的数字表示粒子个数,只有微观意义 3Mg 2H+B . 元素符号右下角的数字,表示1个分子中 该元素的原子个数C .元素符号右上角的数字表示 该元素的离子所带的电荷数H 2H H2 2H2 2H+表示微粒的个数表示分子中原子的个数练习1:说出化学式CO2表示的意义 表示二氧化碳这种物质
表示二氧化碳由碳元素和氧元素组成
表示1个二氧化碳分子
表示1 个二氧化碳分子由1个碳原子和2个氧 原子构成练习2:
2个二氧化碳分子:_______________;
2O2:______ (3)a个氢分子:________
(4)二氧化硫:______
(5) He:______,_______,___________。2CO2两个氧分子氦元素SO2a H2一个氦原子氦气1.化合价是元素的原子相互化合时的数目一.什么是化合价?化合价有正负之分判断下列说法是否正确:1、显正价的一定是金属元素。2、非金属元素一定显负价。3一种元素只能显一种化合价。①在化合物里,正负化合价的代数和为零。
②在化合物里氢通常显+1价,氧通常显-2价。
③金属元素通常显正价,非金属元素通常显负价。
④一些元素在不同的物质中可显不同的化合价,如: FeO、Fe2O3
⑤单质里元素的化合价为0价。2.化合价的有关规律化合物都有固定的组成,如:+1-2-1+1-1-2+1+1+3-2化合物中元素化合价的代数和为零3.化合价的书写:
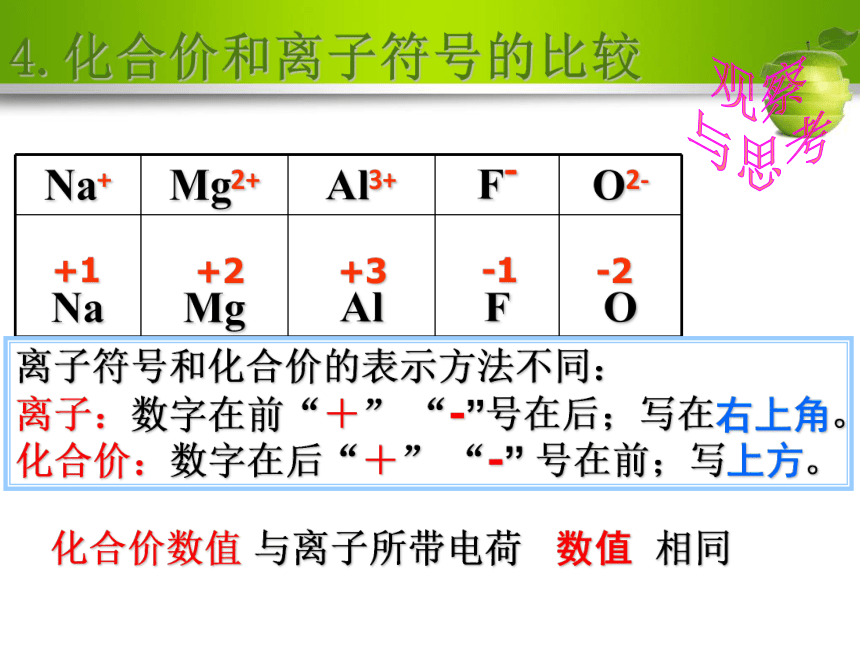
正二价的镁元素:+2Mg规则:先写元素符号,然后在元素
符号的正上方写上+、 —号,再写数字!+1+2+3-1-2离子符号和化合价的表示方法不同:
离子:数字在前“+” “-”号在后;写在右上角。
化合价:数字在后“+” “-” 号在前;写上方。化合价数值 与离子所带电荷 数值 相同4.化合价和离子符号的比较观察
与思考化合价与离子符号表示意义的区别2:2+:表示在氧化镁中镁元素的化合价为+2价表示2个镁离子表示每个镁离子带两个单位的正电荷一价 钾 钠 氯 银 氢
二价 氧 钙 钡 镁 锌
三铝 四 硅 五 氮 磷
二三 铁 二四 碳
二四六硫 都齐全
铜汞二价 最常见化合价口决原子团( 根 ):
常见原子团 OH-、 NO3-、SO42-、CO32-、NH4+
化合价分别为 –1、 -1、 -2 、 -2、 +1 价。原子团的化合价等于它的电荷数 原子团(根)
负一氢氧、硝酸根
负二硫酸、碳酸根
还有负三磷酸根
只有正一是铵根 说明下列化学元素用语各表示的意义
Mg (2) 2Mg
(3) Mg2+ (4) 2Mg2+
(5) Mg (6) MgO
课堂练习:+2+2(1)、根据化学式确定元素的化合价:例1、标出化学式中各元素的化合价氯化锌 金属锌 氢氧化钠 ZnCl2 Zn NaOH+2-10+1-2+1注意:化合价标在相应元素符号的正上方二、化合价的运用:例2、试确定氯酸钾中氯元素的化合价【思路】先写出化学式KClO3设未知数解:设KClO3中Cl的化合价为X 列等式
(正负化合价总和为0) 1+X+(-2)×3=0解答 X=+5
答:氯酸钾中氯元素的化合价为+5价+ 5(2)、根据元素的化合价确定化学式:例3、已知某种磷的氧化物中磷的化合价为+3,写出这种磷的氧化物的化学式【思路】(1)先写元素符号(正左负右)(2)标出各元素的化合价(正上方)(3)把化合价数值交叉写出(4)将数字化为最简
(除以最大公约数)P OP O+ 3 -2P2O 3省略+ 3 -2P2O3十字交叉法假如为1,省略不写根据元素的化合价写出下列物质的化学式 1.氧化铁 2.硫酸铝 3.氧化铜 书写方法
正左负右,
标价交叉,
约简复查。Fe O+3 -2 23验证:(+3)×2 +(-2)×3 = 0Al SO4Cu O+3 - 22( )验证:(+3)×2 + (-2)×3 = 0+2 -2 验证:(+2) +(-2)= 03练一练1、已知在H3RO4中,氢元素为+1价,氧为-2价,则其中R的化合价为( )
A、+3 B、+4 C、+5 D、+6
2、下列化合物中,氮元素为+5价的是( )
A、N0 B、NO2 C、HNO2 D、KNO3
3、元素R的氧化物的化学式为R2O3,则R元素与OH-组成的物质的化学式为( )
A、ROH B、R(OH)2 C、R(OH)3 D、R(OH)4CDC堂堂清4、说出下列物质中硫元素的化合价
H2S S H2SO3 H2SO4
5、试确定下列化合物中原子团的化合价
KOH Mg(NO3)2 BaSO4 Na2CO3 Na3PO4-20+4+6-1-1-2-2-36、下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ______, 氯化铁 FeCl2 ______,
氯化锌 ZnCl ______, 硫化铝 Al3S2 ______,
氢氧化铜CuOH ________,氯化钠ClNa ____CaOFeCl3Al2S3Cu(OH)2NaClZnCl27. 已知铁元素有+3和+2二种化合价,分别写出铁元素同硫酸根(SO42-)化合的化合物的化学式。
硫酸铝的化学式又怎样呢?
硫酸铁:Fe2(SO4)3硫酸亚铁:FeSO4硫酸铝:Al2(SO4)3三、化学式的写法1、单质的写法:
a、金属和稀有气体及大多数固态非金属单质直接用元素符号表示如 C、S、 P、Si。 b、气态非金属单质,用元素符号和数字表示如:
O2、H2 、N2 、 Cl2、O3
2、化合物的写法① 氧化物:氧元素写在右边,其它元素写在左边,
CO2、P2O5、Fe3O4、H2O、 MgO、HgO 金属化合物: 把金属元素写在左边,其它元素写在右边
NaCl,Ca(OH)2,KOH, FeCl3、CuSO4a.金属氧化物:读作“氧化某”如 HgO,读作
氧化汞 四、化学式的读法: (1) 单质 a.固态 直接读元素名称b.气态 读“某气”(2) 氧化物b.非金属氧化物:读作“几氧化几某” 如 P2O5读作 五氧化二磷 酸:氢元素+酸根 某酸
H2SO4 硫酸 H2CO3 碳酸碱: 金属元素+氢氧根 氢氧化某
NaOH 氢氧化钠 Ca(OH)2 氢氧化钙盐: 金属元素+酸 根 某酸某
Na2SO4 硫酸钠 AgNO3 硝酸银(3) 两种元素组成的化合物如:读作“某化某” 如ZnS读作硫化锌。(4)酸碱盐某化某:指该物质中含两种元素
某酸某:指该物质中含“某酸根”原子团
氢氧化某:指该物质中含“氢氧根”原子团
某化亚某:
某酸亚某:
氢氧化亚某:注意规律:顺写反读指该物质中正价元素有两种化合价,且取该元素较低的化合价。4、化学式的读法:Al2O3请分别写出氧化铝和硫酸铝的化学式 一写
二标
三约分交叉Al OAl O +3 -2Al SO4Al SO4+3 -2Al2(SO4)3练习1:写出下列物质的化学式。 氧化钾
氧化钙
氧化铁氯化钾
氯化钙
氯化亚铁氢氧化钾
氢氧化钙
氢氧化铁硫酸钾
硫酸钙
硫酸铁K2OCaCl2KClKOHK2SO4CaOCa(OH)2Ca SO4Fe2O3FeCl2Fe(OH)3
Fe 2 (SO4) 3
填空:
下列化学式如有错误请改在横线上:
氧化钙Ca2O2 ______, 氯化铁 FeCl2 ______,
氯化锌 ZnCl ______, 硫化铝 Al3S2 ______,
氧化钠NaO2 ____, 氯化钠ClNa ______。CaOFeCl3ZnCl2Al2S3Na2ONaCl练习:1、下列物质的名称与化学式相符合的是( )A 氢气( H ) B 氯化钾(KCIO3)
C 氧化钙 Oca D 五氧化二磷(P2O5)D2个铁原子2个水分子,1个水分子中含有2个氢原子1 个镁离子带
2个单位的正电荷1个氢分子中
含有2个氢原子2个碳酸根离子,1个碳酸根
离子带 2个单位的负电荷 1个锰酸钾分子中含有 2个钾原子 练习3:如图是四位同学对某化学式的描述,
他们描述的是( )A:CO, B:O2, C:Ne, D:H2OB定义: 化学式中各原子的相对原子质量总和
单位为1,一般省略不写, 符号为Mr 一.相对分子质量∴H2O的相对分子质量 = 1×2+16 =18H2O的意义:一个水分子是由两个氢原子和一个氧原子构成的。真实质量:一个水分子的质量=两个氢原子质量+一个氧原子的质量相对质量:一个水分子的相对分子质量=两个氢原子相对原子质量+一个氧原子的相对原子质量二、有关相对分子质量的计算想一想就知道了氢的相对原子质量氢原子的个数氧的相对原子质量1.计算相对分子质量 [例题1]:计算下列物质的相对分子质量 。
N2 的相对分子质量=
H2SO4的相对分子质量=
Cu(OH)2的相对分子质量=
Mr ( NH4NO3) =
Mr (C6H12O6) = 14× 2 = 281× 2 + 32 + 16 × 4= 9864 +(16+1)×2 = 9814+1× 4 + 14 + 16 × 3= 8012× 6+ 1 ×12 + 16 × 6= 1802.计算物质组成元素的质量比 [例题2]:计算下列物质中各元素的质量比。
H2O
CO2
NH4NO3
CO(NH2)2 m(H) : m(O) =(1× 2) :16 = 1 : 8m(C) : m(O) = 12 :(16 × 2) = 3 : 8m(N) : m(H) : m(O) =(14 × 2):(1×4 ): (16 ×3)
= 7 : 1 : 12 m(C) : m(O) : m(N) : m(H)
= 12 : 16 : (14×2) : (1×4)
= 3 : 4 : 7 : 13.计算物质中某元素的质量分数 [例题3]:(1)计算氮肥NH4NO3中氮元素的质量分数。
(2)若测得某种NH4NO3的含氮量为18%,判断该物质是否纯净? NH4NO3中氮元素的质量分数:NH4NO3的相对分子质量N的相对原子质量×N的原子数8014 ×2 ×100%×100%=35%解:=(1)NH4NO3的相对分子质量 =14+1×4 + 14+ 16×3
=80=因为18%<35%, 所以该物质不纯净.答:略4.计算物质中某元素的质量[例题4]: 60 Kg NH4NO3中含氮元素多少Kg ? [例题5]:某化合物的化学式为RO2 ,其中氧元素的质量分数为50%,求R的相对原子质量并确定R为何种元素?5.综合应用 8014 ×2 ×100% = 60Kg× 35% = 21 Kg解:60Kg ×答:略NH4NO3的相对分子质量 =14+1×4 + 14+ 16×3
=80m(N)=1.右图是某厂生产的葡萄糖酸锌口服液的标签,每
支口服液含葡萄糖酸锌45.5mg,标签中____上的数
据是多少?××牌口服液
主要成份:葡萄糖酸锌
化学式:C12H22O14Zn
含锌量:每支口服液
含锌_____mg
××制药厂解:葡萄糖酸锌的相对分子质量=
12×12+1×22+16×14+65=455
葡萄糖酸锌中含锌的质量=
45.5mg×14.3%=6.5mg课堂练习2,鱼油中富含的DHA( C22H32O2 )是大脑细胞形成和发育不可
缺少的物质,K下列关于DHA的叙述中不正确的是( )
A DHA由三种元素组成, B DHA是氧化物
C DHA 中碳.氢.氧元素的质量比为33:4:4
D. DHA中氢元素的质量分数最大B D3,丁酸丁酯(C6H12O2)是一种无色无味的液体,下列叙述中.正确的是( )
A.丁酸丁酯是由20个原子构成,
B.丁酸丁酯的相对原子质量为116g
C.丁酸丁酯中C.H.O元素的质量比为3:6:1
D.丁酸丁酯中C.H.O元素的质量比为18:3:8D4,味精是常用的调味品,它的主要成分是“谷氨酸钠”,它的化学式为(C6H8NO4Na)。某市生产的味精包装上标注:每包净重10g,谷氨酸钠含量≧85%。问:
(1)谷氨酸钠中含有________种元素。
(2)谷氨酸钠的相对分子质量为_______。
(3)每一包味精最少含有多少克钠元素(计算结果精确到小数点后一 位)?5181解:每包味精至少含谷氨酸钠为10×85%=8.5(g)
m(Na)=8.5×Na%=8.5×23181×100%=1.1g。 注意:
元素的质量一定是纯净物的质量×元素的质量分数经分析某硝酸铵样品中,氮元素的质量分数为38%,这种
氮肥中可能混入的杂质是( )
A NH4HCO3 B NH4Cl
C CO(NH2)2 D ( NH4)2SO4解: NH4NO3中N%=35%
经计算,
NH4Cl 中 N% = 21.2%
NH4HCO3中 N% = 17.7%
( NH4)2SO4中 N% = 29.2% 均<35%
CO(NH2)2中 N% = 46.7%>38%
所以杂质中N%>38% 选C 变式题1. 求49克硫酸中含硫的质量2: 多少克碳酸氢铵(NH4HCO3)与40g
硝酸铵(NH4NO3)含氮元素质量相等?公式巩固练习3,丙氨酸是一种氨基酸,其相对分子质量89,其中
氮元素的质量分数为15.8%,则每个丙氨酸分子中含
氮原子的个数为 ( )
A 4 B 3 C 2 D 1
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
