第四章第一节 开发利用金属矿物和海水资源 同步练习(带解析)
文档属性
| 名称 | 第四章第一节 开发利用金属矿物和海水资源 同步练习(带解析) |
|
|
| 格式 | doc | ||
| 文件大小 | 760.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-08-07 00:00:00 | ||
图片预览




文档简介
21世纪教育网 –中小学教育资源及组卷应用平台
第一节 开发利用金属矿物和海水资源 同步练习(带解析)
【基础演练】
1.下列从海水中提取镁的工艺流程中,你认为最合理的是
A. 海水 ( http: / / www.21cnjy.com )Mg(OH)2 ( http: / / www.21cnjy.com )Mg
B. 海水 ( http: / / www.21cnjy.com )Mg(OH)2 ( http: / / www.21cnjy.com )MgCl2 ( http: / / www.21cnjy.com )Mg
C. 海水 ( http: / / www.21cnjy.com )MgCl2 ( http: / / www.21cnjy.com )Mg
D. 海水 ( http: / / www.21cnjy.com )MgCl2 ( http: / / www.21cnjy.com )Mg
2.下列冶炼金属的原理中,属于热还原法的是
A. 2Ag2O ( http: / / www.21cnjy.com )4Ag+O2↑
B. Fe 2O3+3CO2Fe+3CO2
C. Fe+CuSO4= FeSO4+Cu
D. MgCl2 ( http: / / www.21cnjy.com )Mg+Cl2↑
3.海带提碘实验中,不会用到的装置是( )
( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
A. B. C. D.
4.下列反应原理中,不符合工业冶炼金属实际情况的是( )
A. 2Ag2O ( http: / / www.21cnjy.com )4Ag+O2↑
B. 2Al2O3(熔融) ( http: / / www.21cnjy.com )4Al+3O2↑
C. 2MgO ( http: / / www.21cnjy.com )2Mg+O2↑
D. 4CO+Fe3O4 ( http: / / www.21cnjy.com )3Fe+4CO2
5.下列防止金属制品生锈的可行性方法是:
①油漆 ②电镀 ③涂油脂或包裹塑料
A. 只有①② B. 只有②③ C. 只有①③ D. ①②③
6.下列实验设计方案中,可行的是
A. 用蒸馏法将海水淡化
B. 用稀硝酸除去混在铜粉中的少量镁粉和铝粉
C. 用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物
D. 除去CuCl2溶液中少量的FeCl3,加入足量铁屑,充分反应后,过滤
7.利用金属的活泼性不同,冶炼镁、铁、汞分别应采用的方法是
A. 热还原法、热分解法、电解法
B. 电解法、热还原法、热分解法
C. 热分解法、热还原法、电解法
D. 电解法、热分解法、热还原法
8.海水中有取之不尽的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图:21cnjy.com
( http: / / www.21cnjy.com )
试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是:____,还需要的玻璃仪器有:____。21·cn·jy·com
(2)粗盐中含有Ca2+、 Mg2+、 ( http: / / www.21cnjy.com )SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2C03溶液,则添加试剂顺序为____(填写序号),最后在滤液加入盐酸至溶液呈中性。请写出加入盐酸后可能发生反应的离子方程式:____。2·1·c·n·j·y
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式:____。21·世纪*教育网
(4)电解无水氯化镁制取镁的化学方程式为____。将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由:____。www-2-1-cnjy-com
9.目前,世界上生产的镁有60%来自海水,其生产流程图如下
( http: / / www.21cnjy.com )(1)贝壳的主要化学成分为________________(写化学式).
(2)写出反应②的离子方程式:_____________.
(3)根据流程图可知,可循环利用的物质是________________.
(4)Mg与CO2反应时,有白色粉末并有黑 ( http: / / www.21cnjy.com )色固体生成.请写出Mg与CO2反应的化学方程式,并用单线桥标出电子转移的方向与数目.____________________________.
(5)Na比Mg和Al要活泼.将Na投入到 ( http: / / www.21cnjy.com )Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为____________________________.【来源:21cnj*y.co*m】
【综合提升】
1.如图为海水综合利用的部分模拟过程。
( http: / / www.21cnjy.com )
下列有关说法正确的是
A. ① 中加入试剂顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液
B. 过程②为电解熔融精盐
C. 工业上过程③加入的试剂为浓NaOH溶液
D. 第④步反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl-
2.海水资源的利用具有非常广阔的前景。下列关于海水资源利用的说法中不正确的是( )
A. 电解法分解海水,制取洁净的热能资源氢气
B. 采用太阳光照射法晒制工业用食盐
C. 针对能量现状,大力开发潮汐能和波浪能
D. 铀是海水中的微量元素,但核工业的铀主要从海水中提取
3.下列说法正确的是 ( )
A. 氯水和二氧化硫都具有漂白作用,两者漂白原理相同
B. 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等,途径a:Cu ( http: / / www.21cnjy.com )CuO ( http: / / www.21cnjy.com )CuSO4; 途径b:Cu ( http: / / www.21cnjy.com )CuSO421*cnjy*com
C. 不用其它化学试剂只用适当仪器就可以区别Na2CO3溶液和稀硫酸
D. 从海水中提取物质都必须通过化学反应才能实现
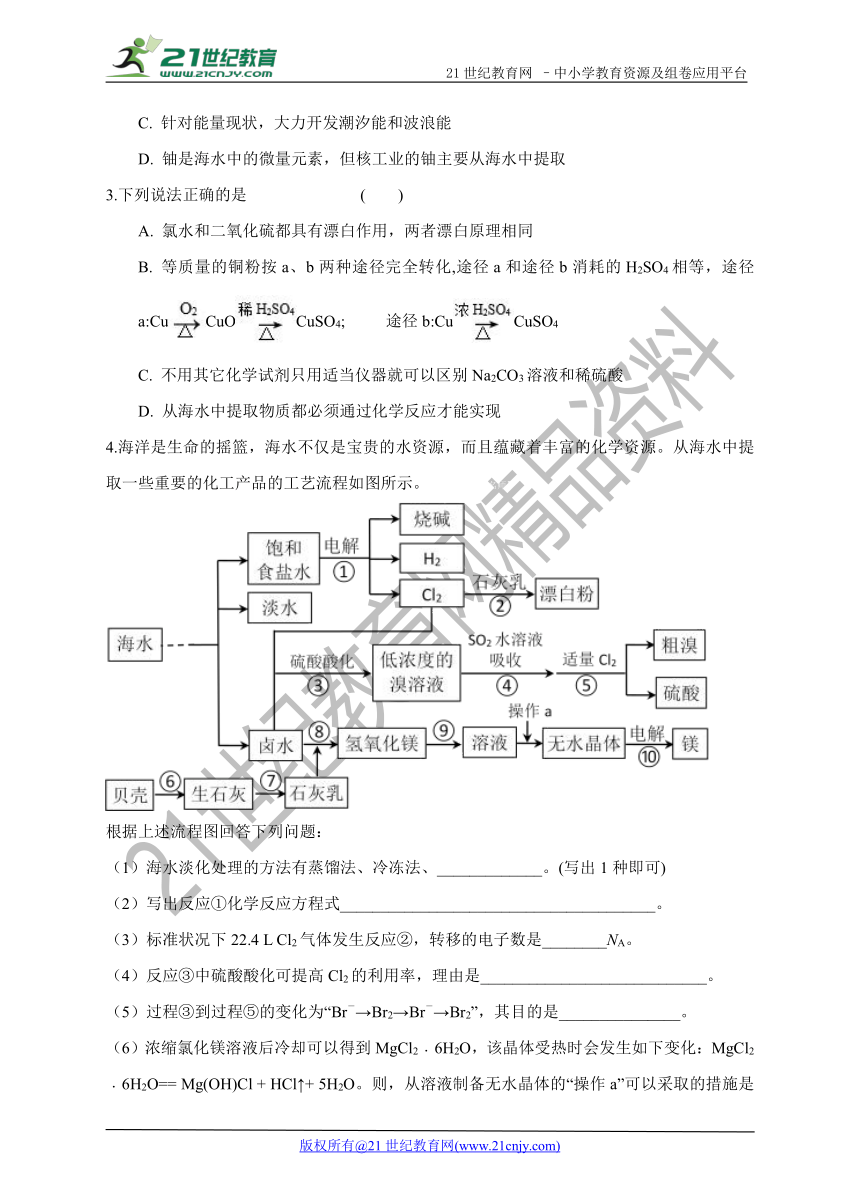
4.海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从海水中提取一些重要的化工产品的工艺流程如图所示。【出处:21教育名师】
( http: / / www.21cnjy.com )
根据上述流程图回答下列问题:
(1)海水淡化处理的方法有蒸馏法、冷冻法、_____________。(写出1种即可)
(2)写出反应①化学反应方程式_______________________________________。
(3)标准状况下22.4 L Cl2气体发生反应②,转移的电子数是________NA。
(4)反应③中硫酸酸化可提高Cl2的利用率,理由是____________________________。
(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是_______________。
(6)浓缩氯化镁溶液后冷却 ( http: / / www.21cnjy.com )可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是__________________________________________。【版权所有:21教育】
参考答案及解析
【基础演练】
1.B
【解析】海水中含有镁离子,要想从海水中 ( http: / / www.21cnjy.com )提取镁,首先要将镁离子转化为难溶性的氢氧化镁,所以向海水中加入碱,且加入的碱要廉价,所以可以选取熟石灰制取氢氧化镁;镁是活泼金属,所以工业上用电解熔融氯化镁或氧化镁的方法冶炼,但氧化镁熔点较高,电解时浪费热能,所以一般采用电解熔融氯化镁的方法冶炼,氢氧化镁和盐酸反应生成氯化镁,氯化镁溶液在氯化氢氛围中制取无水氯化镁,然后采用电解熔融氯化镁的方法冶炼镁,只有B选项正确;答案选B。21世纪教育网版权所有
2.B
【解析】A.冶炼银采用热分解法,所以该方法为热分解法,故A错误;
B.冶炼铁采用热氧化还原反应法,故B正确;
C.该反应属于湿法冶炼铜,故C错误;
D.冶炼镁等活泼金属采用电解法冶炼,所以该方法属于电解法,故D错误;故选B。
3.D
【解析】A.灼烧海带用到A装置,故A不选;
B.过滤灼烧后的海带灰的浸取液用到B装置,故B不选;
C.分离碘的有机层与水层用到C装置,故C不选;
D. 海带提碘实验中无需水浴加热,故D选;故选D。
4.C
【解析】金属冶炼常用电解法、热还原法、热分解法,K~Al常用电解法冶炼,Zn~Cu常用热还原法冶炼,Cu以后的金属常用热分解法冶炼,21教育名师原创作品
A、冶炼银,常用氧化银的分解,符合实际,故A错误;
B、电解氧化铝冶炼铝单质,符合实际,故B错误;
C、工业常电解氯化镁冶炼镁,因为氧化镁的熔点高,熔化时需要消耗大量的能量, 因此电解氧化镁冶炼金属镁,不符合实际,故C正确;
D、冶炼铁,用热还原法,符合实际,故D错误。
5.D
【解析】①油漆 ②电镀 ③涂油脂或包裹塑料,均能使铁与水或氧气隔绝,能起到防锈的作用,所以①②③都能防止金属制品生锈;故选D。
6.A
【解析】A、水与盐类化合物沸点差别大,则可用蒸馏法将海水淡化,故A正确;
B、Cu、Mg、Al均与稀硝酸反应,不能除杂,应选择稀盐酸或稀硫酸除去混在铜粉中的少量镁粉和铝粉,故B错误;
C、硝酸钾和氯化钠均溶于水,过滤不能分离,应采取冷却热饱和溶液的方法分离,故C错误;
D、Fe3+ 水解产生H+ ,加入 ( http: / / www.21cnjy.com )CuO可以使平衡不断正移产生Fe(OH)3沉淀,同时不引入新的杂质,加Fe,Fe+Cu2+=Fe2++Cu,故D错误;故选A。
7.B
【解析】根据金属活动性顺序表,金属 ( http: / / www.21cnjy.com )的冶炼方法可以分为:K、Ca、Na、Mg、Al的冶炼用电解法(电解熔融的化合物);Zn、Fe、Sn、Pb、Cu的冶炼用热还原法;Ag、Hg的冶炼用热分解法,从而可知,冶炼镁用的是电解熔融的氯化镁的方法,冶炼铁用的是热还原法,冶炼汞用的是热分解法,故选B。
8. 引流,使待滤液体沿玻璃棒流入漏斗 ( http: / / www.21cnjy.com )烧杯、漏斗 ①②③或②①③ OH-+H+===H2O、CO32-+2H+===CO2↑+H2O Ca(OH)2+Mg2+==Mg(OH)2+Ca2+ MgCl2(熔融)Mg+Cl2↑ 避免Mg被空气中的氧气氧化
【解析】(1)过滤的操作需用到玻璃棒,玻璃棒的作用是引流,使待滤液体沿玻璃棒流入漏斗,还需要的玻璃仪器有烧杯、漏斗;
(2)Ca2+用碳酸钠除去 ( http: / / www.21cnjy.com ),Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此实验过程中添加试剂的顺序是①②③或②①③;根据以上分析可知加入盐酸后可能发生反应的离子方程式为OH-+H+=H2O、CO32-+2H+=CO2↑+H2O;
(3)母液中有K+、Na ( http: / / www.21cnjy.com )+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2,离子方程式为Ca(OH)2+Mg2+=Mg(OH)2+Ca2+;【来源:21·世纪·教育·网】
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化因此镁蒸气需在Ar气氛围中冷却。
9. CaCO3 Mg(OH)2+2H+═Mg2++2H2O 盐酸或者氯气
( http: / / www.21cnjy.com )
6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑
【解析】流程分析:海水晒盐得到的卤水中 ( http: / / www.21cnjy.com )加入煅烧贝壳得到的氧化钙溶于水生成的氢氧化钙石灰乳,用来沉淀镁离子,过滤得到氢氧化镁加入盐酸溶解富集镁元素得到氯化镁,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中脱水得到固体氯化镁,电解熔融氯化镁得到镁和氯气;
(1)贝壳的主要成分是碳酸钙,其化学式为CaCO3;
(2)氢氧化镁和稀盐酸发生复分解反应生成氯化镁和水,离子反应方程式为:Mg(OH)2+2H+═Mg2++2H2O;
(3)根据流程图中可以知道盐酸或转化盐酸的氯气既是反应的原料同时也是反应的副产物,可以循环利用;
(4)镁在二氧化碳中燃烧生成氧化镁和碳,该反应中Mg元素化合价由0价变为+2价、C元素化合价由+4价变为0价,转移电子数为4,用单线桥标出电子转移的方向与数目为: ( http: / / www.21cnjy.com );
(5)Na比Mg和Al要活泼.将Na投 ( http: / / www.21cnjy.com )入到Fe2(SO4)3溶液中先钠和水反应,2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠与铁离子反应,总反应为:
6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑。
【综合提升】
1.D
【解析】A、除杂不引杂,引入的杂质还要除去,所以碳酸钠应放在氯化钡的后面把多余的钡离子除去,选项A错误;21教育网
B、过程②为电解精盐溶液,选项B错误;
C、考虑经济效益,工业上过程③加入的试剂为石灰乳,选项C错误;
D、第④步溴离子被氧化生成溴单质,反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl-,选项D正确。答案选D。2-1-c-n-j-y
2.A
【解析】电解法分解海水制取氢气,消耗大量的电能,经济效益差,故A错误;
利用海水晒制食盐,故B正确;
大力开发潮汐能和波浪能,可以节约化石燃料,故C正确;
海水中含有铀元素,核工业的铀主要从海水中提取,故D正确。
3.C
【解析】A、氯水和二氧化硫都具有漂 ( http: / / www.21cnjy.com )白作用,但两者漂白原理不相同,氯气漂白原理:强氧化性漂白,二氧化硫漂白原理:和有色物质生成不稳定的无色物质而漂白,选项A错误;
B、假设铜均为1mol,a途径中CuO完全反应消耗1mol稀硫酸,b途径中铜完全反应消耗2mol浓硫酸,选项B错误;www.21-cn-jy.com
C、Na2CO3溶液逐滴滴入稀硫酸中,立 ( http: / / www.21cnjy.com )刻有气泡产生,稀硫酸逐滴滴入Na2CO3溶液中,开始时无气泡产生,故可用互滴来区别两溶液,选项C正确;21*cnjy*com
D、从海水中提取蒸馏水和盐时,通过蒸馏、蒸发等物理变化就能实现,选项D错误。答案选C。
4. 离子交换膜法(也可写成电渗析法或反渗析法)
2NaCl+2H2O ( http: / / www.21cnjy.com )2NaOH+H2↑+Cl2↑ 1
酸化可抑制氯气、溴与水反应 富集溴 将MgCl2溶液在HCl气流中蒸干
【解析】(1)海水淡化处理的方法有蒸馏法、冷冻法、离子交换膜法、电渗析法或反渗析法等;
(2)反应①是电解饱和食盐水生成氢氧化钠、氢气和氯气,其反应化学反应方程式为:2NaCl+2H2O ( http: / / www.21cnjy.com )2NaOH+H2↑+Cl2↑;
(3)标准状况下22.4 L Cl2 ( http: / / www.21cnjy.com )气体发生反应②:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,转移的电子数是NA;
(4)反应③中硫酸酸化,抑制氯气、溴与水反应,可提高Cl2的利用率;
(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是:富集溴;
(6)浓缩氯化镁溶液后冷却可以得到Mg ( http: / / www.21cnjy.com )Cl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是:将MgCl2溶液在HCl气流中蒸干,避免氯化镁水解而得不到无水晶体。
( http: / / www.21cnjy.com )
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://www.21cnjy.com/" 版权所有@21世纪教育网(www.21cnjy.com)
第一节 开发利用金属矿物和海水资源 同步练习(带解析)
【基础演练】
1.下列从海水中提取镁的工艺流程中,你认为最合理的是
A. 海水 ( http: / / www.21cnjy.com )Mg(OH)2 ( http: / / www.21cnjy.com )Mg
B. 海水 ( http: / / www.21cnjy.com )Mg(OH)2 ( http: / / www.21cnjy.com )MgCl2 ( http: / / www.21cnjy.com )Mg
C. 海水 ( http: / / www.21cnjy.com )MgCl2 ( http: / / www.21cnjy.com )Mg
D. 海水 ( http: / / www.21cnjy.com )MgCl2 ( http: / / www.21cnjy.com )Mg
2.下列冶炼金属的原理中,属于热还原法的是
A. 2Ag2O ( http: / / www.21cnjy.com )4Ag+O2↑
B. Fe 2O3+3CO2Fe+3CO2
C. Fe+CuSO4= FeSO4+Cu
D. MgCl2 ( http: / / www.21cnjy.com )Mg+Cl2↑
3.海带提碘实验中,不会用到的装置是( )
( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
A. B. C. D.
4.下列反应原理中,不符合工业冶炼金属实际情况的是( )
A. 2Ag2O ( http: / / www.21cnjy.com )4Ag+O2↑
B. 2Al2O3(熔融) ( http: / / www.21cnjy.com )4Al+3O2↑
C. 2MgO ( http: / / www.21cnjy.com )2Mg+O2↑
D. 4CO+Fe3O4 ( http: / / www.21cnjy.com )3Fe+4CO2
5.下列防止金属制品生锈的可行性方法是:
①油漆 ②电镀 ③涂油脂或包裹塑料
A. 只有①② B. 只有②③ C. 只有①③ D. ①②③
6.下列实验设计方案中,可行的是
A. 用蒸馏法将海水淡化
B. 用稀硝酸除去混在铜粉中的少量镁粉和铝粉
C. 用溶解、过滤的方法分离硝酸钾和氯化钠固体的混合物
D. 除去CuCl2溶液中少量的FeCl3,加入足量铁屑,充分反应后,过滤
7.利用金属的活泼性不同,冶炼镁、铁、汞分别应采用的方法是
A. 热还原法、热分解法、电解法
B. 电解法、热还原法、热分解法
C. 热分解法、热还原法、电解法
D. 电解法、热分解法、热还原法
8.海水中有取之不尽的化学资源,从海水中可提取多种化工原料,下图是某化工厂对海水资源综合利用的示意图:21cnjy.com
( http: / / www.21cnjy.com )
试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是:____,还需要的玻璃仪器有:____。21·cn·jy·com
(2)粗盐中含有Ca2+、 Mg2+、 ( http: / / www.21cnjy.com )SO42-等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2C03溶液,则添加试剂顺序为____(填写序号),最后在滤液加入盐酸至溶液呈中性。请写出加入盐酸后可能发生反应的离子方程式:____。2·1·c·n·j·y
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式:____。21·世纪*教育网
(4)电解无水氯化镁制取镁的化学方程式为____。将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由:____。www-2-1-cnjy-com
9.目前,世界上生产的镁有60%来自海水,其生产流程图如下
( http: / / www.21cnjy.com )(1)贝壳的主要化学成分为________________(写化学式).
(2)写出反应②的离子方程式:_____________.
(3)根据流程图可知,可循环利用的物质是________________.
(4)Mg与CO2反应时,有白色粉末并有黑 ( http: / / www.21cnjy.com )色固体生成.请写出Mg与CO2反应的化学方程式,并用单线桥标出电子转移的方向与数目.____________________________.
(5)Na比Mg和Al要活泼.将Na投入到 ( http: / / www.21cnjy.com )Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为____________________________.【来源:21cnj*y.co*m】
【综合提升】
1.如图为海水综合利用的部分模拟过程。
( http: / / www.21cnjy.com )
下列有关说法正确的是
A. ① 中加入试剂顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液
B. 过程②为电解熔融精盐
C. 工业上过程③加入的试剂为浓NaOH溶液
D. 第④步反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl-
2.海水资源的利用具有非常广阔的前景。下列关于海水资源利用的说法中不正确的是( )
A. 电解法分解海水,制取洁净的热能资源氢气
B. 采用太阳光照射法晒制工业用食盐
C. 针对能量现状,大力开发潮汐能和波浪能
D. 铀是海水中的微量元素,但核工业的铀主要从海水中提取
3.下列说法正确的是 ( )
A. 氯水和二氧化硫都具有漂白作用,两者漂白原理相同
B. 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等,途径a:Cu ( http: / / www.21cnjy.com )CuO ( http: / / www.21cnjy.com )CuSO4; 途径b:Cu ( http: / / www.21cnjy.com )CuSO421*cnjy*com
C. 不用其它化学试剂只用适当仪器就可以区别Na2CO3溶液和稀硫酸
D. 从海水中提取物质都必须通过化学反应才能实现
4.海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从海水中提取一些重要的化工产品的工艺流程如图所示。【出处:21教育名师】
( http: / / www.21cnjy.com )
根据上述流程图回答下列问题:
(1)海水淡化处理的方法有蒸馏法、冷冻法、_____________。(写出1种即可)
(2)写出反应①化学反应方程式_______________________________________。
(3)标准状况下22.4 L Cl2气体发生反应②,转移的电子数是________NA。
(4)反应③中硫酸酸化可提高Cl2的利用率,理由是____________________________。
(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是_______________。
(6)浓缩氯化镁溶液后冷却 ( http: / / www.21cnjy.com )可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是__________________________________________。【版权所有:21教育】
参考答案及解析
【基础演练】
1.B
【解析】海水中含有镁离子,要想从海水中 ( http: / / www.21cnjy.com )提取镁,首先要将镁离子转化为难溶性的氢氧化镁,所以向海水中加入碱,且加入的碱要廉价,所以可以选取熟石灰制取氢氧化镁;镁是活泼金属,所以工业上用电解熔融氯化镁或氧化镁的方法冶炼,但氧化镁熔点较高,电解时浪费热能,所以一般采用电解熔融氯化镁的方法冶炼,氢氧化镁和盐酸反应生成氯化镁,氯化镁溶液在氯化氢氛围中制取无水氯化镁,然后采用电解熔融氯化镁的方法冶炼镁,只有B选项正确;答案选B。21世纪教育网版权所有
2.B
【解析】A.冶炼银采用热分解法,所以该方法为热分解法,故A错误;
B.冶炼铁采用热氧化还原反应法,故B正确;
C.该反应属于湿法冶炼铜,故C错误;
D.冶炼镁等活泼金属采用电解法冶炼,所以该方法属于电解法,故D错误;故选B。
3.D
【解析】A.灼烧海带用到A装置,故A不选;
B.过滤灼烧后的海带灰的浸取液用到B装置,故B不选;
C.分离碘的有机层与水层用到C装置,故C不选;
D. 海带提碘实验中无需水浴加热,故D选;故选D。
4.C
【解析】金属冶炼常用电解法、热还原法、热分解法,K~Al常用电解法冶炼,Zn~Cu常用热还原法冶炼,Cu以后的金属常用热分解法冶炼,21教育名师原创作品
A、冶炼银,常用氧化银的分解,符合实际,故A错误;
B、电解氧化铝冶炼铝单质,符合实际,故B错误;
C、工业常电解氯化镁冶炼镁,因为氧化镁的熔点高,熔化时需要消耗大量的能量, 因此电解氧化镁冶炼金属镁,不符合实际,故C正确;
D、冶炼铁,用热还原法,符合实际,故D错误。
5.D
【解析】①油漆 ②电镀 ③涂油脂或包裹塑料,均能使铁与水或氧气隔绝,能起到防锈的作用,所以①②③都能防止金属制品生锈;故选D。
6.A
【解析】A、水与盐类化合物沸点差别大,则可用蒸馏法将海水淡化,故A正确;
B、Cu、Mg、Al均与稀硝酸反应,不能除杂,应选择稀盐酸或稀硫酸除去混在铜粉中的少量镁粉和铝粉,故B错误;
C、硝酸钾和氯化钠均溶于水,过滤不能分离,应采取冷却热饱和溶液的方法分离,故C错误;
D、Fe3+ 水解产生H+ ,加入 ( http: / / www.21cnjy.com )CuO可以使平衡不断正移产生Fe(OH)3沉淀,同时不引入新的杂质,加Fe,Fe+Cu2+=Fe2++Cu,故D错误;故选A。
7.B
【解析】根据金属活动性顺序表,金属 ( http: / / www.21cnjy.com )的冶炼方法可以分为:K、Ca、Na、Mg、Al的冶炼用电解法(电解熔融的化合物);Zn、Fe、Sn、Pb、Cu的冶炼用热还原法;Ag、Hg的冶炼用热分解法,从而可知,冶炼镁用的是电解熔融的氯化镁的方法,冶炼铁用的是热还原法,冶炼汞用的是热分解法,故选B。
8. 引流,使待滤液体沿玻璃棒流入漏斗 ( http: / / www.21cnjy.com )烧杯、漏斗 ①②③或②①③ OH-+H+===H2O、CO32-+2H+===CO2↑+H2O Ca(OH)2+Mg2+==Mg(OH)2+Ca2+ MgCl2(熔融)Mg+Cl2↑ 避免Mg被空气中的氧气氧化
【解析】(1)过滤的操作需用到玻璃棒,玻璃棒的作用是引流,使待滤液体沿玻璃棒流入漏斗,还需要的玻璃仪器有烧杯、漏斗;
(2)Ca2+用碳酸钠除去 ( http: / / www.21cnjy.com ),Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此实验过程中添加试剂的顺序是①②③或②①③;根据以上分析可知加入盐酸后可能发生反应的离子方程式为OH-+H+=H2O、CO32-+2H+=CO2↑+H2O;
(3)母液中有K+、Na ( http: / / www.21cnjy.com )+、Mg2+等阳离子,在母液里加入石灰乳,与镁离子反应,将Mg2+沉淀为Mg(OH)2,离子方程式为Ca(OH)2+Mg2+=Mg(OH)2+Ca2+;【来源:21·世纪·教育·网】
(4)电解无水氯化镁所得的镁蒸气,应避免镁再被氧化因此镁蒸气需在Ar气氛围中冷却。
9. CaCO3 Mg(OH)2+2H+═Mg2++2H2O 盐酸或者氯气
( http: / / www.21cnjy.com )
6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑
【解析】流程分析:海水晒盐得到的卤水中 ( http: / / www.21cnjy.com )加入煅烧贝壳得到的氧化钙溶于水生成的氢氧化钙石灰乳,用来沉淀镁离子,过滤得到氢氧化镁加入盐酸溶解富集镁元素得到氯化镁,蒸发浓缩,冷却结晶得到氯化镁晶体,在氯化氢气流中脱水得到固体氯化镁,电解熔融氯化镁得到镁和氯气;
(1)贝壳的主要成分是碳酸钙,其化学式为CaCO3;
(2)氢氧化镁和稀盐酸发生复分解反应生成氯化镁和水,离子反应方程式为:Mg(OH)2+2H+═Mg2++2H2O;
(3)根据流程图中可以知道盐酸或转化盐酸的氯气既是反应的原料同时也是反应的副产物,可以循环利用;
(4)镁在二氧化碳中燃烧生成氧化镁和碳,该反应中Mg元素化合价由0价变为+2价、C元素化合价由+4价变为0价,转移电子数为4,用单线桥标出电子转移的方向与数目为: ( http: / / www.21cnjy.com );
(5)Na比Mg和Al要活泼.将Na投 ( http: / / www.21cnjy.com )入到Fe2(SO4)3溶液中先钠和水反应,2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠与铁离子反应,总反应为:
6Na+6H2O+2Fe3+=2Fe(OH)3↓+6Na++3H2↑。
【综合提升】
1.D
【解析】A、除杂不引杂,引入的杂质还要除去,所以碳酸钠应放在氯化钡的后面把多余的钡离子除去,选项A错误;21教育网
B、过程②为电解精盐溶液,选项B错误;
C、考虑经济效益,工业上过程③加入的试剂为石灰乳,选项C错误;
D、第④步溴离子被氧化生成溴单质,反应的离子方程式可表示为:2Br-+Cl2=Br2+2Cl-,选项D正确。答案选D。2-1-c-n-j-y
2.A
【解析】电解法分解海水制取氢气,消耗大量的电能,经济效益差,故A错误;
利用海水晒制食盐,故B正确;
大力开发潮汐能和波浪能,可以节约化石燃料,故C正确;
海水中含有铀元素,核工业的铀主要从海水中提取,故D正确。
3.C
【解析】A、氯水和二氧化硫都具有漂 ( http: / / www.21cnjy.com )白作用,但两者漂白原理不相同,氯气漂白原理:强氧化性漂白,二氧化硫漂白原理:和有色物质生成不稳定的无色物质而漂白,选项A错误;
B、假设铜均为1mol,a途径中CuO完全反应消耗1mol稀硫酸,b途径中铜完全反应消耗2mol浓硫酸,选项B错误;www.21-cn-jy.com
C、Na2CO3溶液逐滴滴入稀硫酸中,立 ( http: / / www.21cnjy.com )刻有气泡产生,稀硫酸逐滴滴入Na2CO3溶液中,开始时无气泡产生,故可用互滴来区别两溶液,选项C正确;21*cnjy*com
D、从海水中提取蒸馏水和盐时,通过蒸馏、蒸发等物理变化就能实现,选项D错误。答案选C。
4. 离子交换膜法(也可写成电渗析法或反渗析法)
2NaCl+2H2O ( http: / / www.21cnjy.com )2NaOH+H2↑+Cl2↑ 1
酸化可抑制氯气、溴与水反应 富集溴 将MgCl2溶液在HCl气流中蒸干
【解析】(1)海水淡化处理的方法有蒸馏法、冷冻法、离子交换膜法、电渗析法或反渗析法等;
(2)反应①是电解饱和食盐水生成氢氧化钠、氢气和氯气,其反应化学反应方程式为:2NaCl+2H2O ( http: / / www.21cnjy.com )2NaOH+H2↑+Cl2↑;
(3)标准状况下22.4 L Cl2 ( http: / / www.21cnjy.com )气体发生反应②:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,转移的电子数是NA;
(4)反应③中硫酸酸化,抑制氯气、溴与水反应,可提高Cl2的利用率;
(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是:富集溴;
(6)浓缩氯化镁溶液后冷却可以得到Mg ( http: / / www.21cnjy.com )Cl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是:将MgCl2溶液在HCl气流中蒸干,避免氯化镁水解而得不到无水晶体。
( http: / / www.21cnjy.com )
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://www.21cnjy.com/" 版权所有@21世纪教育网(www.21cnjy.com)
