浙教版初中科学2017年中考真题分类专题汇编物质的结构
文档属性
| 名称 | 浙教版初中科学2017年中考真题分类专题汇编物质的结构 |

|
|
| 格式 | zip | ||
| 文件大小 | 276.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2017-08-23 00:00:00 | ||
图片预览




文档简介
2017年浙江中考真题分类汇编(科学)专题:物质的结构
一、单选题
1、(2017·台州)如图是微信热传的“苯宝宝表情包”,苯(化学式为C6H6)是一种重要的化工原料。下列有关苯的说法正确的是(
)
A、苯属于无机化合物
B、苯由6个碳原子和6个氢原子构成
C、苯由碳、氢两种元素组成
D、苯中碳、氢两种元素的质量比为1:1
2、(2017·台州)垃圾分一分,环境美十分。投放铝制易拉罐的垃圾箱应贴以下哪个标识?(
)
A、可回收物
B、厨余垃圾
C、有害垃圾
D、其他垃圾
3、(2017 杭州)2017年5月,中科院、国家语委和全国科技名词委正式定名118号元素为
,其部分信息如图所示。则下列有关
的说法正确的是(
)
A、元素符号为Og
B、相对原子质量为118
C、原子的核电荷数为179
D、原子的核外电子数为297
4、(2017 温州)构成人体骨骼和牙齿的无机盐称为骨盐,其中含有氟化钙(CaF2)。氟化钙中氟(F)元素的化合价为(
)
A、 2
B、 1
C、+1
D、+2
5、(2017 温州)5月9日,相关机构发布
等四种元素的中文名称。元素的核电荷数为118,相对原子质量为294,则
原子核外电子数为(
)
A、118
B、176
C、294
D、412
6、(2017 嘉兴)谷氨酸钠(化学式为
C5H8O4NNa)是味精的主要成分。下列关于谷氨酸钠的说法错误的是(
)
A、是一种有机物
B、加热会产生含硫物质
C、由五种元素组成
D、碳、氢原子个数之比为
5∶8
7、(2017 嘉兴)今年5月9日,由中国科学院等相关部门正式发布了113
号、115号、117
号、118号元素的中文名称。下表是这四种元素的部分信息,以下有关说法正确的是(
)
A、属于金属元素
B、镆的元素符号是mo
C、元素的相对原子质量是117
D、元素在自然界中含量丰富
8、(2017 湖州)化肥为缓解地球上有限的耕地资源与庞大的粮食需求之间的矛盾做出了巨大的贡献。但在化肥生产和使用中,也伴随着能源耗费和环境污染等问题。因此,生物固氮作用的研究日益受到各国政府的重视。大气中的N2转化为NH3的过程叫做固氮作用。固氮作用的途径有三条:生物固氮、雷电固氮和人工固氮。
请回答:
(1)固氮生物大多属于细菌,细菌属于________(选
填“真核生物”或“原核生物”)。
(2)资料显示一公顷林地平均每年固定氮元素的质量约为100千克。这些氮元素如果从NH4NO3中获得,则需要施加多少千克NH4NO3?(精确到0.1千克)
9、(2017·宁波)如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
A、该化学反应属于化合反应
B、甲和乙属于单质,丙属于化合物
C、参加反应的甲与乙的分子个数比为1:1
D、1个丙分子由1个甲分子和2个乙分子构成
10、(2017 杭州)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示
(其中表示不同离子)。则下列说法正确的是(
)
A、表示氯离子
B、表示钠离子
C、可用适量硝酸银溶液和足量稀硝酸进行检验
D、此反应的实质是
结合成水分子
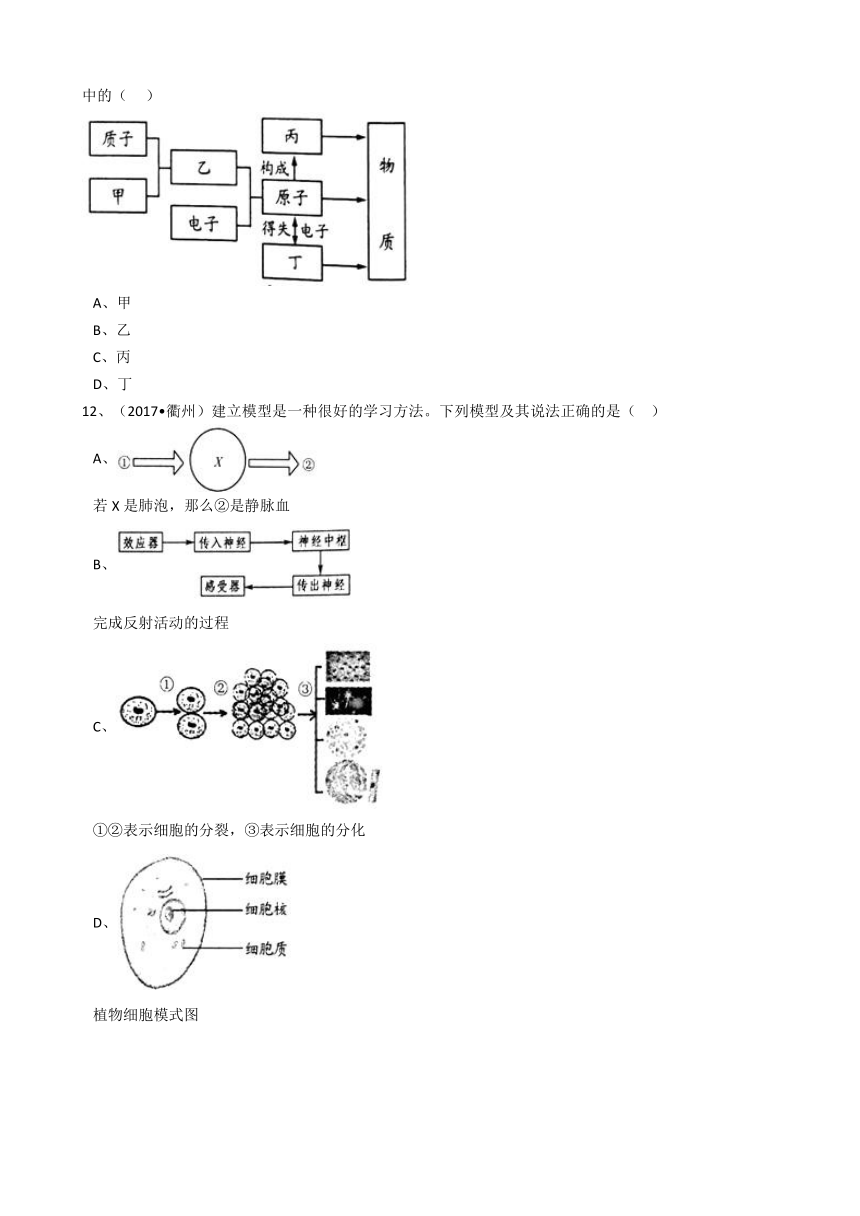
11、(2017 衢州)1897年,英国科学家汤姆生发现了原子内有带负电的电子,而原子
是电中性的,由此推测,原子内还有带正电的物质。在此基础上,经过卢瑟福、玻尔等科学家的不断完善和修正,建立了现代原子结构模型。如图是小柯整理的物质微观构成网络图,则汤姆生当年推测的“带正电的物质”相当于图中的(
)
A、甲
B、乙
C、丙
D、丁
12、(2017 衢州)建立模型是一种很好的学习方法。下列模型及其说法正确的是(
)
A、
若X是肺泡,那么②是静脉血
B、
完成反射活动的过程
C、
①②表示细胞的分裂,③表示细胞的分化
D、
植物细胞模式图
13、(2017 绍兴)图中字母代表含硫元素的物质,下列判断错误的是(
)
A、物质a在纯氧中燃烧可以生成物质b
B、物质c是二氧化硫
C、物质d中硫元素的化合价为-2价
D、物质d、e和f中一定都含有氢元素
14、(2017 金华)将宏观、微观及化学符号联系在一起是化学学科的特点。在一定条件下,A和B能发生化学反应生成C和D。其微观示意图如图所示,下列相关叙述正确的是(
)
A、从宏观角度看,物质C由两种元素组成,属于混合物
B、从微观角度看,该化学变化中发生根本改变和微粒是原子
C、若D为空气中体积分数最大的气体,则D的微观符号可表示为N2
D、该反应属于基本反应类型中的置换反应,反应前后各元素化合价不变
15、(2017 丽水)科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下。有关该反应的说法正确的是(
)
A、该反应属于化合反应
B、反应前碳元素的化合价为+2价
C、生成物的化学式可用C2H2O表示
D、参加反应的两物质的质量比为1:1
二、填空题
16、(2017 舟山)人们常在可燃建筑材料中添加阻燃剂以防止火灾,三氧化二锑(Sb2O3)、氢氧化镁都是常见的阻燃剂。
(1)Sb2O3中的Sb的化合价________。
(2)氢氧化镁作为阻燃剂,分解时吸收大量的热,从而可以降低________。
17、(2017 温州)据报道,我国已在南海某海域试采可燃冰获得成功。可燃冰分布于深海沉积物或陆域的永久冻土中,主要是由甲烷(CH4)与水在高压低温条件下形成的类冰状结晶物质,可燃烧,所以被称为“可燃冰”。
(1)CH4中C、H元素的质量比为________。
(2)已知在相同条件下,1米3CO和1米3
CH4所含的分子数目相同。CO、CH4燃烧的化学方程式分别为2CO+O2点燃2CO2
,
CH4+2O2点燃CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的CO与CH4
,
消耗氧气较多的是________。
(3)有专家指出,“从实现可燃冰试开采成功到大规模开采之路依然遥远,许多问题有待进一步解决”。下列证据中,支持专家观点的有
(可多选)。
A、可燃冰存在于低温与高压环境,稳定性较差。大规模开采时,稍有不慎,海底沉积物会失去稳定,可能引发海底塌方,甚至导致海啸
B、可燃冰是高效、资源量大的优质能源,开采可燃冰对我国能源生产有重要价值
C、可燃冰埋藏在海面下600~2000米深,虽然存储总量很大,但分布较为分散,目前开采难度大
D、我国已实现可燃冰全流程试采核心技术的重大突破,形成了国际领先的新型试采工艺
E、可燃冰与煤、石油等能源相比,是绿色清洁能源,具有良好的商业开发前景
18、(2017·台州)硫酸铵【化学式为(NH4)2SO4】是一种能促进植物茎、叶生长的氮肥。
(1)硫酸铵中氮元素的化合价为________。
(2)施肥浓度过高,会造成烧苗现象。小柯通过实验发现,质量分数为2%的硫酸铵溶液不会导致植物烧苗。他用50克30%的硫酸铵溶液配制2%的硫酸铵溶液,需要加水________毫升。
19、(2017 湖州)1886年,法国化学家莫瓦桑第一次制得了氟的气态单质,并确定其化学式为F2
,
它几乎可以与所有金属直接化合,且在化合物中氟几乎都呈﹣1价
(1)F元素属于________元素(选填“金属”或“非金属”).
(2)科学家还用Xe(氙气)和PtF6﹣首次合成了含稀有气体元素的化合价XePtF6
,
其中PtF6﹣为带一个单位负电荷的原子团,XePtF6中Pt元素的化合价为________.
20、(2017 湖州)2016年6月,国际纯粹与应用化学联合会宣布,合成化学元素113号(Nh鉨),115号(Mc
镆),117号(Ts
)和118号(Og
)为化学新元素.其中,“115号(Mc
镆)”中115表示原子的________数,Mc表示的微观意义是________.
21、(2017 温州)我省开展“全面剿灭劣V类水”行动。为了治理某河道的水污染,相关部门放置一批太阳能仿生水草,几个月后效果明显。太阳能仿生水草主要由太阳能电池板、小型送风电动机以及若干人造水草等构成(如图)。太阳能电池板为电动机供电,电动机工作,给河水持续提供空气,增加水体中的溶解氧。
(1)电动机工作时,其能量如何转化?________
(2)人造水草中有硝化细菌,当水体溶解氧增加,硝化细菌会快速繁殖。细菌的生殖方式为________生殖。
(3)水体中氮元素含量过高是河道水污染的主要原因之一。人造水草中的硝化细菌能将污水中的含氮化合物最终转化为无污染物质,该过程涉及到的化学反应之一是:
,则X的化学式为________。
22、(2017 嘉兴)小明利用12种元素制作了一张如图所示的“元素钟面”。
(1)钟面上的这些元素之间最根本的区别是________不同。
(2)小明根据钟面上提供的元素,写出了下列三种物质的化学式:O2、H2O和NaNO3
,
其中属于氧化物的是________。
(3)此刻钟面上的时针、分针和秒针分别指向三种不同元素,请写出由这三种元素组成的化合物________。(用化学式表示)
三、解答题
23、(2017·台州)每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。
(1)在白醋中滴加花青素,溶液变________色。
(2)一个花青素分子中共有________个原子。
(3)28.7克花青素中含有多少克碳元素?(请列式计算)
24、(2017 丽水)2017年5月18日,国土资源部发布消息,在南海北部1266米深的神狐海域,中国首次海域“可燃冰”试采成功。
查阅资料发现,古代低等生物遗骸大量沉积,经过漫长的地质年代形成石油及天然气,海底的天然气与水在高压低温条件下形成的类冰状的固体物质即“可燃冰”。“可燃冰”为甲烷的水合物,遇火即可燃烧且热值高,是一种环保、高效的新能源。
(1)若甲烷的水合物化学式为CH4 8H2O,它的相对分子量是160,则CH4 8H2O中CH4的质量分数为________;
(2)可燃冰储存的巨大的化学能量终来自于古代绿色植物通过________固定的太阳能;
(3)可燃冰燃烧时把自己的热量释放出去,就不会再次自动聚集起来供人类重新利用,这说明能量转化具有________性;
(4)人类正面临常规能源枯竭的危机,下列有关能源的认识正确的是
。
A、提高能源利用效率
B、积极寻找替代常规能源的新能源
C、自然界的能量虽然守恒,但还是要节约能源
25、(2017 绍兴)今年5月,运用“蓝鲸一号”钻探平台,我国南海神狐海域首次实现可燃冰试采成功。
材料一:可燃冰,学名天然气水化合物,其化学式为CH4 8H2O,它是天然气的固体状态(因海底高压埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气)。其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成“可燃冰”。
材料二:“蓝鲸一号”钻探平台设计和建造过程刷新了多项世界记录。它长117米,宽92.7米,高118米,质量为42000吨。
请根据上述材料回答:
(1)形成可燃冰需要一定的生态环境。
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的________。这些细菌分解有机质________(选填“需要”或“不需要”)氧气。这些细菌与真菌在细胞结构上的主要区别是________。
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有________的能力。
(2)形成可燃冰的其中一个条件是有甲烷气源。
①可燃冰(CH4 8H2O)中C:H:O的元素质量比是________。甲烷属于________(选填“有机物”或“无机物”)。
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条)________。(可燃冰在空气中燃烧的化学方程式为CH4 8H2O+2O2
CO2+10H2O)
(3)如果南海海水的密度是1.03×103千克/米3
,
“蓝鲸一号”钻探平台漂浮海面受到海水浮力是________牛,浸入海水的体积至少需要________米3。开采出的可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因可能是________。
26、(2017 嘉兴)2017年5月,中国首次海域天然气水合物(可燃冰)试采成功。可燃冰储量丰富,热值高,燃烧后不产生任何残渣,被称作“未来的能源”。
(1)可燃冰通常出现在深海海底以下数百至一千多米的沉积层内,据推测可能是地层断裂导致气体逸出,上升的气流与海洋深处的冷水接触而形成。基于以上信息可知,影响可燃冰形成的因素可能是气源、压强和________。
(2)可燃冰开采不当,会对地球环境带来严重破坏,如大规模的海底滑坡、大量甲烷逃逸到大气中等。甲烷气体进入大气会带来严重的________,造成全球气温上升。
(3)现在普遍认为可燃冰的化学式是CH4·8H2O,请列式计算可燃冰中碳元素的质量分数。
27、(2017 丽水)儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:
(1)葡萄糖酸锌由________种元素组成;
(2)葡萄糖酸锌中碳、氢元素的质量比为________;
(3)要满足儿童身体正常的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
答案解析部分
一、单选题
1、【答案】C
【考点】有关化学式的计算和推断
【解析】【分析】有机化合物主要是由碳元素、氢元素组成,是一定含碳的化合物,但是不包括碳的氧化物(一氧化碳、二氧化碳)、碳酸,碳酸盐、氰化物、硫氰化物、氰酸盐、金属碳化物、部分简单含碳化合物(如SiC)等物质化学式可表示物质的组成,微观结构,组成物质的各元素质量之比。
【解答】A.苯属于无机化合物,苯含有C元素属有机化合物,A错误;
B.苯由6个碳原子和6个氢原子构成,一个苯分子由6个碳原子和6个氢原子构成,B错误;
C.苯由碳、氢两种元素组成,化学式可看出物质由什么元素组成,苯由碳、氢两种元素组成正确,C正确;
D.苯中碳、氢两种元素的质量比为1:1,1:1是原子个数比,质量之比是12:1,D错误。
故选C
2、【答案】A
【考点】模型与符号
【解析】【分析】在垃圾分类中我们一般将垃圾分成四类:分别是可回收垃圾、厨余垃圾、有害垃圾和其他垃圾。
【解答】A.可回收垃圾,一般包括金属、纸、塑料、玻璃等废旧物,易拉罐属可回收物,A正确;
B.厨余垃圾,主要包括食品的废弃物,B错误;
C.有害垃圾,主要有药品、电池、油漆、荧光灯管等废弃物,C错误;
D.其他垃圾,生活中的不可回收的一些废弃物,D错误。
故选A
3、【答案】A
【考点】元素周期表
【解析】【分析】本题考查了元素、原子的相对原子质量,原子符号的含义以及粒子数目的关系,难度不大,注意概念的掌握。在原子中,核电荷数=质子数=核外电子数=原子序数,质量数=质子数+中子数;原子的相对原子质量近似等于质量数,不等于元素的相对原子质量。
【解答】A、根据元素周期表的图,可知右上角Og为元素符号,故A正确;
B、根据核电荷数=质子数=核外电子数=原子序数,118为该元素的核电荷数,故B错误;
C、根据核电荷数=质子数=核外电子数=原子序数,核电荷数为118,故C错误;
D、根据核电荷数=质子数=核外电子数=原子序数,核外电子数为118,故D错误。
故选A
4、【答案】B
【考点】有关元素化合价的计算
【解析】【分析】本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题。根据在化合物中正负化合价代数和为零,结合氟化钙(CaF2)的化学式进行解答本题。
【解答】钙元素显+2价,设氟元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+2x=0,则x=-1价。
故选B
5、【答案】A
【考点】原子的构成
【解析】【分析】此题是一道原子知识的考查题,解题的关键是对原子内一些等量的关系的了解和掌握。依据原子中原子序数=核内质子数=核外电子数=核电荷数,且相对原子质量=质子数+中子数分析解答。
【解答】解:原子的核电荷数为118,根据原子中核外电子数=核电荷数,则该元素原子的核外电子数为118,
故选A
6、【答案】B
【考点】化学式
【解析】【分析】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。根据物质的化学式来分析,谷氨酸钠含有的元素种类,以及原子个数比。
【解答】A、谷氨酸钠属于有机物,故A正确;
B、根据的化学式分析,谷氨酸钠不含有S元素,因此不会产生含硫物质,故B错误;
C、根据的化学式分析,谷氨酸钠含有C、H、O、N、Na五种元素,故C正确;
D、根据的化学式分析,谷氨酸钠碳、氢原子个数之比为
5∶8,故D正确。
故选B
7、【答案】A
【考点】元素周期表
【解析】【分析】本题考查了原子结构、原子核外电子排布、周期表中的位置判断,注意知识积累,掌握基础是解题关键,题目难度中等。
【解答】A、元素周期表中,以金字旁为偏旁的属于金属元素,因此属于金属元素,故A正确;
B、根据元素周期表的规律,元素符号的首字母都是大写的,故B错误;
C、的原子序数是117,说明该元素核内质子是117,相对原子质量大于117,故C错误;
D、元素在自然界中几乎不存在,故D错误。
故选A
8、【答案】(1)原核生物
(2)N%=
m=100千克/0.35=285.7千克
【考点】细菌,有关化学式的计算和推断
【解析】【分析】(1)原核生物:蓝藻(如颤藻、发菜、念珠藻、蓝球藻)、细菌(如乳酸菌、硝化细菌、大肠杆菌等)、支原体、放线菌.(2)根据化合物中各元素的质量比和物质中某元素的质量分数进行分析解答。
【解答】(1)解:细菌都是由一个细胞组成的.细菌的细胞内都有细胞壁、细胞膜、细胞质等结构,但都没有成形的细胞核.属于原核生物.
9、【答案】A
【考点】构成物质的微粒
【解析】【分析】根据反应的微观示意图模型反应了物质的结构和物质间的相互作用。
【解答】A、该化学反应属于化合反应,甲和乙两种物质反应生成一种物质是化合反应,A正确;
B、甲和乙属于单质,丙属于化合物,甲有两种元素的原子构成不是单质,B错误;
C、参加反应的甲与乙的分子个数比为1:1,由生成中可以看出应该要2个乙分子,C错误;
D、1个丙分子由1个甲分子和2个乙分子构成,分子由原子构成不能说分子构成分子,D错误。
10、【答案】D
【考点】模型与符号
【解析】【分析】本题主要从微观图示的角度对中和反应和相关的知识进行了考查,考查了溶液的导电性、酸碱性和pH值的关系。
【解答】根据题中的叙述可知A选项表示氢离子;B选项表示氢氧根离子;C选项表示钠离子,故选项是错误的叙述;D选项酸碱中核反应的实质为氢离子和氢氧根离子结合生成水;故答案选择D
11、【答案】B
【考点】原子结构的探索过程,原子的构成,原子核的构成,离子
【解析】【分析】汤姆生提出了原子的“枣糕模型”认为原子内有带负电的电子就是“枣”,而正电荷均匀的分布在整个原子中。而现在我们已经知道原子是由带正电的原子核与带负电的核外电子构成的,而原子核仍能继续分成带正电的质子和不带电的中子。原子可以构成分子,原子得失电子后可以形成离子,原子、离子、分子都是构成物质的微粒。
【解答】A、甲,应该是中子不带电,A错误;
B、乙,和电子一起构成原子的应该是原子核且带正电,故B正确;
C、丙,丙是由原子构成的分子不带电,C错误;
D、丁,丁是离子可带正电也可带负电且不在原子内,D错误。
12、【答案】C
【考点】模型与符号
【解析】【分析】模型可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。
【解答】A、若X是肺泡,那么②是静脉血,②是肺静脉但流的是动脉血,A错误;
B、完成反射活动的过程,反射弧的起点是感受器最后才是效应器,B错误;
C、①②表示细胞的分裂,③表示细胞的分化,①②细胞形态及功能均未发生改变属分裂,③过程细胞的形态和功能与母细胞明显不同属分化,C正确;
D、植物细胞模式图,植物细胞应有细胞壁,D错误。
13、【答案】B
【考点】常见元素与常见原子团的化合价
【解析】【分析】本题把握物质中元素的化合价及化合物及微粒性质的关系为解答的关键,注意从元素化合价角度分析,题目难度不大。
【解答】A、物质a化合价为0,为硫单质,在纯氧中燃烧可以生成物SO2
,
SO2化合价为+4,为b,故A正确;
B、c中S为+6价,c是三氧化硫,故B错误;
C、根据图可知物质d中硫元素的化合价为-2价,故C正确;
D、物质d、e、f分别为H2S、H2SO3、H2SO4
,
都含有氢元素,故D正确。
故选B
14、【答案】C
【考点】模型与符号
【解析】【分析】本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键。根据微粒的变化和质量守恒定律分析D的化学式;观察微观示意图,分析反应物、生成物,写出反应的化学方程式,进行分析。
【解答】A、C表示水,由两种元素组成,属于是纯净物,故A错误;
B、由质量守恒定律反应前后原子的种类及数目不变可知,原子不改变,故B错误;
C、空气中体积分数最大的气体是氮气N2
,
故C正确;
D、该反应前后化合价会改变,氧气变成水的过程中,氧元素化合价由0变成-2价,故D错误。
故选C
15、【答案】A
【考点】模型与符号
【解析】【分析】此题是对化学反应微观示意图问题的考查,根据分子构成判断反应物与生成物的种类,写出反应的方程式,然后结合相关的知识分析解答即可。根据题目信息结合微观示意图排除未反应的分子的干扰可写出反应的方程式为:CO2+H2CH2O2据此分析物质的属类、质量比等。
【解答】据题目信息结合微观示意图排除未反应的分子的干扰可写出反应的方程式为:CO2+H2CH2O2;
A、该反应由两种物质生成了一种物质,属于化合反应,故正确;
B、反应前碳元素在化合物中属于CO2
,
碳元素的化合价是+4价,故错误;
C、该反应得到的物质是:CH2O2
,
故错误;
D、参加反应的两物质分子比为1:1,质量比为:22:1,故错误。
故选:A
二、填空题
16、【答案】(1)+3
(2)可燃物的温度
【考点】有关元素化合价的计算
【解析】【分析】(1)根据三氧化二锑的化学式为Sb2O3
,
利用氧化物中氧元素的化合价及化合物中元素的正负化合价的代数和为0来计算其中元素的化合价.
【解答】(1)解:在三氧化二锑中,氧元素的化合价为-2价,
设锑元素的化合价为x,
由化学式为Sb2O3
,
根据化合物中元素的正负化合价的代数和为0,则
2x+(-2)×3=0
解得x=+3;
(2.)氢氧化镁分解时吸收大量热,产生水蒸气可使温度难以升高,因此可以降低可燃物的温度。
胡答案为(1)+3;(2)可燃物的温度.
17、【答案】(1)3﹕1
(2)CH4(或甲烷)
(3)A,C
【考点】化学式
【解析】【分析】(1)考查同学们灵活运用化学式有关计算进行分析问题、解决问题的能力;根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;(2)根据甲烷燃烧的化学方程式,由参加反应的甲烷的质量计算出消耗氧气的量即可;(3)根据可燃冰燃烧特点分析。
【解答】(1)C、H元素的质量比为=12×1﹕1×4=3﹕1;
(2)一分子量CH4
,
消耗2分子氧气,一分子CO,消化0.5分子的氧气,因此消耗氧气较多的是甲烷;
(3)可燃冰存在于低温与高压环境,稳定性较差。大规模开采时,稍有不慎,海底沉积物会失去稳定,可能引发海底塌方,甚至导致海啸,可燃冰埋藏在海面下600~2000米深,虽然存储总量很大,但分布较为分散,目前开采难度大,为可燃冰开采的困难,故选AC。
故答案为:(1)3﹕1;(2)CH4(或甲烷);(3)AC。
18、【答案】(1)-3
(2)700
【考点】有关化学式的计算和推断
【解析】【分析】(1)根据物质中各元素的化合价之和为0可解;(2)根据溶液稀释时溶质的质量不变可解。
【解答】(1)化学式为(NH4)2SO4
,
设N元素的化合价为x,
得x=-3;(2)设需加水V毫升,
,V=700ml。
故答案为:(1)-3;(2)700
19、【答案】(1)非金属
(2)+5
【考点】元素的简单分类,有关元素化合价的计算
【解析】【分析】(1)金属元素名称一般有“钅”字旁,固态非金属元素名称有“石”字旁,气态非金属元素名称有“气”字头,进行分析解答.(2)根据PtF6﹣为带一个单位负电荷的原子团,化合价的数值等于离子所带电荷的数值,且符号一致,结合原子团中元素的化合价代数和等于原子团的化合价,进行分析解答.
【解答】解:(1)F的名称是氟,带“气”字旁,属于非金属元素.(2)PtF6﹣为带一个单位负电荷的原子团,化合价的数值等于离子所带电荷的数值,且符号一致,则PtF6的化合价为﹣1价;在化合物中氟几乎都呈﹣1价,设Pt元素的化合价为x,由原子团中元素的化合价代数和等于原子团的化合价,可得:x+(﹣1)×6=﹣1,则x=+5价.
故答案为:(1)非金属;(2)+5.
20、【答案】原子序;一个镆原子
【考点】元素的概念,元素的符号及其意义
【解析】【分析】根据元素周期表的意义,以及元素符号的意义进行解答.
【解答】解:115表示原子的原子序数,根据元素符号的意义可知,Mc可表示的微观意义为一个镆原子;
故答案为:原子序;一个镆原子;
21、【答案】(1)电能转化为机械能
(2)无性(或分裂)
(3)H2O
【考点】化学式,直流电动机的原理
【解析】【分析】(1)电动机的原理是利用通电导体在磁场中受到力的作用的原理制成的,它是一种将电能转化为机械能的机器。为了让电动机能够持续转动,在制作电动机时增加了换向器,当线圈刚好转过平衡位置时就自动改变线圈中的电流的方向,及时改变通电线圈的受力方向,保证电动机能够连续转动;(2)细菌通过分裂的方式进行繁殖,细菌的繁殖能力很强,在条件适宜的情况下,每20-30分钟就能分裂一次;(3)根据化学反应方程式的配平进行分析。
【解答】(1)动机的原理是利用通电导体在磁场中受到力的作用的原理制成的,它是一种将电能转化为机械能的机器;
(2)细菌通过分裂的方式进行繁殖,分裂时,细胞首先将它的遗传物质进行复制;
(3)根据化学反应方程式两端原子分析,X为H2O。
故答案为:(1)电能转化为机械能;(2)无性(或分裂);(3)H2O。
22、【答案】(1)质子数(或“核电荷数”)
(2)H2O
(3)Mg(OH)2
【考点】元素的符号及其意义
【解析】【分析】(1)本题考查了元素种类的决定因素。根据已有的知识进行分析解答,元素的种类与原子的核内质子数有关,据此解答;(2)由两种元素组成的化合物中,其中一种元素是氧化物,这种化合物叫氧化物,根据氧化物的特点进行分析;(3)根据指针写出三种元素能组成的化合物。
【解答】(1)元素之间的根本区别是其核内的质子数(核电荷数)不同;
(2)由两种元素组成的化合物中,其中一种元素是氧化物的是H2O;
(3)时针、分针和秒针指的三种元素分别为Mg、O、H,可以组成化合物Mg(OH)2。
故答案为:(1)质子数(或“核电荷数”);(2)H2O;(3)Mg(OH)2。
三、解答题
23、【答案】(1)红
(2)32
(3)mc=28.7克×(15C/C15H11O6)=28.7克×(180/287)=18克
【考点】酸碱指示剂及其性质,有关化学式的计算和推断
【解析】【分析】(1)根据材料提供的信息可解;(2)根据化学式的含义;(3)根据化学式求出C元素的质量分数再乘以28.7g即为28.7克花青素中碳元素的质量。
【解答】(1)根据材料提供信息酸性时呈红色,碱性时呈蓝色可知,白醋中滴加花青素,由于白醋显酸性所以溶液应该显红色;(2)一个花青素分子(C15H11O6)含有15个碳原子,11个氢原子,6个氧原子共有32个原子
故答案为:(1)红;(2)32;(3)18克
24、【答案】(1)10%
(2)光合作用
(3)方向
(4)A,B,C
【考点】化学式
【解析】【分析】化学式是最重要的化学用语之一,应用广泛,是考查的重点和热点,理解化学式的含义,掌握相关计算的方法,问题就会迎刃而解。(1)根据甲烷水合物的化学式判断计算CH4的质量分数;(2)绿色植物通过光合作用固定太阳能;(3)根据能量转换具有方向性分析解答;(4)根据能量的合理利用分析判断。
【解答】(1)根据可燃冰的化学式可以计算出CH4的质量分数=;
(2)可燃冰是由古代植物通过光合作用固定的太阳能;
(3)可燃冰燃烧时把自己的热量释放出去,具有单向性,说明能量转化具有方向性;
(4)面临常规能源枯竭的危机,可以提高能源利用效率,积极寻找替代常规能源的新能源,自然界的能量虽然守恒,但还是要节约能源。
故答案为:(1)10%;(2)光合作用;(3)方向;(4)ABC。
25、【答案】(1)适应;不需要;无成形的细胞核;自动调节
(2)3:5:32;有机物;开发新能源,解决能源紧张问题、减少对环境的污染
(3)4.2×108;4.08×104;压强减小、温度升高
【考点】化学式,阿基米德原理,细菌
【解析】【分析】(1)考察细菌与真菌的结构差异,以及生态系统的自我调节机制;(2)根据可燃冰的化学式,可以分析各元素的质量比;可燃冰属于有机物;(3)根据漂浮状态的二力平衡可以计算出漂浮状态时F浮=G,水中受到的浮力根据阿基米德原理F浮=ρ液gV排计算V排。
【解答】(1)海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的适应;深海之中缺乏氧气,因此这些细菌分解有机质不需要氧气;细菌与真菌在细胞结构上的主要区别是无成形的细胞核;生态系统具有自动调节机制,以维持生态系统的稳定和平衡;
(2)根据可燃冰的化学式,可以分析各元素的质量比C:H:O=12×1:20×1:16×8=3:5:32;可燃冰属于有机物;开采可燃冰的积极意义有开发新能源,解决能源紧张问题、减少对环境的污染;
(3)钻探平台漂浮海面时二力平衡,此时F浮=G=mg=4.2×107kg×10N/kg=4.2×108N
=
可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因是压强减小、温度升高使可燃冰分解了。
故答案为:(1)适应,不需要,无成形的细胞核,自动调节;(2)3:5:32,有机物,开发新能源,解决能源紧张问题、减少对环境的污染;(3)4.2×108
,
4.08×104
,
压强减小、温度升高。
26、【答案】(1)温度
(2)温室效应
(3)碳元素的质量分数=
答:可燃冰中碳元素的质量分数为7.5%。
【考点】化学式
【解析】【分析】可燃冰的储量很丰富,是比较清洁的燃料,有可能成为取代石油、煤的新型燃料。甲烷燃烧生成水和二氧化碳,不污染环境,是一种比较清洁的燃料。天然气和水在低温、高压条件下相互作用能够形成可燃冰,可燃冰的主要成分是甲烷,甲烷燃烧时不污染环境。
【解答】(1)可燃冰是由天然气和水在低温、高压条件下相互作用能够形成,因此影响因素还有温度;
(2)甲烷是温室气体,进入大气会造成温室效应;
故答案为:(1)温度;(2)温室效应;(3)7.5%。
27、【答案】(1)四
(2)72:11
(3)1支
【考点】化学式
【解析】【分析】本题主要考查元素的存在形式,有关化学式和溶液溶质质量分数的计算,了解元素的两种存在形式,掌握相关计算公式是解题的先决条件。根据口服液中的锌的存在形式和葡萄糖酸锌的化学式及元素质量比的含义回答,根据口服液中锌的质量分数计算。
【解答】(1)在补锌口服液中,锌是以C12H22O14Zn的形式存在的,含有四种元素;
(2)在补锌口服液中,锌是以C12H22O14Zn的形式存在的,该口服液中的锌是指锌元素;葡萄糖酸锌的化学式为C12H22O14Zn,其中碳、氢元素的质量比为(12×12):(1×22)=72:11;
(3)1kg体重每日需要0.5mg锌,体重为20kg的儿童每天需要10mg锌,一半来自食物补充即5mg.
而每支含锌5mg,所以仅需1支就可以满足需要。
故答案为:(1)四;(2)72:11;(3)1支。
一、单选题
1、(2017·台州)如图是微信热传的“苯宝宝表情包”,苯(化学式为C6H6)是一种重要的化工原料。下列有关苯的说法正确的是(
)
A、苯属于无机化合物
B、苯由6个碳原子和6个氢原子构成
C、苯由碳、氢两种元素组成
D、苯中碳、氢两种元素的质量比为1:1
2、(2017·台州)垃圾分一分,环境美十分。投放铝制易拉罐的垃圾箱应贴以下哪个标识?(
)
A、可回收物
B、厨余垃圾
C、有害垃圾
D、其他垃圾
3、(2017 杭州)2017年5月,中科院、国家语委和全国科技名词委正式定名118号元素为
,其部分信息如图所示。则下列有关
的说法正确的是(
)
A、元素符号为Og
B、相对原子质量为118
C、原子的核电荷数为179
D、原子的核外电子数为297
4、(2017 温州)构成人体骨骼和牙齿的无机盐称为骨盐,其中含有氟化钙(CaF2)。氟化钙中氟(F)元素的化合价为(
)
A、 2
B、 1
C、+1
D、+2
5、(2017 温州)5月9日,相关机构发布
等四种元素的中文名称。元素的核电荷数为118,相对原子质量为294,则
原子核外电子数为(
)
A、118
B、176
C、294
D、412
6、(2017 嘉兴)谷氨酸钠(化学式为
C5H8O4NNa)是味精的主要成分。下列关于谷氨酸钠的说法错误的是(
)
A、是一种有机物
B、加热会产生含硫物质
C、由五种元素组成
D、碳、氢原子个数之比为
5∶8
7、(2017 嘉兴)今年5月9日,由中国科学院等相关部门正式发布了113
号、115号、117
号、118号元素的中文名称。下表是这四种元素的部分信息,以下有关说法正确的是(
)
A、属于金属元素
B、镆的元素符号是mo
C、元素的相对原子质量是117
D、元素在自然界中含量丰富
8、(2017 湖州)化肥为缓解地球上有限的耕地资源与庞大的粮食需求之间的矛盾做出了巨大的贡献。但在化肥生产和使用中,也伴随着能源耗费和环境污染等问题。因此,生物固氮作用的研究日益受到各国政府的重视。大气中的N2转化为NH3的过程叫做固氮作用。固氮作用的途径有三条:生物固氮、雷电固氮和人工固氮。
请回答:
(1)固氮生物大多属于细菌,细菌属于________(选
填“真核生物”或“原核生物”)。
(2)资料显示一公顷林地平均每年固定氮元素的质量约为100千克。这些氮元素如果从NH4NO3中获得,则需要施加多少千克NH4NO3?(精确到0.1千克)
9、(2017·宁波)如图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
A、该化学反应属于化合反应
B、甲和乙属于单质,丙属于化合物
C、参加反应的甲与乙的分子个数比为1:1
D、1个丙分子由1个甲分子和2个乙分子构成
10、(2017 杭州)向氢氧化钠溶液中滴加稀盐酸至恰好完全反应,反应前后溶液中存在的离子种类如图所示
(其中表示不同离子)。则下列说法正确的是(
)
A、表示氯离子
B、表示钠离子
C、可用适量硝酸银溶液和足量稀硝酸进行检验
D、此反应的实质是
结合成水分子
11、(2017 衢州)1897年,英国科学家汤姆生发现了原子内有带负电的电子,而原子
是电中性的,由此推测,原子内还有带正电的物质。在此基础上,经过卢瑟福、玻尔等科学家的不断完善和修正,建立了现代原子结构模型。如图是小柯整理的物质微观构成网络图,则汤姆生当年推测的“带正电的物质”相当于图中的(
)
A、甲
B、乙
C、丙
D、丁
12、(2017 衢州)建立模型是一种很好的学习方法。下列模型及其说法正确的是(
)
A、
若X是肺泡,那么②是静脉血
B、
完成反射活动的过程
C、
①②表示细胞的分裂,③表示细胞的分化
D、
植物细胞模式图
13、(2017 绍兴)图中字母代表含硫元素的物质,下列判断错误的是(
)
A、物质a在纯氧中燃烧可以生成物质b
B、物质c是二氧化硫
C、物质d中硫元素的化合价为-2价
D、物质d、e和f中一定都含有氢元素
14、(2017 金华)将宏观、微观及化学符号联系在一起是化学学科的特点。在一定条件下,A和B能发生化学反应生成C和D。其微观示意图如图所示,下列相关叙述正确的是(
)
A、从宏观角度看,物质C由两种元素组成,属于混合物
B、从微观角度看,该化学变化中发生根本改变和微粒是原子
C、若D为空气中体积分数最大的气体,则D的微观符号可表示为N2
D、该反应属于基本反应类型中的置换反应,反应前后各元素化合价不变
15、(2017 丽水)科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下。有关该反应的说法正确的是(
)
A、该反应属于化合反应
B、反应前碳元素的化合价为+2价
C、生成物的化学式可用C2H2O表示
D、参加反应的两物质的质量比为1:1
二、填空题
16、(2017 舟山)人们常在可燃建筑材料中添加阻燃剂以防止火灾,三氧化二锑(Sb2O3)、氢氧化镁都是常见的阻燃剂。
(1)Sb2O3中的Sb的化合价________。
(2)氢氧化镁作为阻燃剂,分解时吸收大量的热,从而可以降低________。
17、(2017 温州)据报道,我国已在南海某海域试采可燃冰获得成功。可燃冰分布于深海沉积物或陆域的永久冻土中,主要是由甲烷(CH4)与水在高压低温条件下形成的类冰状结晶物质,可燃烧,所以被称为“可燃冰”。
(1)CH4中C、H元素的质量比为________。
(2)已知在相同条件下,1米3CO和1米3
CH4所含的分子数目相同。CO、CH4燃烧的化学方程式分别为2CO+O2点燃2CO2
,
CH4+2O2点燃CO2+2H2O。据此分析,在相同条件下,分别燃烧1米3的CO与CH4
,
消耗氧气较多的是________。
(3)有专家指出,“从实现可燃冰试开采成功到大规模开采之路依然遥远,许多问题有待进一步解决”。下列证据中,支持专家观点的有
(可多选)。
A、可燃冰存在于低温与高压环境,稳定性较差。大规模开采时,稍有不慎,海底沉积物会失去稳定,可能引发海底塌方,甚至导致海啸
B、可燃冰是高效、资源量大的优质能源,开采可燃冰对我国能源生产有重要价值
C、可燃冰埋藏在海面下600~2000米深,虽然存储总量很大,但分布较为分散,目前开采难度大
D、我国已实现可燃冰全流程试采核心技术的重大突破,形成了国际领先的新型试采工艺
E、可燃冰与煤、石油等能源相比,是绿色清洁能源,具有良好的商业开发前景
18、(2017·台州)硫酸铵【化学式为(NH4)2SO4】是一种能促进植物茎、叶生长的氮肥。
(1)硫酸铵中氮元素的化合价为________。
(2)施肥浓度过高,会造成烧苗现象。小柯通过实验发现,质量分数为2%的硫酸铵溶液不会导致植物烧苗。他用50克30%的硫酸铵溶液配制2%的硫酸铵溶液,需要加水________毫升。
19、(2017 湖州)1886年,法国化学家莫瓦桑第一次制得了氟的气态单质,并确定其化学式为F2
,
它几乎可以与所有金属直接化合,且在化合物中氟几乎都呈﹣1价
(1)F元素属于________元素(选填“金属”或“非金属”).
(2)科学家还用Xe(氙气)和PtF6﹣首次合成了含稀有气体元素的化合价XePtF6
,
其中PtF6﹣为带一个单位负电荷的原子团,XePtF6中Pt元素的化合价为________.
20、(2017 湖州)2016年6月,国际纯粹与应用化学联合会宣布,合成化学元素113号(Nh鉨),115号(Mc
镆),117号(Ts
)和118号(Og
)为化学新元素.其中,“115号(Mc
镆)”中115表示原子的________数,Mc表示的微观意义是________.
21、(2017 温州)我省开展“全面剿灭劣V类水”行动。为了治理某河道的水污染,相关部门放置一批太阳能仿生水草,几个月后效果明显。太阳能仿生水草主要由太阳能电池板、小型送风电动机以及若干人造水草等构成(如图)。太阳能电池板为电动机供电,电动机工作,给河水持续提供空气,增加水体中的溶解氧。
(1)电动机工作时,其能量如何转化?________
(2)人造水草中有硝化细菌,当水体溶解氧增加,硝化细菌会快速繁殖。细菌的生殖方式为________生殖。
(3)水体中氮元素含量过高是河道水污染的主要原因之一。人造水草中的硝化细菌能将污水中的含氮化合物最终转化为无污染物质,该过程涉及到的化学反应之一是:
,则X的化学式为________。
22、(2017 嘉兴)小明利用12种元素制作了一张如图所示的“元素钟面”。
(1)钟面上的这些元素之间最根本的区别是________不同。
(2)小明根据钟面上提供的元素,写出了下列三种物质的化学式:O2、H2O和NaNO3
,
其中属于氧化物的是________。
(3)此刻钟面上的时针、分针和秒针分别指向三种不同元素,请写出由这三种元素组成的化合物________。(用化学式表示)
三、解答题
23、(2017·台州)每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。
(1)在白醋中滴加花青素,溶液变________色。
(2)一个花青素分子中共有________个原子。
(3)28.7克花青素中含有多少克碳元素?(请列式计算)
24、(2017 丽水)2017年5月18日,国土资源部发布消息,在南海北部1266米深的神狐海域,中国首次海域“可燃冰”试采成功。
查阅资料发现,古代低等生物遗骸大量沉积,经过漫长的地质年代形成石油及天然气,海底的天然气与水在高压低温条件下形成的类冰状的固体物质即“可燃冰”。“可燃冰”为甲烷的水合物,遇火即可燃烧且热值高,是一种环保、高效的新能源。
(1)若甲烷的水合物化学式为CH4 8H2O,它的相对分子量是160,则CH4 8H2O中CH4的质量分数为________;
(2)可燃冰储存的巨大的化学能量终来自于古代绿色植物通过________固定的太阳能;
(3)可燃冰燃烧时把自己的热量释放出去,就不会再次自动聚集起来供人类重新利用,这说明能量转化具有________性;
(4)人类正面临常规能源枯竭的危机,下列有关能源的认识正确的是
。
A、提高能源利用效率
B、积极寻找替代常规能源的新能源
C、自然界的能量虽然守恒,但还是要节约能源
25、(2017 绍兴)今年5月,运用“蓝鲸一号”钻探平台,我国南海神狐海域首次实现可燃冰试采成功。
材料一:可燃冰,学名天然气水化合物,其化学式为CH4 8H2O,它是天然气的固体状态(因海底高压埋于海底地层深处的大量有机质在细菌的分解作用下,最后形成石油和天然气(石油气)。其中许多天然气被包进水分子中,在海底的低温(2~5℃)与压力下结晶,形成“可燃冰”。
材料二:“蓝鲸一号”钻探平台设计和建造过程刷新了多项世界记录。它长117米,宽92.7米,高118米,质量为42000吨。
请根据上述材料回答:
(1)形成可燃冰需要一定的生态环境。
①海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的________。这些细菌分解有机质________(选填“需要”或“不需要”)氧气。这些细菌与真菌在细胞结构上的主要区别是________。
②在开采过程中,极少量的垃圾废弃物没有对海洋环境造成破坏,这主要是因为海洋生态系统有________的能力。
(2)形成可燃冰的其中一个条件是有甲烷气源。
①可燃冰(CH4 8H2O)中C:H:O的元素质量比是________。甲烷属于________(选填“有机物”或“无机物”)。
②与石油、煤等化石燃料相比较,开采可燃冰的积极意义有(写一条)________。(可燃冰在空气中燃烧的化学方程式为CH4 8H2O+2O2
CO2+10H2O)
(3)如果南海海水的密度是1.03×103千克/米3
,
“蓝鲸一号”钻探平台漂浮海面受到海水浮力是________牛,浸入海水的体积至少需要________米3。开采出的可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因可能是________。
26、(2017 嘉兴)2017年5月,中国首次海域天然气水合物(可燃冰)试采成功。可燃冰储量丰富,热值高,燃烧后不产生任何残渣,被称作“未来的能源”。
(1)可燃冰通常出现在深海海底以下数百至一千多米的沉积层内,据推测可能是地层断裂导致气体逸出,上升的气流与海洋深处的冷水接触而形成。基于以上信息可知,影响可燃冰形成的因素可能是气源、压强和________。
(2)可燃冰开采不当,会对地球环境带来严重破坏,如大规模的海底滑坡、大量甲烷逃逸到大气中等。甲烷气体进入大气会带来严重的________,造成全球气温上升。
(3)现在普遍认为可燃冰的化学式是CH4·8H2O,请列式计算可燃冰中碳元素的质量分数。
27、(2017 丽水)儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明书的部分信息,回答下列问题:
(1)葡萄糖酸锌由________种元素组成;
(2)葡萄糖酸锌中碳、氢元素的质量比为________;
(3)要满足儿童身体正常的需要,在某一时间段需要适量补锌。若儿童1千克体重每日需要0.5毫克锌,每天从食物中只能摄入所需锌的一半。体重为20千克的儿童,理论上一天还需服该口服液多少支?
答案解析部分
一、单选题
1、【答案】C
【考点】有关化学式的计算和推断
【解析】【分析】有机化合物主要是由碳元素、氢元素组成,是一定含碳的化合物,但是不包括碳的氧化物(一氧化碳、二氧化碳)、碳酸,碳酸盐、氰化物、硫氰化物、氰酸盐、金属碳化物、部分简单含碳化合物(如SiC)等物质化学式可表示物质的组成,微观结构,组成物质的各元素质量之比。
【解答】A.苯属于无机化合物,苯含有C元素属有机化合物,A错误;
B.苯由6个碳原子和6个氢原子构成,一个苯分子由6个碳原子和6个氢原子构成,B错误;
C.苯由碳、氢两种元素组成,化学式可看出物质由什么元素组成,苯由碳、氢两种元素组成正确,C正确;
D.苯中碳、氢两种元素的质量比为1:1,1:1是原子个数比,质量之比是12:1,D错误。
故选C
2、【答案】A
【考点】模型与符号
【解析】【分析】在垃圾分类中我们一般将垃圾分成四类:分别是可回收垃圾、厨余垃圾、有害垃圾和其他垃圾。
【解答】A.可回收垃圾,一般包括金属、纸、塑料、玻璃等废旧物,易拉罐属可回收物,A正确;
B.厨余垃圾,主要包括食品的废弃物,B错误;
C.有害垃圾,主要有药品、电池、油漆、荧光灯管等废弃物,C错误;
D.其他垃圾,生活中的不可回收的一些废弃物,D错误。
故选A
3、【答案】A
【考点】元素周期表
【解析】【分析】本题考查了元素、原子的相对原子质量,原子符号的含义以及粒子数目的关系,难度不大,注意概念的掌握。在原子中,核电荷数=质子数=核外电子数=原子序数,质量数=质子数+中子数;原子的相对原子质量近似等于质量数,不等于元素的相对原子质量。
【解答】A、根据元素周期表的图,可知右上角Og为元素符号,故A正确;
B、根据核电荷数=质子数=核外电子数=原子序数,118为该元素的核电荷数,故B错误;
C、根据核电荷数=质子数=核外电子数=原子序数,核电荷数为118,故C错误;
D、根据核电荷数=质子数=核外电子数=原子序数,核外电子数为118,故D错误。
故选A
4、【答案】B
【考点】有关元素化合价的计算
【解析】【分析】本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题。根据在化合物中正负化合价代数和为零,结合氟化钙(CaF2)的化学式进行解答本题。
【解答】钙元素显+2价,设氟元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+2x=0,则x=-1价。
故选B
5、【答案】A
【考点】原子的构成
【解析】【分析】此题是一道原子知识的考查题,解题的关键是对原子内一些等量的关系的了解和掌握。依据原子中原子序数=核内质子数=核外电子数=核电荷数,且相对原子质量=质子数+中子数分析解答。
【解答】解:原子的核电荷数为118,根据原子中核外电子数=核电荷数,则该元素原子的核外电子数为118,
故选A
6、【答案】B
【考点】化学式
【解析】【分析】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力。根据物质的化学式来分析,谷氨酸钠含有的元素种类,以及原子个数比。
【解答】A、谷氨酸钠属于有机物,故A正确;
B、根据的化学式分析,谷氨酸钠不含有S元素,因此不会产生含硫物质,故B错误;
C、根据的化学式分析,谷氨酸钠含有C、H、O、N、Na五种元素,故C正确;
D、根据的化学式分析,谷氨酸钠碳、氢原子个数之比为
5∶8,故D正确。
故选B
7、【答案】A
【考点】元素周期表
【解析】【分析】本题考查了原子结构、原子核外电子排布、周期表中的位置判断,注意知识积累,掌握基础是解题关键,题目难度中等。
【解答】A、元素周期表中,以金字旁为偏旁的属于金属元素,因此属于金属元素,故A正确;
B、根据元素周期表的规律,元素符号的首字母都是大写的,故B错误;
C、的原子序数是117,说明该元素核内质子是117,相对原子质量大于117,故C错误;
D、元素在自然界中几乎不存在,故D错误。
故选A
8、【答案】(1)原核生物
(2)N%=
m=100千克/0.35=285.7千克
【考点】细菌,有关化学式的计算和推断
【解析】【分析】(1)原核生物:蓝藻(如颤藻、发菜、念珠藻、蓝球藻)、细菌(如乳酸菌、硝化细菌、大肠杆菌等)、支原体、放线菌.(2)根据化合物中各元素的质量比和物质中某元素的质量分数进行分析解答。
【解答】(1)解:细菌都是由一个细胞组成的.细菌的细胞内都有细胞壁、细胞膜、细胞质等结构,但都没有成形的细胞核.属于原核生物.
9、【答案】A
【考点】构成物质的微粒
【解析】【分析】根据反应的微观示意图模型反应了物质的结构和物质间的相互作用。
【解答】A、该化学反应属于化合反应,甲和乙两种物质反应生成一种物质是化合反应,A正确;
B、甲和乙属于单质,丙属于化合物,甲有两种元素的原子构成不是单质,B错误;
C、参加反应的甲与乙的分子个数比为1:1,由生成中可以看出应该要2个乙分子,C错误;
D、1个丙分子由1个甲分子和2个乙分子构成,分子由原子构成不能说分子构成分子,D错误。
10、【答案】D
【考点】模型与符号
【解析】【分析】本题主要从微观图示的角度对中和反应和相关的知识进行了考查,考查了溶液的导电性、酸碱性和pH值的关系。
【解答】根据题中的叙述可知A选项表示氢离子;B选项表示氢氧根离子;C选项表示钠离子,故选项是错误的叙述;D选项酸碱中核反应的实质为氢离子和氢氧根离子结合生成水;故答案选择D
11、【答案】B
【考点】原子结构的探索过程,原子的构成,原子核的构成,离子
【解析】【分析】汤姆生提出了原子的“枣糕模型”认为原子内有带负电的电子就是“枣”,而正电荷均匀的分布在整个原子中。而现在我们已经知道原子是由带正电的原子核与带负电的核外电子构成的,而原子核仍能继续分成带正电的质子和不带电的中子。原子可以构成分子,原子得失电子后可以形成离子,原子、离子、分子都是构成物质的微粒。
【解答】A、甲,应该是中子不带电,A错误;
B、乙,和电子一起构成原子的应该是原子核且带正电,故B正确;
C、丙,丙是由原子构成的分子不带电,C错误;
D、丁,丁是离子可带正电也可带负电且不在原子内,D错误。
12、【答案】C
【考点】模型与符号
【解析】【分析】模型可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。
【解答】A、若X是肺泡,那么②是静脉血,②是肺静脉但流的是动脉血,A错误;
B、完成反射活动的过程,反射弧的起点是感受器最后才是效应器,B错误;
C、①②表示细胞的分裂,③表示细胞的分化,①②细胞形态及功能均未发生改变属分裂,③过程细胞的形态和功能与母细胞明显不同属分化,C正确;
D、植物细胞模式图,植物细胞应有细胞壁,D错误。
13、【答案】B
【考点】常见元素与常见原子团的化合价
【解析】【分析】本题把握物质中元素的化合价及化合物及微粒性质的关系为解答的关键,注意从元素化合价角度分析,题目难度不大。
【解答】A、物质a化合价为0,为硫单质,在纯氧中燃烧可以生成物SO2
,
SO2化合价为+4,为b,故A正确;
B、c中S为+6价,c是三氧化硫,故B错误;
C、根据图可知物质d中硫元素的化合价为-2价,故C正确;
D、物质d、e、f分别为H2S、H2SO3、H2SO4
,
都含有氢元素,故D正确。
故选B
14、【答案】C
【考点】模型与符号
【解析】【分析】本题通过微观粒子的反应模型图,考查了微观上对化学反应的认识,学会通过微观示意图把宏观物质和微观粒子联系起来、从微观的角度分析物质的变化是正确解答此类题的关键。根据微粒的变化和质量守恒定律分析D的化学式;观察微观示意图,分析反应物、生成物,写出反应的化学方程式,进行分析。
【解答】A、C表示水,由两种元素组成,属于是纯净物,故A错误;
B、由质量守恒定律反应前后原子的种类及数目不变可知,原子不改变,故B错误;
C、空气中体积分数最大的气体是氮气N2
,
故C正确;
D、该反应前后化合价会改变,氧气变成水的过程中,氧元素化合价由0变成-2价,故D错误。
故选C
15、【答案】A
【考点】模型与符号
【解析】【分析】此题是对化学反应微观示意图问题的考查,根据分子构成判断反应物与生成物的种类,写出反应的方程式,然后结合相关的知识分析解答即可。根据题目信息结合微观示意图排除未反应的分子的干扰可写出反应的方程式为:CO2+H2CH2O2据此分析物质的属类、质量比等。
【解答】据题目信息结合微观示意图排除未反应的分子的干扰可写出反应的方程式为:CO2+H2CH2O2;
A、该反应由两种物质生成了一种物质,属于化合反应,故正确;
B、反应前碳元素在化合物中属于CO2
,
碳元素的化合价是+4价,故错误;
C、该反应得到的物质是:CH2O2
,
故错误;
D、参加反应的两物质分子比为1:1,质量比为:22:1,故错误。
故选:A
二、填空题
16、【答案】(1)+3
(2)可燃物的温度
【考点】有关元素化合价的计算
【解析】【分析】(1)根据三氧化二锑的化学式为Sb2O3
,
利用氧化物中氧元素的化合价及化合物中元素的正负化合价的代数和为0来计算其中元素的化合价.
【解答】(1)解:在三氧化二锑中,氧元素的化合价为-2价,
设锑元素的化合价为x,
由化学式为Sb2O3
,
根据化合物中元素的正负化合价的代数和为0,则
2x+(-2)×3=0
解得x=+3;
(2.)氢氧化镁分解时吸收大量热,产生水蒸气可使温度难以升高,因此可以降低可燃物的温度。
胡答案为(1)+3;(2)可燃物的温度.
17、【答案】(1)3﹕1
(2)CH4(或甲烷)
(3)A,C
【考点】化学式
【解析】【分析】(1)考查同学们灵活运用化学式有关计算进行分析问题、解决问题的能力;根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;(2)根据甲烷燃烧的化学方程式,由参加反应的甲烷的质量计算出消耗氧气的量即可;(3)根据可燃冰燃烧特点分析。
【解答】(1)C、H元素的质量比为=12×1﹕1×4=3﹕1;
(2)一分子量CH4
,
消耗2分子氧气,一分子CO,消化0.5分子的氧气,因此消耗氧气较多的是甲烷;
(3)可燃冰存在于低温与高压环境,稳定性较差。大规模开采时,稍有不慎,海底沉积物会失去稳定,可能引发海底塌方,甚至导致海啸,可燃冰埋藏在海面下600~2000米深,虽然存储总量很大,但分布较为分散,目前开采难度大,为可燃冰开采的困难,故选AC。
故答案为:(1)3﹕1;(2)CH4(或甲烷);(3)AC。
18、【答案】(1)-3
(2)700
【考点】有关化学式的计算和推断
【解析】【分析】(1)根据物质中各元素的化合价之和为0可解;(2)根据溶液稀释时溶质的质量不变可解。
【解答】(1)化学式为(NH4)2SO4
,
设N元素的化合价为x,
得x=-3;(2)设需加水V毫升,
,V=700ml。
故答案为:(1)-3;(2)700
19、【答案】(1)非金属
(2)+5
【考点】元素的简单分类,有关元素化合价的计算
【解析】【分析】(1)金属元素名称一般有“钅”字旁,固态非金属元素名称有“石”字旁,气态非金属元素名称有“气”字头,进行分析解答.(2)根据PtF6﹣为带一个单位负电荷的原子团,化合价的数值等于离子所带电荷的数值,且符号一致,结合原子团中元素的化合价代数和等于原子团的化合价,进行分析解答.
【解答】解:(1)F的名称是氟,带“气”字旁,属于非金属元素.(2)PtF6﹣为带一个单位负电荷的原子团,化合价的数值等于离子所带电荷的数值,且符号一致,则PtF6的化合价为﹣1价;在化合物中氟几乎都呈﹣1价,设Pt元素的化合价为x,由原子团中元素的化合价代数和等于原子团的化合价,可得:x+(﹣1)×6=﹣1,则x=+5价.
故答案为:(1)非金属;(2)+5.
20、【答案】原子序;一个镆原子
【考点】元素的概念,元素的符号及其意义
【解析】【分析】根据元素周期表的意义,以及元素符号的意义进行解答.
【解答】解:115表示原子的原子序数,根据元素符号的意义可知,Mc可表示的微观意义为一个镆原子;
故答案为:原子序;一个镆原子;
21、【答案】(1)电能转化为机械能
(2)无性(或分裂)
(3)H2O
【考点】化学式,直流电动机的原理
【解析】【分析】(1)电动机的原理是利用通电导体在磁场中受到力的作用的原理制成的,它是一种将电能转化为机械能的机器。为了让电动机能够持续转动,在制作电动机时增加了换向器,当线圈刚好转过平衡位置时就自动改变线圈中的电流的方向,及时改变通电线圈的受力方向,保证电动机能够连续转动;(2)细菌通过分裂的方式进行繁殖,细菌的繁殖能力很强,在条件适宜的情况下,每20-30分钟就能分裂一次;(3)根据化学反应方程式的配平进行分析。
【解答】(1)动机的原理是利用通电导体在磁场中受到力的作用的原理制成的,它是一种将电能转化为机械能的机器;
(2)细菌通过分裂的方式进行繁殖,分裂时,细胞首先将它的遗传物质进行复制;
(3)根据化学反应方程式两端原子分析,X为H2O。
故答案为:(1)电能转化为机械能;(2)无性(或分裂);(3)H2O。
22、【答案】(1)质子数(或“核电荷数”)
(2)H2O
(3)Mg(OH)2
【考点】元素的符号及其意义
【解析】【分析】(1)本题考查了元素种类的决定因素。根据已有的知识进行分析解答,元素的种类与原子的核内质子数有关,据此解答;(2)由两种元素组成的化合物中,其中一种元素是氧化物,这种化合物叫氧化物,根据氧化物的特点进行分析;(3)根据指针写出三种元素能组成的化合物。
【解答】(1)元素之间的根本区别是其核内的质子数(核电荷数)不同;
(2)由两种元素组成的化合物中,其中一种元素是氧化物的是H2O;
(3)时针、分针和秒针指的三种元素分别为Mg、O、H,可以组成化合物Mg(OH)2。
故答案为:(1)质子数(或“核电荷数”);(2)H2O;(3)Mg(OH)2。
三、解答题
23、【答案】(1)红
(2)32
(3)mc=28.7克×(15C/C15H11O6)=28.7克×(180/287)=18克
【考点】酸碱指示剂及其性质,有关化学式的计算和推断
【解析】【分析】(1)根据材料提供的信息可解;(2)根据化学式的含义;(3)根据化学式求出C元素的质量分数再乘以28.7g即为28.7克花青素中碳元素的质量。
【解答】(1)根据材料提供信息酸性时呈红色,碱性时呈蓝色可知,白醋中滴加花青素,由于白醋显酸性所以溶液应该显红色;(2)一个花青素分子(C15H11O6)含有15个碳原子,11个氢原子,6个氧原子共有32个原子
故答案为:(1)红;(2)32;(3)18克
24、【答案】(1)10%
(2)光合作用
(3)方向
(4)A,B,C
【考点】化学式
【解析】【分析】化学式是最重要的化学用语之一,应用广泛,是考查的重点和热点,理解化学式的含义,掌握相关计算的方法,问题就会迎刃而解。(1)根据甲烷水合物的化学式判断计算CH4的质量分数;(2)绿色植物通过光合作用固定太阳能;(3)根据能量转换具有方向性分析解答;(4)根据能量的合理利用分析判断。
【解答】(1)根据可燃冰的化学式可以计算出CH4的质量分数=;
(2)可燃冰是由古代植物通过光合作用固定的太阳能;
(3)可燃冰燃烧时把自己的热量释放出去,具有单向性,说明能量转化具有方向性;
(4)面临常规能源枯竭的危机,可以提高能源利用效率,积极寻找替代常规能源的新能源,自然界的能量虽然守恒,但还是要节约能源。
故答案为:(1)10%;(2)光合作用;(3)方向;(4)ABC。
25、【答案】(1)适应;不需要;无成形的细胞核;自动调节
(2)3:5:32;有机物;开发新能源,解决能源紧张问题、减少对环境的污染
(3)4.2×108;4.08×104;压强减小、温度升高
【考点】化学式,阿基米德原理,细菌
【解析】【分析】(1)考察细菌与真菌的结构差异,以及生态系统的自我调节机制;(2)根据可燃冰的化学式,可以分析各元素的质量比;可燃冰属于有机物;(3)根据漂浮状态的二力平衡可以计算出漂浮状态时F浮=G,水中受到的浮力根据阿基米德原理F浮=ρ液gV排计算V排。
【解答】(1)海底地层深处,这些分解有机质的细菌能很好的生存,体现了生物对环境的适应;深海之中缺乏氧气,因此这些细菌分解有机质不需要氧气;细菌与真菌在细胞结构上的主要区别是无成形的细胞核;生态系统具有自动调节机制,以维持生态系统的稳定和平衡;
(2)根据可燃冰的化学式,可以分析各元素的质量比C:H:O=12×1:20×1:16×8=3:5:32;可燃冰属于有机物;开采可燃冰的积极意义有开发新能源,解决能源紧张问题、减少对环境的污染;
(3)钻探平台漂浮海面时二力平衡,此时F浮=G=mg=4.2×107kg×10N/kg=4.2×108N
=
可燃冰可以直接在管口点燃,说明已经成为气体,从固体变成气体的原因是压强减小、温度升高使可燃冰分解了。
故答案为:(1)适应,不需要,无成形的细胞核,自动调节;(2)3:5:32,有机物,开发新能源,解决能源紧张问题、减少对环境的污染;(3)4.2×108
,
4.08×104
,
压强减小、温度升高。
26、【答案】(1)温度
(2)温室效应
(3)碳元素的质量分数=
答:可燃冰中碳元素的质量分数为7.5%。
【考点】化学式
【解析】【分析】可燃冰的储量很丰富,是比较清洁的燃料,有可能成为取代石油、煤的新型燃料。甲烷燃烧生成水和二氧化碳,不污染环境,是一种比较清洁的燃料。天然气和水在低温、高压条件下相互作用能够形成可燃冰,可燃冰的主要成分是甲烷,甲烷燃烧时不污染环境。
【解答】(1)可燃冰是由天然气和水在低温、高压条件下相互作用能够形成,因此影响因素还有温度;
(2)甲烷是温室气体,进入大气会造成温室效应;
故答案为:(1)温度;(2)温室效应;(3)7.5%。
27、【答案】(1)四
(2)72:11
(3)1支
【考点】化学式
【解析】【分析】本题主要考查元素的存在形式,有关化学式和溶液溶质质量分数的计算,了解元素的两种存在形式,掌握相关计算公式是解题的先决条件。根据口服液中的锌的存在形式和葡萄糖酸锌的化学式及元素质量比的含义回答,根据口服液中锌的质量分数计算。
【解答】(1)在补锌口服液中,锌是以C12H22O14Zn的形式存在的,含有四种元素;
(2)在补锌口服液中,锌是以C12H22O14Zn的形式存在的,该口服液中的锌是指锌元素;葡萄糖酸锌的化学式为C12H22O14Zn,其中碳、氢元素的质量比为(12×12):(1×22)=72:11;
(3)1kg体重每日需要0.5mg锌,体重为20kg的儿童每天需要10mg锌,一半来自食物补充即5mg.
而每支含锌5mg,所以仅需1支就可以满足需要。
故答案为:(1)四;(2)72:11;(3)1支。
同课章节目录
