第1章 物质及其变化复习
图片预览





文档简介
(共21张PPT)
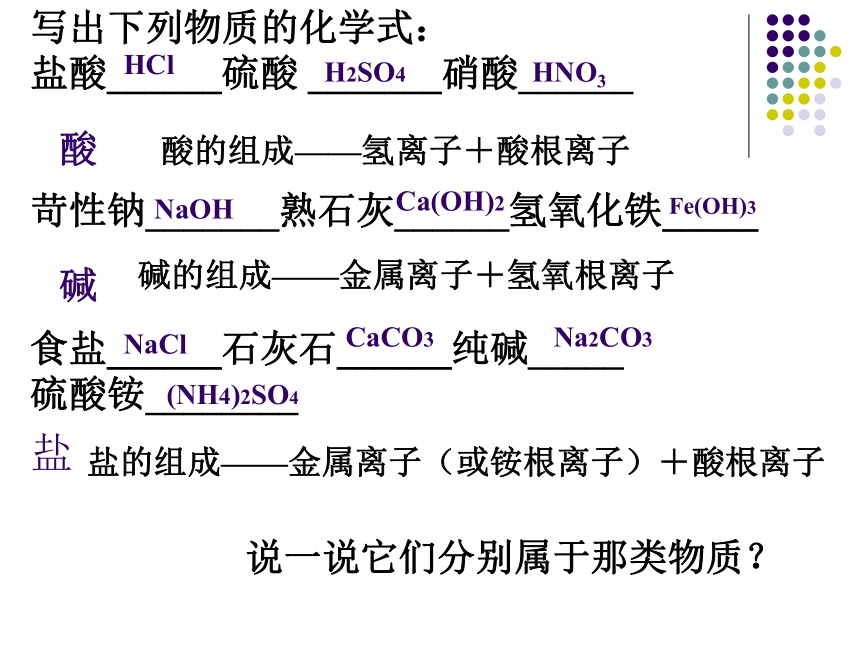
写出下列物质的化学式:
盐酸______硫酸 _______硝酸______
苛性钠_______熟石灰______氢氧化铁_____
食盐______石灰石______纯碱_____
硫酸铵________
说一说它们分别属于那类物质?
酸的组成——氢离子+酸根离子
碱的组成——金属离子+氢氧根离子
盐的组成——金属离子(或铵根离子)+酸根离子
H2SO4
Ca(OH)2
Na2CO3
CaCO3
HCl
NaCl
NaOH
Fe(OH)3
HNO3
(NH4)2SO4
酸
碱
盐
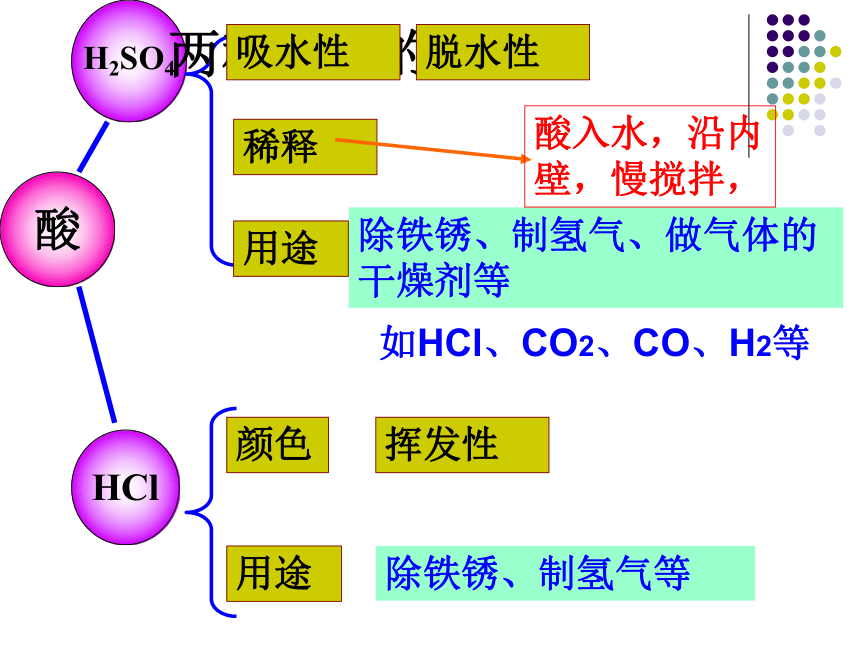
除铁锈、制氢气、做气体的干燥剂等
除铁锈、制氢气等
酸
H2SO4
HCl
稀释
用途
用途
挥发性
颜色
酸入水,沿内壁,慢搅拌,
两种重要的酸
如HCl、CO2、CO、H2等
吸水性
脱水性
干燥剂:做与它不反应 的气体干燥剂
H2、O2、NH3、CO等
制皂、造纸、精炼石油等
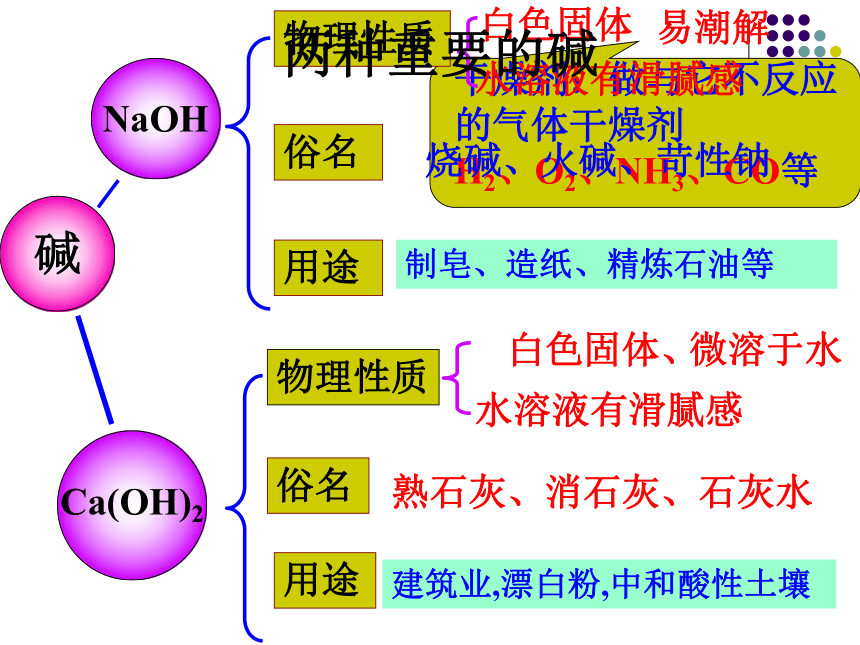
碱
NaOH
Ca(OH)2
物理性质
俗名
用途
俗名
用途
烧碱、火碱、苛性钠
熟石灰、消石灰、石灰水
建筑业,漂白粉,中和酸性土壤
白色固体
易潮解
白色固体、
微溶于水
水溶液有滑腻感
物理性质
水溶液有滑腻感
两种重要的碱
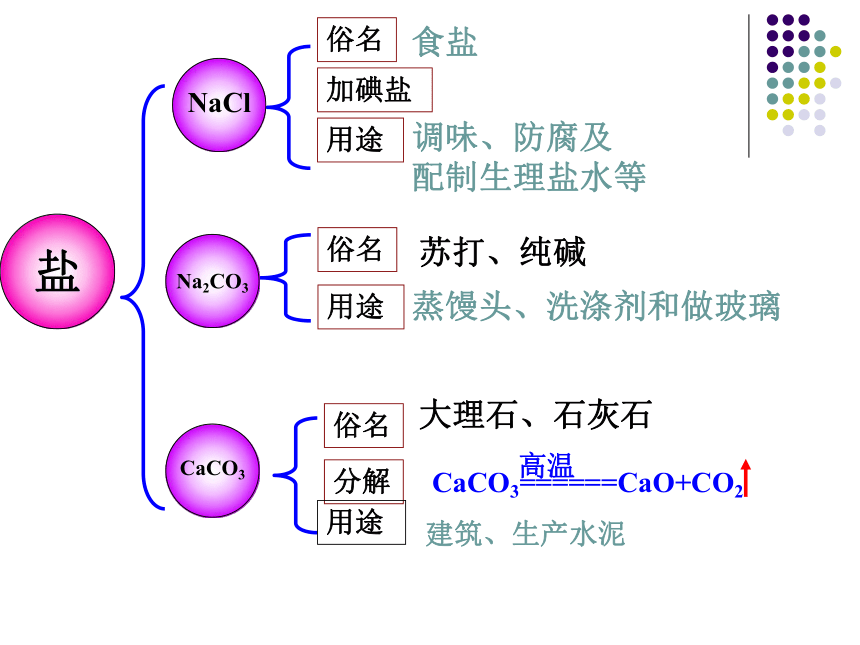
俗名
加碘盐
用途
俗名
用途
盐
CaCO3
Na2CO3
NaCl
苏打、纯碱
大理石、石灰石
CaCO3======CaO+CO2
高温
调味、防腐及
配制生理盐水等
蒸馒头、洗涤剂和做玻璃
分解
俗名
用途
建筑、生产水泥
食盐
指示剂及其显色
紫色石蕊试液
无色酚酞试液
酸性 中性 碱性
红色
无色
紫色
蓝色
无 色
红 色
主板书
酸都可使指示剂变色,但只有可溶性的碱能使指示剂变色
化学性质
1 2 3 4 5 6 7 8 9 10 11 12 13 14
PH值溶液的酸碱度
PH<7 酸
PH=7 盐和水
PH> 7 碱
化肥:氮(N)肥 、磷(P)肥、钾(K)肥
复合肥料
现有盐酸、Ca(OH)2溶液、铁锈 、铁钉 、CO2 、 Na2CO3溶液 、AgNO3 溶液、BaCl2 溶液 、(NH4)2SO4 这些物质,它们之间哪些会反应你知道吗?请分别写出能与盐酸反应的化学方程式。
练一练:
1、 Fe + 2HCl == FeCl2 + H2 ↑
2、 Fe2O3 + 6 HCl = 2Fe (Cl)3 +3 H2O
3、 Ca(OH)2 + 2HCl == CaCl2 + 2H2O
4、 AgNO3 + HCl = AgCl ↓ + HNO3
5、 Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
(中和反应)
(复分解反应)
酸的通性:
1、酸+某些金属——盐+氢气
2、酸+金属氧化物——盐+水
3、酸+碱——盐+水
4、酸+盐——新酸+新盐
5、酸能使紫色石蕊试液变红色,
无色酚酞不变色。
酸为什么具有通性
金属活动性顺序
1、 Ca(OH)2 +2 HCl == CaCl2+ 2H2O
2、 Na2CO3+ Ca (OH)2=CaCO3↓+2NaOH
3、 (NH4)2SO4+Ca(OH)2=CaSO4+2NH3 ↑+H2O
4、Ca(OH)2+CO2= CaCO3↓+ H2O
说一说碱的通性
1、酸+碱——盐+水(中和反应)
2、溶碱+溶盐——新碱+新盐
3、溶碱+酸性氧化物——盐+水
4、碱的水溶液能使紫色石蕊试液变蓝,无色酚酞试液变红
碱为什么具有通性
1、 AgNO3 + HCl = AgCl ↓ + HNO3
2、 Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
3、 Na2CO3+ Ca (OH)2=CaCO3↓+2NaOH
4、 (NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+H2O
5、 BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
6、BaCl2+ Na2CO3= BaCO3 ↓+2NaCl
7、BaCl2 + (NH4)2SO4 = BaSO4 ↓ + 2 NH4Cl
8、 2AgNO3 + Fe = Fe (NO3)2+ 2Ag
说一说盐的性质
1、酸+盐——新酸+新盐
2、溶碱+溶盐——新碱+新盐
4、金属+溶盐——新金属+新盐
3、溶盐+溶盐——新盐+新盐
SO42-
Cl-
CO3 2-
NH4+
思考:如何检验下列含这些离子的物质?
加入BaCl2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
先AgNO3溶液再加稀HNO3
NaOH 或Ca(OH)2微热,放出能使湿润的红色石蕊试纸变篮
H2SO4或 HCl 并将产生的气体通入澄清石灰水
MgSO4+BaCl2=BaSO4↓+MgCl2
AgNO3 + HCl = AgCl ↓ + HNO3
Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+H2O
1、在稀硫酸、浓硫酸、盐酸:具有挥发性的酸——————可做酸性气体干燥剂的酸是——————在空气中敞口放置一段时间后,质量会减小的酸是————————:质量会增加的酸是—— ——。
2、区分稀盐酸和稀硫酸,应选用的药品( )
A、BaCl2溶液 B、NaCl溶液
C、稀HNO3 D、硝酸银溶液
盐酸
浓硫酸
盐酸
浓硫酸
A
3、下列物质既能用浓H2SO4干燥,又能被烧碱干燥的是----------( )
A、CO B、CO2 C、NH3 D、HCl
A
2、工厂烧煤的烟囱冒出的烟气含有SO2,会污染环境,一般可以在烟囱内喷洒氢氧化钠溶液吸收,原因是—————————————,化学方程式是————————————————————————。
1、氢氧化钠暴露在空气中很容易变质,因为氢氧化钠固体不仅容易——————————而且还能吸收————————————发生化学反应而变质;检验氢氧化钠是否变质,可滴加——————————的化学方程式为___________—————————————————
潮解
CO2
稀HCl
SO2被NaOH吸收
2NaOH+SO2===Na2SO3+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2
2、我省某此山地土壤浸出液的pH约为4,这种土壤对农作物生长不利,现要改良它,可以施用下列物质的-------------------------------( )
A、石灰石 B、氢氧化钠 C、熟石灰 D、硝酸钾
C
3、胃液里含有适量的盐酸可以帮助消化。但盐酸过多,人就会感到不舒服。下列物质中,可用作治疗胃酸过多的是-----( )
A.氢氧化钠稀溶液 B.澄清石灰水
C.氢氧化铝 D.食醋
C
3、下列物质不能用于干燥 NH3(氨气)的
是( )
A.无水CuSO4 B.NaOH固体
C.CaO粉末 D.浓H2SO4
D
碱的溶解性:钾、钠、钡、钙微溶,其余碱全不溶。(铵溶)
盐的溶解性:
(1)钾盐、钠盐、铵盐、硝酸盐全溶
(2)氯化物除AgCl不溶外,其余全溶
(3)硫酸盐除BaSO4不溶,其余全溶
( Ag2SO4、 CaSO4微溶)
(4)碳酸盐除钾、钠、铵盐全溶,其余全不溶。 (MgCO3微溶)
物质的颜色:
铜:红色 ;纯铁:银白色,铁粉,黑色
氧化铜(CuO)黑色 ;
三氧化二铁Fe2O3 红色;四氧化三铁Fe3O4 黑色
氢氧化铜Cu(OH)2蓝色沉淀;
氢氧化铁Fe(OH)3红褐色沉淀
溶于水的铜盐溶液(例CuSO 4溶液)蓝色
溶于水的亚铁盐溶液(例FeCl2、 FeSO 4 浅绿色
溶于水的铁盐溶液(例FeCl3)黄色
快速判断下列反应是否能发生:
Cu+HCl Al+HCl
Zn+H2SO 4 Ag+HCl
Cu+AgNO3 Al+NaNO 3
Zn+FeSO 4 Mg+KCl
Fe+Cu(OH)2
物质的颜色:
铜:红色 ;纯铁:银白色,铁粉,黑色
氧化铜(CuO)黑色 ;
三氧化二铁Fe2O3 红色;四氧化三铁Fe3O4 黑色
氢氧化铜Cu(OH)2蓝色沉淀;
氢氧化铁Fe(OH)3红褐色沉淀
溶于水的铜盐溶液(例CuSO 4溶液)蓝色
溶于水的亚铁盐溶液(例FeCl2、 FeSO 4 浅绿色
溶于水的铁盐溶液(例FeCl3)黄色
写出下列物质的化学式:
盐酸______硫酸 _______硝酸______
苛性钠_______熟石灰______氢氧化铁_____
食盐______石灰石______纯碱_____
硫酸铵________
说一说它们分别属于那类物质?
酸的组成——氢离子+酸根离子
碱的组成——金属离子+氢氧根离子
盐的组成——金属离子(或铵根离子)+酸根离子
H2SO4
Ca(OH)2
Na2CO3
CaCO3
HCl
NaCl
NaOH
Fe(OH)3
HNO3
(NH4)2SO4
酸
碱
盐
除铁锈、制氢气、做气体的干燥剂等
除铁锈、制氢气等
酸
H2SO4
HCl
稀释
用途
用途
挥发性
颜色
酸入水,沿内壁,慢搅拌,
两种重要的酸
如HCl、CO2、CO、H2等
吸水性
脱水性
干燥剂:做与它不反应 的气体干燥剂
H2、O2、NH3、CO等
制皂、造纸、精炼石油等
碱
NaOH
Ca(OH)2
物理性质
俗名
用途
俗名
用途
烧碱、火碱、苛性钠
熟石灰、消石灰、石灰水
建筑业,漂白粉,中和酸性土壤
白色固体
易潮解
白色固体、
微溶于水
水溶液有滑腻感
物理性质
水溶液有滑腻感
两种重要的碱
俗名
加碘盐
用途
俗名
用途
盐
CaCO3
Na2CO3
NaCl
苏打、纯碱
大理石、石灰石
CaCO3======CaO+CO2
高温
调味、防腐及
配制生理盐水等
蒸馒头、洗涤剂和做玻璃
分解
俗名
用途
建筑、生产水泥
食盐
指示剂及其显色
紫色石蕊试液
无色酚酞试液
酸性 中性 碱性
红色
无色
紫色
蓝色
无 色
红 色
主板书
酸都可使指示剂变色,但只有可溶性的碱能使指示剂变色
化学性质
1 2 3 4 5 6 7 8 9 10 11 12 13 14
PH值溶液的酸碱度
PH<7 酸
PH=7 盐和水
PH> 7 碱
化肥:氮(N)肥 、磷(P)肥、钾(K)肥
复合肥料
现有盐酸、Ca(OH)2溶液、铁锈 、铁钉 、CO2 、 Na2CO3溶液 、AgNO3 溶液、BaCl2 溶液 、(NH4)2SO4 这些物质,它们之间哪些会反应你知道吗?请分别写出能与盐酸反应的化学方程式。
练一练:
1、 Fe + 2HCl == FeCl2 + H2 ↑
2、 Fe2O3 + 6 HCl = 2Fe (Cl)3 +3 H2O
3、 Ca(OH)2 + 2HCl == CaCl2 + 2H2O
4、 AgNO3 + HCl = AgCl ↓ + HNO3
5、 Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
(中和反应)
(复分解反应)
酸的通性:
1、酸+某些金属——盐+氢气
2、酸+金属氧化物——盐+水
3、酸+碱——盐+水
4、酸+盐——新酸+新盐
5、酸能使紫色石蕊试液变红色,
无色酚酞不变色。
酸为什么具有通性
金属活动性顺序
1、 Ca(OH)2 +2 HCl == CaCl2+ 2H2O
2、 Na2CO3+ Ca (OH)2=CaCO3↓+2NaOH
3、 (NH4)2SO4+Ca(OH)2=CaSO4+2NH3 ↑+H2O
4、Ca(OH)2+CO2= CaCO3↓+ H2O
说一说碱的通性
1、酸+碱——盐+水(中和反应)
2、溶碱+溶盐——新碱+新盐
3、溶碱+酸性氧化物——盐+水
4、碱的水溶液能使紫色石蕊试液变蓝,无色酚酞试液变红
碱为什么具有通性
1、 AgNO3 + HCl = AgCl ↓ + HNO3
2、 Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
3、 Na2CO3+ Ca (OH)2=CaCO3↓+2NaOH
4、 (NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+H2O
5、 BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2
6、BaCl2+ Na2CO3= BaCO3 ↓+2NaCl
7、BaCl2 + (NH4)2SO4 = BaSO4 ↓ + 2 NH4Cl
8、 2AgNO3 + Fe = Fe (NO3)2+ 2Ag
说一说盐的性质
1、酸+盐——新酸+新盐
2、溶碱+溶盐——新碱+新盐
4、金属+溶盐——新金属+新盐
3、溶盐+溶盐——新盐+新盐
SO42-
Cl-
CO3 2-
NH4+
思考:如何检验下列含这些离子的物质?
加入BaCl2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶。
先AgNO3溶液再加稀HNO3
NaOH 或Ca(OH)2微热,放出能使湿润的红色石蕊试纸变篮
H2SO4或 HCl 并将产生的气体通入澄清石灰水
MgSO4+BaCl2=BaSO4↓+MgCl2
AgNO3 + HCl = AgCl ↓ + HNO3
Na2CO3+ 2HCl=2NaCl+H2O+CO2↑
(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+H2O
1、在稀硫酸、浓硫酸、盐酸:具有挥发性的酸——————可做酸性气体干燥剂的酸是——————在空气中敞口放置一段时间后,质量会减小的酸是————————:质量会增加的酸是—— ——。
2、区分稀盐酸和稀硫酸,应选用的药品( )
A、BaCl2溶液 B、NaCl溶液
C、稀HNO3 D、硝酸银溶液
盐酸
浓硫酸
盐酸
浓硫酸
A
3、下列物质既能用浓H2SO4干燥,又能被烧碱干燥的是----------( )
A、CO B、CO2 C、NH3 D、HCl
A
2、工厂烧煤的烟囱冒出的烟气含有SO2,会污染环境,一般可以在烟囱内喷洒氢氧化钠溶液吸收,原因是—————————————,化学方程式是————————————————————————。
1、氢氧化钠暴露在空气中很容易变质,因为氢氧化钠固体不仅容易——————————而且还能吸收————————————发生化学反应而变质;检验氢氧化钠是否变质,可滴加——————————的化学方程式为___________—————————————————
潮解
CO2
稀HCl
SO2被NaOH吸收
2NaOH+SO2===Na2SO3+H2O
Na2CO3+2HCl===2NaCl+H2O+CO2
2、我省某此山地土壤浸出液的pH约为4,这种土壤对农作物生长不利,现要改良它,可以施用下列物质的-------------------------------( )
A、石灰石 B、氢氧化钠 C、熟石灰 D、硝酸钾
C
3、胃液里含有适量的盐酸可以帮助消化。但盐酸过多,人就会感到不舒服。下列物质中,可用作治疗胃酸过多的是-----( )
A.氢氧化钠稀溶液 B.澄清石灰水
C.氢氧化铝 D.食醋
C
3、下列物质不能用于干燥 NH3(氨气)的
是( )
A.无水CuSO4 B.NaOH固体
C.CaO粉末 D.浓H2SO4
D
碱的溶解性:钾、钠、钡、钙微溶,其余碱全不溶。(铵溶)
盐的溶解性:
(1)钾盐、钠盐、铵盐、硝酸盐全溶
(2)氯化物除AgCl不溶外,其余全溶
(3)硫酸盐除BaSO4不溶,其余全溶
( Ag2SO4、 CaSO4微溶)
(4)碳酸盐除钾、钠、铵盐全溶,其余全不溶。 (MgCO3微溶)
物质的颜色:
铜:红色 ;纯铁:银白色,铁粉,黑色
氧化铜(CuO)黑色 ;
三氧化二铁Fe2O3 红色;四氧化三铁Fe3O4 黑色
氢氧化铜Cu(OH)2蓝色沉淀;
氢氧化铁Fe(OH)3红褐色沉淀
溶于水的铜盐溶液(例CuSO 4溶液)蓝色
溶于水的亚铁盐溶液(例FeCl2、 FeSO 4 浅绿色
溶于水的铁盐溶液(例FeCl3)黄色
快速判断下列反应是否能发生:
Cu+HCl Al+HCl
Zn+H2SO 4 Ag+HCl
Cu+AgNO3 Al+NaNO 3
Zn+FeSO 4 Mg+KCl
Fe+Cu(OH)2
物质的颜色:
铜:红色 ;纯铁:银白色,铁粉,黑色
氧化铜(CuO)黑色 ;
三氧化二铁Fe2O3 红色;四氧化三铁Fe3O4 黑色
氢氧化铜Cu(OH)2蓝色沉淀;
氢氧化铁Fe(OH)3红褐色沉淀
溶于水的铜盐溶液(例CuSO 4溶液)蓝色
溶于水的亚铁盐溶液(例FeCl2、 FeSO 4 浅绿色
溶于水的铁盐溶液(例FeCl3)黄色
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
