第2节金属的化学性质
图片预览










文档简介
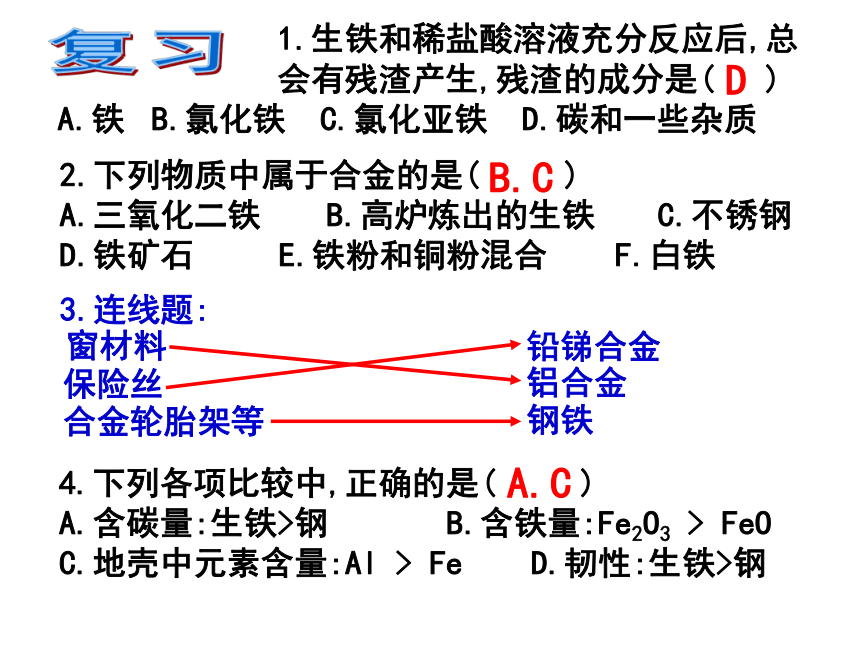
课件45张PPT。 1.生铁和稀盐酸溶液充分反应后,总
会有残渣产生,残渣的成分是( )
A.铁? B.氯化铁 C.氯化亚铁 D.碳和一些杂质2.下列物质中属于合金的是( )
A.三氧化二铁???????B.高炉炼出的生铁??? C.不锈钢
D.铁矿石 E.铁粉和铜粉混合 F.白铁 4.下列各项比较中,正确的是( )
A.含碳量:生铁>钢 B.含铁量:Fe2O3 > FeO
C.地壳中元素含量:Al > Fe D.韧性:生铁>钢A.C复习DB.C2、为什么装食品的罐头一般用镀锡的铁制造,而不用锡制造?锡太软不能制造罐头壳,而镀锡的铁片却能防止铁生锈。银太贵,银太软。第2节 金属的化学性质你已知金属有哪些化学性质?活动1 :将镁条和铜条放在酒精灯上加热,哪根金属先燃烧?
不燃烧的金属冷却后表面的颜色发生了什么变化? 镁条表面变黑金属的化学性质金属的化学性质1:1、K Ca Na在常温下与氧气发生反应生成金属氧化物。
2、 Mg Al Zn Fe在点燃的条件下与氧气发生反应生成金属氧化物。
3、 Cu在加热的条件下与氧气发生反应生成金属氧化物。
4、Pt Au不与氧气反应。常温下某些活泼的金属(如:Mg、Al、Fe)也能在空气中发生缓慢氧化反应,在表面形成一层保护膜。例如:
1、铝在常温下能与氧气发生缓慢氧化反应,生成一层致密的氧化铝保护膜,从而阻止铝进一步氧化
2、铁在潮湿的空气里会被空气中的氧气缓慢氧化生成铁锈(主要成分是氧化铁) 铁在氧气里燃烧会生成黑色的四氧化三铁,铁在潮湿的里空气里容易锈蚀,生成棕黄色的铁锈(主要成分是氧化铁)。这说明什么?思考 同种物质在不同的条件下发生化学反应会生成不同的物质。 活动2: 将铝片放入盛有稀盐酸的试管中,观察并记录现象:__________________________铝片表面产生大量的气泡思考:铝制容器可不可以盛放酸性或碱性物质?为什么?2Al+6HCl ====2AlCl3+ 3H2↑注意:切不可用铝制容器盛酸性或碱性物质思考:是否所有的金属都能
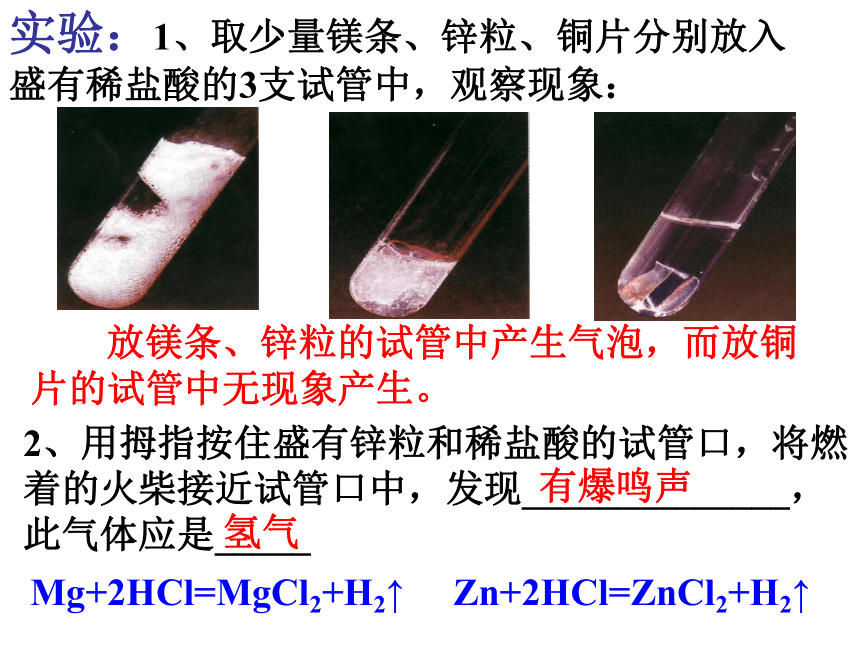
被酸腐蚀?实验:1、取少量镁条、锌粒、铜片分别放入盛有稀盐酸的3支试管中,观察现象: 放镁条、锌粒的试管中产生气泡,而放铜片的试管中无现象产生。Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑2、用拇指按住盛有锌粒和稀盐酸的试管口,将燃着的火柴接近试管口中,发现______________,此气体应是_____有爆鸣声氢气实验:3、取少量镁条、锌粒、铜片分别放入盛有稀硫酸的3支试管中,观察现象: 放镁条、锌粒的试管中产生气泡,而放铜片的试管中无现象产生。Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑4、镁、锌、铜三种金属中,跟稀盐酸、稀硫酸不发生反应的金属是 。铜金属的化学性质2:Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Cu与稀HCl不反应Mg+H2SO4=MgSO4+H2↑Cu与稀H2SO4不反应Zn+H2SO4=ZnSO4+H2↑思考 置换反应:由一种单质跟一种化合物起反应生成另一种单质和另一种化合物的反应。Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑下述几个反应有什么共同点?单质+化合物=化合物+单质A+BC=B+ACMg + H2SO4 = MgSO4 + H2↑互相交换位置置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。A + BC = B + AC请思考?置换反应与前面所学的化合反应、分解反应、复分解反应有什么关系?比较:四种基本反应类型两种或两种以上两种或两种以上两种化合物一种单质和一种化合物一种一种两种新化合物一种新单质和一种新化合物 四种反应并列存在,合称为
四大基本反应类型判断下列反应的基本反应类型6.H2+CuO===Cu+H2O
7.CO+CuO===Cu+CO2↑
8.Zn+2HCl===ZnCl2+H2↑
化合反应化合反应分解反应置换反应置换反应置换反应X置换反应[08海南]1. 海藻中含有丰富的碘,“2NaI+Cl2==2NaCl+I2”是实验室从海藻中提取碘单质的反应方程式,它属于( )
A.置换反应 B.分解反应
C.化合反应 D.复分解反应
[08江西晋江]2.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:
4HF+SiO2=SiF4↑+2H2O,该反应属于( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应AD探究:比较铁与铜、铜与银的化学活动性1.提出问题:一种金属浸入另一种金属的盐溶液中,相互之间能发生反应吗?2.建立假设:一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。3.设计方案:
(1)Fe和Cu的活动性比较:
(2)Cu和Ag的活动性比较:CuSO4溶液中放入铁丝FeSO4中浸入一段铜丝AgNO3溶液中放入铜丝CuSO4溶液中放入铁丝
FeSO4中浸入一段铜丝Fe+CuSO4=Cu+FeSO4铁丝表面有红色物质生成
无现象说明:铁可以将铜从其盐溶液中置换出来,但铜不能置换铁。
原因:活泼性 Fe > Cu金属+盐=新盐+新金属4.实验过程:AgNO3溶液中放入铜丝
Cu+2AgNO3=Cu(NO3)2+2Ag铜丝表面有银白色物质生成
说明:铜可以将银从其盐溶液中置换出来。
原因:活泼性 Cu > Ag4.实验过程:5.得出结论并交流:根据以上实验事实,铁与铜、铜与银的化学活动性是:___________________.Fe > Cu > Ag 根据刚才实验比较镁、锌、铜的活泼程度(金属活动性),并从大到小列出镁、锌、铜的活动性顺序。如果把氢也列入其中,应如何排列?Mg>Zn>H>Cu 根据金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可反映金属的活泼程度,即金属活动性。金属活泼性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活泼性逐渐减弱助你记忆(右脑记忆):嫁给那美女,新帖四千,统共一百斤应用及注意:K、Ca、Na非常活泼,可以从水中将氢置换出来,所以写化学方程式时不能用K、Ca、Na去置换其它的金属
氢以前的金属可与酸置换出氢气
排在前面的金属可以将排在后面的金属从其盐溶液中置换出来你知道湿法炼铜原理是什么?能用化学方程式表示吗?思考:Fe+CuSO4=Cu+FeSO4根据金属活动性顺序表判断能否用锡壶装酸性物质?
能否用铁制的容器配制波尔多液?为什么?思考: 实验室制取氢气选择什么药品最适宜?选择浓盐酸有什么不好?选择稀硫酸和铜反应可以吗? 实验室制取氢气常用锌与盐酸、稀硫酸反应。
用浓盐酸制取氢气,会使制得的氢气不纯(因为浓盐酸有挥发性)
铜与稀硫酸不反应。铜与浓硫酸反应不生成氢气。 思考 31.为了验证Cu、Zn、Hg三种金属的活动顺序,小林同学设计了如下实验:
①将锌粒放人CuSO4溶液中,锌粒表面出现红色固体;
②将锌片插人Hg(NO3)2溶液中一会儿取出,锌片表面出现银白色金属;
③将铜丝插入ZnSO4溶液中,无明显现象。
(1)小林同学得出的结论是_______________,要得出三种金属的活动顺序,小林还应该做的实验是_____________________。
(2)为了使实验尽量简化,我认为可用____________步实验就能得出结论,实验内容是________________________________。
锌比铜活泼,锌比汞活泼把铜片放入Hg(NO3)2溶液26.(6分)钛(Ti)是一种重要的航天金属材料。某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究。过程如下:
[提出假设]a、Ti金属活动性比Al强。 b、Al金属活动性比Cu强。
[查阅资料]钛能与盐酸反应。
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。 .
[操作分析]三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是______________。
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使反应金属温度相同,易反应
[实验现象]
[实验结论](1)原假设中_____不正确(填“a”、“b”或“ab”)。
(2)三种金属的金属活动性由强至弱的顺序为_____________。
[结论应用]能否用铝制容器来盛装波尔多液(含硫酸铜)_______________。
AaAl>Ti>Cu不能5.著名化学家侯德榜的“侯氏制碱法”对传统的纯
碱生产技术进行 了大胆革新,成为当时世界上
最先进的制碱法。纯碱是重要的 化工产品,用
途广泛。现以纯碱、石灰石、水三种物质为原料
制取氢氧化钠,所发生的化学反应中不包括( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应C石灰石:CaCO3 碳酸钠:Na2CO3 水:H2O 氢氧化钠:NaOH
第一步 高温煅烧石灰石:CaCO3=高温=CaO+CO2↑ 第二步 生石灰和水化合:CaO+H2O=Ca(OH)2 第三步 碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 7、下列化学反应中,不属于置换的反应的是( ) A、 Fe+CuSO4===Cu+FeSO4 B、 2Al+3H2SO4==Al2(SO4)3+3H2 C、 Mg+2HCl==MgCl2+H2 D、 CO+CuO===Cu+CO2↑ D
下列图表表示正确的是( )5、质量相同的镁、锌和足量的稀盐酸完全反应,产生的氢气 多,产生氢气 快。镁镁B6、等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是m
C每年由于锈蚀而直接损失的钢铁材料占年产钢铁的四分之一那么生活中有没有对铁生锈的利用呢?实验:金属锈蚀的条件有哪些?如何用实验验证?(外/内 条件)2.提供的器材:带塞子的试管若干支,普通铁片若干,蒸馏水,干燥剂。1.分析各种猜测的可能性。锈蚀的条件有:空气、水3.根据所提供的器材,设计实验方案,以验证锈蚀的条件,并画出装置图A:普通铁片,水、空气
B:普通铁片,空气。(内有干燥剂)
C:普通铁片,蒸馏水。(无空气)4. 比较( B与A ,C 与A ):铁锈蚀的外部条件是:
______________________。同时具备空气和水。5、利用纯铁(D)按上述方案进行实验,纯铁生锈了吗,为什么?6. 比较( D与A ):铁锈蚀的内部条件是:
______________________。与内部结构有关1.金属的生锈的原因:1) 与周围环境中的水和空气等物质的 作用有关 。2) 与金属内部的结构有关。三、防止金属锈蚀的常用方法2.金属的防锈的方法:1)保护膜法:2)改变金属内部结构法:讨论:根据金属锈蚀的条件,讨论金属防护的常用方法?
调查生活中常用的金属防腐蚀的措施。1、保护膜法:(外部措施)油漆、搪瓷、金属镀层、氧化膜法2、改变金属内部结构法:(内部措施)热敷袋铁粉干燥剂(双吸剂)饼干等食品里面的生石灰干燥剂设计实验除去杂质:铜粉中含有少量的铁粉
FeCl2中含有少量的CuCl2
除杂原则:将杂质从样品中分离出去。可将其直接过滤或转变成其它成分过滤或转变成主体成分除去。
铁粉可以直接用磁铁(物理方法),化学方法:利用铁可以和稀盐酸反应而铜不可以,将铁通过反应而消耗,最终过滤得到铜。只能用化学方法:利用铁可以和CuCl2反应而不可以和FeCl2反应,并且反应后,CuCl2被转化为FeCl2,置换出来的铜通过过滤而除去。 Fe+2HCl=FeCl2+H2↑ Fe+CuCl2=Cu+FeCl2已知排在金属活动性顺序表最前几位的活泼金属能与水反应生成碱和氢气,请写出下列反应的方程式,并推测可能产生的实验现象:把一块金属钠放入1小杯滴有酚酞的水中
将一小块金属钾放入1小杯硫酸铜溶液中
会有残渣产生,残渣的成分是( )
A.铁? B.氯化铁 C.氯化亚铁 D.碳和一些杂质2.下列物质中属于合金的是( )
A.三氧化二铁???????B.高炉炼出的生铁??? C.不锈钢
D.铁矿石 E.铁粉和铜粉混合 F.白铁 4.下列各项比较中,正确的是( )
A.含碳量:生铁>钢 B.含铁量:Fe2O3 > FeO
C.地壳中元素含量:Al > Fe D.韧性:生铁>钢A.C复习DB.C2、为什么装食品的罐头一般用镀锡的铁制造,而不用锡制造?锡太软不能制造罐头壳,而镀锡的铁片却能防止铁生锈。银太贵,银太软。第2节 金属的化学性质你已知金属有哪些化学性质?活动1 :将镁条和铜条放在酒精灯上加热,哪根金属先燃烧?
不燃烧的金属冷却后表面的颜色发生了什么变化? 镁条表面变黑金属的化学性质金属的化学性质1:1、K Ca Na在常温下与氧气发生反应生成金属氧化物。
2、 Mg Al Zn Fe在点燃的条件下与氧气发生反应生成金属氧化物。
3、 Cu在加热的条件下与氧气发生反应生成金属氧化物。
4、Pt Au不与氧气反应。常温下某些活泼的金属(如:Mg、Al、Fe)也能在空气中发生缓慢氧化反应,在表面形成一层保护膜。例如:
1、铝在常温下能与氧气发生缓慢氧化反应,生成一层致密的氧化铝保护膜,从而阻止铝进一步氧化
2、铁在潮湿的空气里会被空气中的氧气缓慢氧化生成铁锈(主要成分是氧化铁) 铁在氧气里燃烧会生成黑色的四氧化三铁,铁在潮湿的里空气里容易锈蚀,生成棕黄色的铁锈(主要成分是氧化铁)。这说明什么?思考 同种物质在不同的条件下发生化学反应会生成不同的物质。 活动2: 将铝片放入盛有稀盐酸的试管中,观察并记录现象:__________________________铝片表面产生大量的气泡思考:铝制容器可不可以盛放酸性或碱性物质?为什么?2Al+6HCl ====2AlCl3+ 3H2↑注意:切不可用铝制容器盛酸性或碱性物质思考:是否所有的金属都能
被酸腐蚀?实验:1、取少量镁条、锌粒、铜片分别放入盛有稀盐酸的3支试管中,观察现象: 放镁条、锌粒的试管中产生气泡,而放铜片的试管中无现象产生。Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑2、用拇指按住盛有锌粒和稀盐酸的试管口,将燃着的火柴接近试管口中,发现______________,此气体应是_____有爆鸣声氢气实验:3、取少量镁条、锌粒、铜片分别放入盛有稀硫酸的3支试管中,观察现象: 放镁条、锌粒的试管中产生气泡,而放铜片的试管中无现象产生。Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑4、镁、锌、铜三种金属中,跟稀盐酸、稀硫酸不发生反应的金属是 。铜金属的化学性质2:Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Cu与稀HCl不反应Mg+H2SO4=MgSO4+H2↑Cu与稀H2SO4不反应Zn+H2SO4=ZnSO4+H2↑思考 置换反应:由一种单质跟一种化合物起反应生成另一种单质和另一种化合物的反应。Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑下述几个反应有什么共同点?单质+化合物=化合物+单质A+BC=B+ACMg + H2SO4 = MgSO4 + H2↑互相交换位置置换反应:一种单质和一种化合物反应生成另一种单质和另一种化合物的反应。A + BC = B + AC请思考?置换反应与前面所学的化合反应、分解反应、复分解反应有什么关系?比较:四种基本反应类型两种或两种以上两种或两种以上两种化合物一种单质和一种化合物一种一种两种新化合物一种新单质和一种新化合物 四种反应并列存在,合称为
四大基本反应类型判断下列反应的基本反应类型6.H2+CuO===Cu+H2O
7.CO+CuO===Cu+CO2↑
8.Zn+2HCl===ZnCl2+H2↑
化合反应化合反应分解反应置换反应置换反应置换反应X置换反应[08海南]1. 海藻中含有丰富的碘,“2NaI+Cl2==2NaCl+I2”是实验室从海藻中提取碘单质的反应方程式,它属于( )
A.置换反应 B.分解反应
C.化合反应 D.复分解反应
[08江西晋江]2.氢氟酸可用于在玻璃上雕刻各种精美图案,雕刻过程中发生的反应为:
4HF+SiO2=SiF4↑+2H2O,该反应属于( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应AD探究:比较铁与铜、铜与银的化学活动性1.提出问题:一种金属浸入另一种金属的盐溶液中,相互之间能发生反应吗?2.建立假设:一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。3.设计方案:
(1)Fe和Cu的活动性比较:
(2)Cu和Ag的活动性比较:CuSO4溶液中放入铁丝FeSO4中浸入一段铜丝AgNO3溶液中放入铜丝CuSO4溶液中放入铁丝
FeSO4中浸入一段铜丝Fe+CuSO4=Cu+FeSO4铁丝表面有红色物质生成
无现象说明:铁可以将铜从其盐溶液中置换出来,但铜不能置换铁。
原因:活泼性 Fe > Cu金属+盐=新盐+新金属4.实验过程:AgNO3溶液中放入铜丝
Cu+2AgNO3=Cu(NO3)2+2Ag铜丝表面有银白色物质生成
说明:铜可以将银从其盐溶液中置换出来。
原因:活泼性 Cu > Ag4.实验过程:5.得出结论并交流:根据以上实验事实,铁与铜、铜与银的化学活动性是:___________________.Fe > Cu > Ag 根据刚才实验比较镁、锌、铜的活泼程度(金属活动性),并从大到小列出镁、锌、铜的活动性顺序。如果把氢也列入其中,应如何排列?Mg>Zn>H>Cu 根据金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可反映金属的活泼程度,即金属活动性。金属活泼性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活泼性逐渐减弱助你记忆(右脑记忆):嫁给那美女,新帖四千,统共一百斤应用及注意:K、Ca、Na非常活泼,可以从水中将氢置换出来,所以写化学方程式时不能用K、Ca、Na去置换其它的金属
氢以前的金属可与酸置换出氢气
排在前面的金属可以将排在后面的金属从其盐溶液中置换出来你知道湿法炼铜原理是什么?能用化学方程式表示吗?思考:Fe+CuSO4=Cu+FeSO4根据金属活动性顺序表判断能否用锡壶装酸性物质?
能否用铁制的容器配制波尔多液?为什么?思考: 实验室制取氢气选择什么药品最适宜?选择浓盐酸有什么不好?选择稀硫酸和铜反应可以吗? 实验室制取氢气常用锌与盐酸、稀硫酸反应。
用浓盐酸制取氢气,会使制得的氢气不纯(因为浓盐酸有挥发性)
铜与稀硫酸不反应。铜与浓硫酸反应不生成氢气。 思考 31.为了验证Cu、Zn、Hg三种金属的活动顺序,小林同学设计了如下实验:
①将锌粒放人CuSO4溶液中,锌粒表面出现红色固体;
②将锌片插人Hg(NO3)2溶液中一会儿取出,锌片表面出现银白色金属;
③将铜丝插入ZnSO4溶液中,无明显现象。
(1)小林同学得出的结论是_______________,要得出三种金属的活动顺序,小林还应该做的实验是_____________________。
(2)为了使实验尽量简化,我认为可用____________步实验就能得出结论,实验内容是________________________________。
锌比铜活泼,锌比汞活泼把铜片放入Hg(NO3)2溶液26.(6分)钛(Ti)是一种重要的航天金属材料。某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究。过程如下:
[提出假设]a、Ti金属活动性比Al强。 b、Al金属活动性比Cu强。
[查阅资料]钛能与盐酸反应。
[实验设计]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象。 .
[操作分析]三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是______________。
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使反应金属温度相同,易反应
[实验现象]
[实验结论](1)原假设中_____不正确(填“a”、“b”或“ab”)。
(2)三种金属的金属活动性由强至弱的顺序为_____________。
[结论应用]能否用铝制容器来盛装波尔多液(含硫酸铜)_______________。
AaAl>Ti>Cu不能5.著名化学家侯德榜的“侯氏制碱法”对传统的纯
碱生产技术进行 了大胆革新,成为当时世界上
最先进的制碱法。纯碱是重要的 化工产品,用
途广泛。现以纯碱、石灰石、水三种物质为原料
制取氢氧化钠,所发生的化学反应中不包括( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应C石灰石:CaCO3 碳酸钠:Na2CO3 水:H2O 氢氧化钠:NaOH
第一步 高温煅烧石灰石:CaCO3=高温=CaO+CO2↑ 第二步 生石灰和水化合:CaO+H2O=Ca(OH)2 第三步 碳酸钠和石灰水:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 7、下列化学反应中,不属于置换的反应的是( ) A、 Fe+CuSO4===Cu+FeSO4 B、 2Al+3H2SO4==Al2(SO4)3+3H2 C、 Mg+2HCl==MgCl2+H2 D、 CO+CuO===Cu+CO2↑ D
下列图表表示正确的是( )5、质量相同的镁、锌和足量的稀盐酸完全反应,产生的氢气 多,产生氢气 快。镁镁B6、等质量的镁片和铝片分别与足量的稀硫酸反应,产生氢气的质量(m)与时间(t)的关系图正确的是m
C每年由于锈蚀而直接损失的钢铁材料占年产钢铁的四分之一那么生活中有没有对铁生锈的利用呢?实验:金属锈蚀的条件有哪些?如何用实验验证?(外/内 条件)2.提供的器材:带塞子的试管若干支,普通铁片若干,蒸馏水,干燥剂。1.分析各种猜测的可能性。锈蚀的条件有:空气、水3.根据所提供的器材,设计实验方案,以验证锈蚀的条件,并画出装置图A:普通铁片,水、空气
B:普通铁片,空气。(内有干燥剂)
C:普通铁片,蒸馏水。(无空气)4. 比较( B与A ,C 与A ):铁锈蚀的外部条件是:
______________________。同时具备空气和水。5、利用纯铁(D)按上述方案进行实验,纯铁生锈了吗,为什么?6. 比较( D与A ):铁锈蚀的内部条件是:
______________________。与内部结构有关1.金属的生锈的原因:1) 与周围环境中的水和空气等物质的 作用有关 。2) 与金属内部的结构有关。三、防止金属锈蚀的常用方法2.金属的防锈的方法:1)保护膜法:2)改变金属内部结构法:讨论:根据金属锈蚀的条件,讨论金属防护的常用方法?
调查生活中常用的金属防腐蚀的措施。1、保护膜法:(外部措施)油漆、搪瓷、金属镀层、氧化膜法2、改变金属内部结构法:(内部措施)热敷袋铁粉干燥剂(双吸剂)饼干等食品里面的生石灰干燥剂设计实验除去杂质:铜粉中含有少量的铁粉
FeCl2中含有少量的CuCl2
除杂原则:将杂质从样品中分离出去。可将其直接过滤或转变成其它成分过滤或转变成主体成分除去。
铁粉可以直接用磁铁(物理方法),化学方法:利用铁可以和稀盐酸反应而铜不可以,将铁通过反应而消耗,最终过滤得到铜。只能用化学方法:利用铁可以和CuCl2反应而不可以和FeCl2反应,并且反应后,CuCl2被转化为FeCl2,置换出来的铜通过过滤而除去。 Fe+2HCl=FeCl2+H2↑ Fe+CuCl2=Cu+FeCl2已知排在金属活动性顺序表最前几位的活泼金属能与水反应生成碱和氢气,请写出下列反应的方程式,并推测可能产生的实验现象:把一块金属钠放入1小杯滴有酚酞的水中
将一小块金属钾放入1小杯硫酸铜溶液中
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
