3.3《常见的盐》(课时1)同步练习
文档属性
| 名称 | 3.3《常见的盐》(课时1)同步练习 |

|
|
| 格式 | doc | ||
| 文件大小 | 532.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2017-09-19 17:29:00 | ||
图片预览



文档简介
21世纪教育网 –中小学教育资源及组卷应用平台
《常见的盐》练习(第一课时)
1、 选择题
1、人的红细胞必须生活在含有0.9%的氯 ( http: / / www.21cnjy.com )化钠的溶液中,医生常给脱水病人注射0.9%的生理盐水.因为红细胞在蒸馏水中会因吸水过多而胀破,在浓盐水中会因失水过多而皱缩,从而失去输送氧的功能,这说明( )21教育网
A、水分子容易进出细胞
B、无机盐离子容易进出细胞
C、红细胞的特性造成的
D、无机盐对维持细胞的形态和功能有重要的作用
2、2015年1月15日,海珠陈女士一家六 ( http: / / www.21cnjy.com )口人饭后出现亚硝酸盐中毒,并被送往医院紧急治疗.亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体.请结合下表信息判断,下列区别亚硝酸钠和氯化钠方法错误的是( )21cnjy.com
亚硝酸钠(NaNO2) 氯化钠(NaCl)
跟稀盐酸作用 放出红棕色的气体 无反应
跟硝酸银溶液作用 生成浅黄色沉淀 生成白色沉淀
A、滴加稀盐酸
B、加热
C、滴加硝酸银溶液
D、加水溶解
3、由于我国北方某些城市在严冬时节曾用食盐 ( http: / / www.21cnjy.com )融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡.目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( ) 【来源:21·世纪·教育·网】
A、氯化钠 氯化钙
B、氯化钠 氯化镁
C、氯化钠 醋酸钙 醋酸镁
D、尿素 硝酸钙 硝酸镁
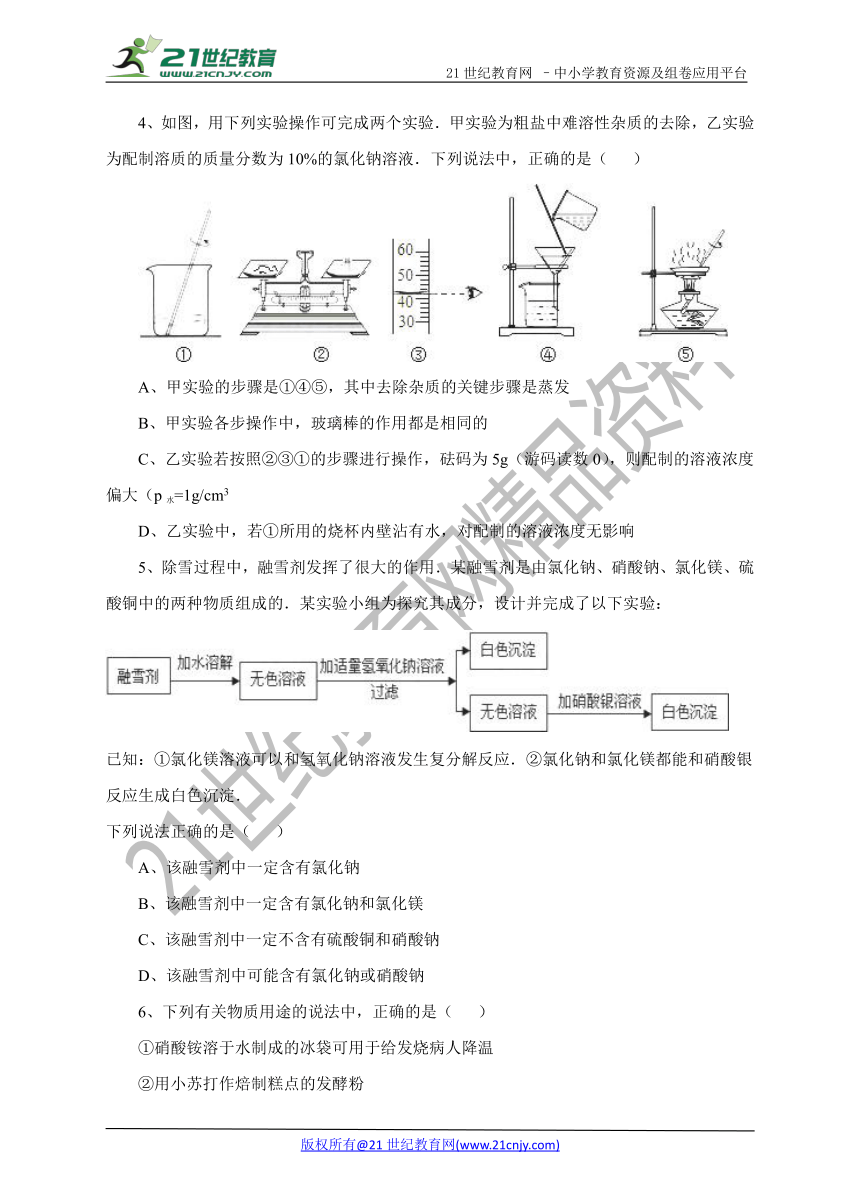
4、如图,用下列实验操作可 ( http: / / www.21cnjy.com )完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )
( http: / / www.21cnjy.com / )
A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B、甲实验各步操作中,玻璃棒的作用都是相同的
C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3【版权所有:21教育】
D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
5、除雪过程中,融雪剂发挥了很大的作用.某融雪剂是由氯化钠、硝酸钠、氯化镁、硫酸铜中的两种物质组成的.某实验小组为探究其成分,设计并完成了以下实验:
( http: / / www.21cnjy.com / )
已知:①氯化镁溶液可以和氢氧化钠溶液发生复分解反应.②氯化钠和氯化镁都能和硝酸银反应生成白色沉淀.
下列说法正确的是( )
A、该融雪剂中一定含有氯化钠
B、该融雪剂中一定含有氯化钠和氯化镁
C、该融雪剂中一定不含有硫酸铜和硝酸钠
D、该融雪剂中可能含有氯化钠或硝酸钠
6、下列有关物质用途的说法中,正确的是( )
①硝酸铵溶于水制成的冰袋可用于给发烧病人降温
②用小苏打作焙制糕点的发酵粉
③厨房洗涤剂有溶解油脂的作用
④用氯化钠来消除公路上的积雪.21*cnjy*com
A、①③④
B、①②④
C、②③④
D、①②③④
7、下列叙述正确的是( )
A、实验室配制一定质量分数的氯化钠溶液的主要步骤为:计算、称量、溶解、转移
B、粗盐提纯实验中,蒸发食盐水时玻璃棒的作用主要是加快蒸发的速率
C、配制一定质量分数的氯化钠溶液,量水时仰视读数,则所配溶液的溶质质量分数偏大
D、粗盐提纯实验中,溶解粗盐时,要加入大量的水,防止食盐不完全溶解
8、盐在人体的新陈代谢中十分重要,它可以维持血液中适当的酸碱度,并通过人体复杂的作用,产生消化液,帮助消化.这里的盐是指()
A、氯化钠
B、硫化钠
C、氯化钙
D、氯化镁
9、关于生活中常见的盐,下列说法不正确的是()
A.碳酸钙可用作补钙剂
B.硫酸铜溶液可以作为自来水的消毒剂
C.食盐可用于调味和腌渍蔬菜、鱼、肉等
D.小苏打是焙制糕点所用的发酵粉的主要成分之一
二、非选择题
10、已知X为中学化学中一种常见的盐, ( http: / / www.21cnjy.com )F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
请回答下列问题;www.21-cn-jy.com
(1)E的化学式为
Fe2O3
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是
(3)在反应①②③④中属于置换反应的是 (填序号)①③
11、Na2CO3、NaHCO3是 ( http: / / www.21cnjy.com )生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:Na2CO3、NaHCO3的水溶液呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2).21·世纪*教育网
(1)称取两种固体各1g分别放入两支试管中,再加入5mL水,振荡.固体充分溶解,并恢复至室温;
①发现Na2CO3完全溶解,而NaHCO3有剩余.由此得出结论:在相同温度下,
②向所得溶液中各滴入1~2滴酚酞溶液后,溶液均呈 色红
(2)①取少量NaHCO3按如图装 ( http: / / www.21cnjy.com )置进行实验,可观察带的现象是:大试管口有水珠生成②用 的方法除去混在Na2CO3粉末中少量的NaHCO3加热
(3)测定Na2CO3样品(含NaCl杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯中加水溶解;
②加入过量的CaCl2溶液充分反应,反应的化 ( http: / / www.21cnjy.com )学方程式为 ;证明反应后CaCl2有剩余的方法是
③过滤、洗涤、干燥,称量测定的质量为ng.则样品中Na2CO3的质量分数为
Na2CO3+CaCl2=CaCO3↓12、地球是一颗蓝色的星球 ( http: / / www.21cnjy.com ),表面大部分被海洋覆盖,海水中蕴含的元素多达80多种.通过海水晒制可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。
( http: / / www.21cnjy.com / )
以下是一种制备精盐的实验方案,步骤如下:
回答下列问题:
(1)小星对粗盐进行初步提纯第Ⅰ步进行 操作。过滤
(2)小明在第Ⅱ步中,欲 ( http: / / www.21cnjy.com )将MgCl2去除,选择添加NaOH溶液,请写出该反应的化学方程式 .但小亮同学对小明设想提出不同意见,他认为应该用Ca(OH)2代替NaOH,理由是 2NaOH+MgCl2=Mg(OH)2↓+2NaCl
(3)小琴对第Ⅲ步进行实验,要将溶液中 ( http: / / www.21cnjy.com )的Ca2+沉淀出来,必然加一种常见的盐,该盐为 ,反应化学方程式为 ,该盐要加过量的目的是 ,据此分析,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有 Na2CO3
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)第Ⅳ步中,小琴加入过量盐酸,除去 ( http: / / www.21cnjy.com )溶液中所有杂质后,认为过量的盐酸也并不是新引入的杂质,经过加热蒸发,盐酸也可以除去,小琴利用了盐酸的 性
《常见的盐》(第一课时)参考答案
1、【答案】D
【解析】由题意知,红细胞在含有0. ( http: / / www.21cnjy.com )9%的氯化钠的溶液中形态不会改变,在蒸馏水中红细胞会因吸水过多而胀破,在浓盐水中红细胞会因为失水而皱缩,这说明一定浓度的无机盐对于维持渗透压保持细胞的形态和和功能稳定具有重要作用.www-2-1-cnjy-com
故选:D.
2、【答案】D
【解析】A、滴加稀盐酸,根据信息知亚硝酸钠放出红棕色气体,而氯化钠不反应,所以A正确.B、加热,根据题干知亚硝酸加热会分解,且放出有臭味的气体,而氯化钠受热 ( http: / / www.21cnjy.com / )故选D.21*cnjy*com
3、【答案】D
【解析】解题的突破口在于对树木起到施肥养护的作用,在四个选项中只有D选项含有常用的化肥尿素,而其它选项均未找的可以作为树木肥料的物质.
故选D.
4、【答案】C
【解析】A.粗盐中难溶性杂质的去除的操作 ( http: / / www.21cnjy.com )步骤是溶解、过滤、蒸发,即步骤是①④⑤,其中去除杂质的关键一步是过滤(把不溶于液体的固体与液体分离的一种方法),故A错误; B.甲实验各步操作中,溶解时玻璃棒的作用是搅拌,能够加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体飞溅;玻璃棒的作用不相同,故B错误;C.量取的水为42g,由溶质质量分数的公式可知,会导致配制的溶液浓度偏大,故C正确;D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大,则会导致配制的溶液浓度偏小,故D错误.21世纪教育网版权所有
故选C.
5、【答案】D
【解析】融雪剂加水溶解得无色溶液,说明无硫酸铜,加氢氧化钠溶液生成白色沉淀,说明含有氯化镁,氯化钠和硝酸钠是否含有无法确定;21教育名师原创作品
故选D
6、【答案】B
( http: / / www.21cnjy.com / )故选B.
7、【答案】A
【解析】A、实验室配制一定质量分数的 ( http: / / www.21cnjy.com )氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、转移,故选项说法正确.B、粗盐提纯实验中,蒸发食盐水时玻璃棒的作用主要是搅拌,以防止局部温度过高,造成液体飞溅,故选项说法错误.C、配制一定质量分数的氯化钠溶液,量水时仰视读数,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项说法错误.D、溶解粗盐时,不能加入大量的水,溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,故选项说法错误.2·1·c·n·j·y
故选:A.
8、【答案】C
【解析】A、碳酸盐中加入氯化银再加入稀 ( http: / / www.21cnjy.com )硝酸,可知化学方程式:Na2CO +2AgNO = Ag CO ↓ + 2NaNO ;Ag CO +2HNO =2AgNO +H O+CO ↑,由此可知,现象为先有沉淀,然后沉淀消失。B、碳酸盐中加入氯化钡再加入稀硝酸,可知化学方程式:
Na2CO +BaCl =B ( http: / / www.21cnjy.com )aCO ↓+2NaCl;BaCO +2HNO =Ba(NO ) +H O+CO ↑ ,由此可知,现象为先有沉淀,然后沉淀消失。C、氯化银、氯化钡来检验盐酸盐和硫酸盐的时候,还要加入稀硝酸,才能够证明;D、加入氯化银生成沉淀没办法鉴定原溶液有盐酸盐,因为没加稀硝酸的时候,碳酸盐也可以有该现象。【来源:21cnj*y.co*m】
故选:C.
9、【答案】B
( http: / / www.21cnjy.com / )故选B.
10、【答案】(1)Fe2O3
(2)铁丝上附有红色物质,溶液颜色逐渐变为浅绿色,
(3)①③
【解析】X为中学化学中一种常见的盐,F ( http: / / www.21cnjy.com )为淡黄色固体,与X溶液反应生成蓝色沉淀Y为氢氧化铜可知,F为Na2O2;X溶液中含铜离子;M、N为常见的金属,结合N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器,E和N反应生成M可知发生了置换反应,判断N为Al,E为Fe2O3;M为Fe,结合M和含铜离子的X溶液反应生成固体C为铜,滤液A为亚铁盐溶液,加入盐酸会发生反应生成无色气体D,说明A只能是硝酸亚铁,即X溶液为硝酸铜溶液;F为过氧化钠加入到溶液B中生成H为气体单质氧气,D为无色气体一氧化氮,D在空气中会出现红棕色二氧化氮,(1)依据上述推断E为:Fe2O3,故答案为:Fe2O3;(2)将M丝插入盛有X溶液的试管中,是Fe和硝酸铜溶液反应生成铜和硝酸亚铁,反应一段时间后的现象,铁丝上附有红色物质,溶液颜色逐渐变为浅绿色,故答案为:铁丝上附有红色物质,溶液颜色逐渐变为浅绿色;(3)反应①是铁和硝酸铜溶液反应发生置换反应;②是硝酸亚铁和盐酸发生氧化还原反应;③是氧化铝和铁反应生成铝和氧化铁,是置换反应;④是硝酸铁和过氧化钠反应,不是置换反应,所以中属于置换反应的是①③,故答案为:①③;
11、【答案】(1)①同质量的两种固体在同 ( http: / / www.21cnjy.com )体积的溶剂中,Na2CO3比NaHCO3易溶于水;②红;
(2)①澄清石灰水变浑浊;②加热;
(3)②Na2CO3+CaCl2=CaCO3↓+2NaCl 再加入碳酸钠,有白色沉淀生成;
③ ( http: / / www.21cnjy.com / )
【解析】(1)①称取两种固体 ( http: / / www.21cnjy.com )各1g,分别放入两个小烧杯中,再各滴加5mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在同样的温度下,同质量的两种固体在同体积的溶剂中,Na2CO3比NaHCO3易溶于水;②碳酸钠和碳酸氢钠的溶液显碱性,向所得溶液中各滴入1~2滴酚酞溶液后,溶液均呈红色;(2)①碳酸氢钠受热易分解,2NaHCO3Na2CO3+CO2↑+H2O,可观察带的现象是:大试管口有水珠生成,生成的CO2气体通入澄清石灰水,澄清石灰水变浑浊;②碳酸钠加热不分解,碳酸氢钠受热易分解,用加热的方法除去混在Na2CO3粉末中少量的NaHCO3.(3)②碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,证明反应后CaCl2有剩余的方法是再加入碳酸钠,有白色沉淀生成.③设碳酸钠样品中碳酸钠的质量为x.
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x ng
( http: / / www.21cnjy.com / )
样品中Na2CO3的质量分数为 ( http: / / www.21cnjy.com / )
12、【答案】(1)甲方案不合理;乙方案不合理
(2)
实验步骤 实验现象 结论
取样,滴加足量盐酸 无气泡放出 完全变质
( http: / / www.21cnjy.com / )(2)根据亚硫酸钠与硫酸钠的化学性质不同:亚硫酸钠能与盐酸反应产生气体,而硫酸钠与盐酸不反应,来设计实验(合理即可). 21·cn·jy·com
实验步骤 实验现象 结论
取样,滴加足量盐酸 无气泡放出 完全变质
12、【答案】过滤;2NaOH+MgCl2=Mg(OH)2↓+2NaCl;NaOH价格较贵,使成本过高;
Na2CO3;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;确保Ca2+完全沉降;NaCl、Na2CO3、NaOH;挥发2-1-c-n-j-y
【解析】:(1)粗盐提纯时,第一步是将 ( http: / / www.21cnjy.com )混合物溶解然后过滤除去泥沙等杂质的过程,故答案为:过滤;
(2)粗盐提纯时,加入氢氧化钠可以将镁离子沉淀下来,即2NaOH+MgCl2=Mg(OH)2↓+2NaCl,但是氢氧化钠的价格高于氢氧化钙,导致提纯时的成本太高,
故答案为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;NaOH价格较贵,使成本过高;
(3)碳酸钠可以将粗盐中的杂质离子钙离子沉淀,反应为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,加入试剂过量能保证钙离子沉淀完全,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有粗盐中的氯化钠,加入的过量的碳酸钠的剩余部分以及上一步除去镁离子所加的过量的氢氧化钠,(4)经过加热蒸发,盐酸也可以除去,应为盐酸具有挥发性,故答案为:挥发.【出处:21教育名师】
( http: / / www.21cnjy.com / )
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://www.21cnjy.com/" 版权所有@21世纪教育网(www.21cnjy.com)
《常见的盐》练习(第一课时)
1、 选择题
1、人的红细胞必须生活在含有0.9%的氯 ( http: / / www.21cnjy.com )化钠的溶液中,医生常给脱水病人注射0.9%的生理盐水.因为红细胞在蒸馏水中会因吸水过多而胀破,在浓盐水中会因失水过多而皱缩,从而失去输送氧的功能,这说明( )21教育网
A、水分子容易进出细胞
B、无机盐离子容易进出细胞
C、红细胞的特性造成的
D、无机盐对维持细胞的形态和功能有重要的作用
2、2015年1月15日,海珠陈女士一家六 ( http: / / www.21cnjy.com )口人饭后出现亚硝酸盐中毒,并被送往医院紧急治疗.亚硝酸钠外观酷似食盐,有咸味,加热会分解,放出有臭味的气体.请结合下表信息判断,下列区别亚硝酸钠和氯化钠方法错误的是( )21cnjy.com
亚硝酸钠(NaNO2) 氯化钠(NaCl)
跟稀盐酸作用 放出红棕色的气体 无反应
跟硝酸银溶液作用 生成浅黄色沉淀 生成白色沉淀
A、滴加稀盐酸
B、加热
C、滴加硝酸银溶液
D、加水溶解
3、由于我国北方某些城市在严冬时节曾用食盐 ( http: / / www.21cnjy.com )融雪,造成土壤中含盐浓度偏高,使路旁的树木死亡.目前专家已研究出一种新型的融雪剂,既能融化冰雪,又能起施肥养护树木的作用,具有上述作用的新型融雪剂的是( ) 【来源:21·世纪·教育·网】
A、氯化钠 氯化钙
B、氯化钠 氯化镁
C、氯化钠 醋酸钙 醋酸镁
D、尿素 硝酸钙 硝酸镁
4、如图,用下列实验操作可 ( http: / / www.21cnjy.com )完成两个实验.甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为10%的氯化钠溶液.下列说法中,正确的是( )
( http: / / www.21cnjy.com / )
A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发
B、甲实验各步操作中,玻璃棒的作用都是相同的
C、乙实验若按照②③①的步骤进行操作,砝码为5g(游码读数0),则配制的溶液浓度偏大(p水=1g/cm3【版权所有:21教育】
D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响
5、除雪过程中,融雪剂发挥了很大的作用.某融雪剂是由氯化钠、硝酸钠、氯化镁、硫酸铜中的两种物质组成的.某实验小组为探究其成分,设计并完成了以下实验:
( http: / / www.21cnjy.com / )
已知:①氯化镁溶液可以和氢氧化钠溶液发生复分解反应.②氯化钠和氯化镁都能和硝酸银反应生成白色沉淀.
下列说法正确的是( )
A、该融雪剂中一定含有氯化钠
B、该融雪剂中一定含有氯化钠和氯化镁
C、该融雪剂中一定不含有硫酸铜和硝酸钠
D、该融雪剂中可能含有氯化钠或硝酸钠
6、下列有关物质用途的说法中,正确的是( )
①硝酸铵溶于水制成的冰袋可用于给发烧病人降温
②用小苏打作焙制糕点的发酵粉
③厨房洗涤剂有溶解油脂的作用
④用氯化钠来消除公路上的积雪.21*cnjy*com
A、①③④
B、①②④
C、②③④
D、①②③④
7、下列叙述正确的是( )
A、实验室配制一定质量分数的氯化钠溶液的主要步骤为:计算、称量、溶解、转移
B、粗盐提纯实验中,蒸发食盐水时玻璃棒的作用主要是加快蒸发的速率
C、配制一定质量分数的氯化钠溶液,量水时仰视读数,则所配溶液的溶质质量分数偏大
D、粗盐提纯实验中,溶解粗盐时,要加入大量的水,防止食盐不完全溶解
8、盐在人体的新陈代谢中十分重要,它可以维持血液中适当的酸碱度,并通过人体复杂的作用,产生消化液,帮助消化.这里的盐是指()
A、氯化钠
B、硫化钠
C、氯化钙
D、氯化镁
9、关于生活中常见的盐,下列说法不正确的是()
A.碳酸钙可用作补钙剂
B.硫酸铜溶液可以作为自来水的消毒剂
C.食盐可用于调味和腌渍蔬菜、鱼、肉等
D.小苏打是焙制糕点所用的发酵粉的主要成分之一
二、非选择题
10、已知X为中学化学中一种常见的盐, ( http: / / www.21cnjy.com )F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
请回答下列问题;www.21-cn-jy.com
(1)E的化学式为
Fe2O3
(2)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是
(3)在反应①②③④中属于置换反应的是 (填序号)①③
11、Na2CO3、NaHCO3是 ( http: / / www.21cnjy.com )生活中常见的盐,某实验小组通过以下实验来研究者离子物质的性质(已知:Na2CO3、NaHCO3的水溶液呈碱性;NaHCO3受热易分解生成Na2CO3、H2O和CO2).21·世纪*教育网
(1)称取两种固体各1g分别放入两支试管中,再加入5mL水,振荡.固体充分溶解,并恢复至室温;
①发现Na2CO3完全溶解,而NaHCO3有剩余.由此得出结论:在相同温度下,
②向所得溶液中各滴入1~2滴酚酞溶液后,溶液均呈 色红
(2)①取少量NaHCO3按如图装 ( http: / / www.21cnjy.com )置进行实验,可观察带的现象是:大试管口有水珠生成②用 的方法除去混在Na2CO3粉末中少量的NaHCO3加热
(3)测定Na2CO3样品(含NaCl杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯中加水溶解;
②加入过量的CaCl2溶液充分反应,反应的化 ( http: / / www.21cnjy.com )学方程式为 ;证明反应后CaCl2有剩余的方法是
③过滤、洗涤、干燥,称量测定的质量为ng.则样品中Na2CO3的质量分数为
Na2CO3+CaCl2=CaCO3↓12、地球是一颗蓝色的星球 ( http: / / www.21cnjy.com ),表面大部分被海洋覆盖,海水中蕴含的元素多达80多种.通过海水晒制可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。
( http: / / www.21cnjy.com / )
以下是一种制备精盐的实验方案,步骤如下:
回答下列问题:
(1)小星对粗盐进行初步提纯第Ⅰ步进行 操作。过滤
(2)小明在第Ⅱ步中,欲 ( http: / / www.21cnjy.com )将MgCl2去除,选择添加NaOH溶液,请写出该反应的化学方程式 .但小亮同学对小明设想提出不同意见,他认为应该用Ca(OH)2代替NaOH,理由是 2NaOH+MgCl2=Mg(OH)2↓+2NaCl
(3)小琴对第Ⅲ步进行实验,要将溶液中 ( http: / / www.21cnjy.com )的Ca2+沉淀出来,必然加一种常见的盐,该盐为 ,反应化学方程式为 ,该盐要加过量的目的是 ,据此分析,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有 Na2CO3
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(4)第Ⅳ步中,小琴加入过量盐酸,除去 ( http: / / www.21cnjy.com )溶液中所有杂质后,认为过量的盐酸也并不是新引入的杂质,经过加热蒸发,盐酸也可以除去,小琴利用了盐酸的 性
《常见的盐》(第一课时)参考答案
1、【答案】D
【解析】由题意知,红细胞在含有0. ( http: / / www.21cnjy.com )9%的氯化钠的溶液中形态不会改变,在蒸馏水中红细胞会因吸水过多而胀破,在浓盐水中红细胞会因为失水而皱缩,这说明一定浓度的无机盐对于维持渗透压保持细胞的形态和和功能稳定具有重要作用.www-2-1-cnjy-com
故选:D.
2、【答案】D
【解析】A、滴加稀盐酸,根据信息知亚硝酸钠放出红棕色气体,而氯化钠不反应,所以A正确.B、加热,根据题干知亚硝酸加热会分解,且放出有臭味的气体,而氯化钠受热 ( http: / / www.21cnjy.com / )故选D.21*cnjy*com
3、【答案】D
【解析】解题的突破口在于对树木起到施肥养护的作用,在四个选项中只有D选项含有常用的化肥尿素,而其它选项均未找的可以作为树木肥料的物质.
故选D.
4、【答案】C
【解析】A.粗盐中难溶性杂质的去除的操作 ( http: / / www.21cnjy.com )步骤是溶解、过滤、蒸发,即步骤是①④⑤,其中去除杂质的关键一步是过滤(把不溶于液体的固体与液体分离的一种方法),故A错误; B.甲实验各步操作中,溶解时玻璃棒的作用是搅拌,能够加快粗盐的溶解速率;过滤时玻璃棒的作用是引流;蒸发时玻璃棒的作用是搅拌,防止液体飞溅;玻璃棒的作用不相同,故B错误;C.量取的水为42g,由溶质质量分数的公式可知,会导致配制的溶液浓度偏大,故C正确;D.乙实验中,若①所用烧杯刚刚用清水洗过,会造成溶剂的质量偏大,则会导致配制的溶液浓度偏小,故D错误.21世纪教育网版权所有
故选C.
5、【答案】D
【解析】融雪剂加水溶解得无色溶液,说明无硫酸铜,加氢氧化钠溶液生成白色沉淀,说明含有氯化镁,氯化钠和硝酸钠是否含有无法确定;21教育名师原创作品
故选D
6、【答案】B
( http: / / www.21cnjy.com / )故选B.
7、【答案】A
【解析】A、实验室配制一定质量分数的 ( http: / / www.21cnjy.com )氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、转移,故选项说法正确.B、粗盐提纯实验中,蒸发食盐水时玻璃棒的作用主要是搅拌,以防止局部温度过高,造成液体飞溅,故选项说法错误.C、配制一定质量分数的氯化钠溶液,量水时仰视读数,会造成实际量取的水的体积偏大,则使溶质质量分数偏小,故选项说法错误.D、溶解粗盐时,不能加入大量的水,溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,故选项说法错误.2·1·c·n·j·y
故选:A.
8、【答案】C
【解析】A、碳酸盐中加入氯化银再加入稀 ( http: / / www.21cnjy.com )硝酸,可知化学方程式:Na2CO +2AgNO = Ag CO ↓ + 2NaNO ;Ag CO +2HNO =2AgNO +H O+CO ↑,由此可知,现象为先有沉淀,然后沉淀消失。B、碳酸盐中加入氯化钡再加入稀硝酸,可知化学方程式:
Na2CO +BaCl =B ( http: / / www.21cnjy.com )aCO ↓+2NaCl;BaCO +2HNO =Ba(NO ) +H O+CO ↑ ,由此可知,现象为先有沉淀,然后沉淀消失。C、氯化银、氯化钡来检验盐酸盐和硫酸盐的时候,还要加入稀硝酸,才能够证明;D、加入氯化银生成沉淀没办法鉴定原溶液有盐酸盐,因为没加稀硝酸的时候,碳酸盐也可以有该现象。【来源:21cnj*y.co*m】
故选:C.
9、【答案】B
( http: / / www.21cnjy.com / )故选B.
10、【答案】(1)Fe2O3
(2)铁丝上附有红色物质,溶液颜色逐渐变为浅绿色,
(3)①③
【解析】X为中学化学中一种常见的盐,F ( http: / / www.21cnjy.com )为淡黄色固体,与X溶液反应生成蓝色沉淀Y为氢氧化铜可知,F为Na2O2;X溶液中含铜离子;M、N为常见的金属,结合N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器,E和N反应生成M可知发生了置换反应,判断N为Al,E为Fe2O3;M为Fe,结合M和含铜离子的X溶液反应生成固体C为铜,滤液A为亚铁盐溶液,加入盐酸会发生反应生成无色气体D,说明A只能是硝酸亚铁,即X溶液为硝酸铜溶液;F为过氧化钠加入到溶液B中生成H为气体单质氧气,D为无色气体一氧化氮,D在空气中会出现红棕色二氧化氮,(1)依据上述推断E为:Fe2O3,故答案为:Fe2O3;(2)将M丝插入盛有X溶液的试管中,是Fe和硝酸铜溶液反应生成铜和硝酸亚铁,反应一段时间后的现象,铁丝上附有红色物质,溶液颜色逐渐变为浅绿色,故答案为:铁丝上附有红色物质,溶液颜色逐渐变为浅绿色;(3)反应①是铁和硝酸铜溶液反应发生置换反应;②是硝酸亚铁和盐酸发生氧化还原反应;③是氧化铝和铁反应生成铝和氧化铁,是置换反应;④是硝酸铁和过氧化钠反应,不是置换反应,所以中属于置换反应的是①③,故答案为:①③;
11、【答案】(1)①同质量的两种固体在同 ( http: / / www.21cnjy.com )体积的溶剂中,Na2CO3比NaHCO3易溶于水;②红;
(2)①澄清石灰水变浑浊;②加热;
(3)②Na2CO3+CaCl2=CaCO3↓+2NaCl 再加入碳酸钠,有白色沉淀生成;
③ ( http: / / www.21cnjy.com / )
【解析】(1)①称取两种固体 ( http: / / www.21cnjy.com )各1g,分别放入两个小烧杯中,再各滴加5mL蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,说明在同样的温度下,同质量的两种固体在同体积的溶剂中,Na2CO3比NaHCO3易溶于水;②碳酸钠和碳酸氢钠的溶液显碱性,向所得溶液中各滴入1~2滴酚酞溶液后,溶液均呈红色;(2)①碳酸氢钠受热易分解,2NaHCO3Na2CO3+CO2↑+H2O,可观察带的现象是:大试管口有水珠生成,生成的CO2气体通入澄清石灰水,澄清石灰水变浑浊;②碳酸钠加热不分解,碳酸氢钠受热易分解,用加热的方法除去混在Na2CO3粉末中少量的NaHCO3.(3)②碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl,证明反应后CaCl2有剩余的方法是再加入碳酸钠,有白色沉淀生成.③设碳酸钠样品中碳酸钠的质量为x.
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x ng
( http: / / www.21cnjy.com / )
样品中Na2CO3的质量分数为 ( http: / / www.21cnjy.com / )
12、【答案】(1)甲方案不合理;乙方案不合理
(2)
实验步骤 实验现象 结论
取样,滴加足量盐酸 无气泡放出 完全变质
( http: / / www.21cnjy.com / )(2)根据亚硫酸钠与硫酸钠的化学性质不同:亚硫酸钠能与盐酸反应产生气体,而硫酸钠与盐酸不反应,来设计实验(合理即可). 21·cn·jy·com
实验步骤 实验现象 结论
取样,滴加足量盐酸 无气泡放出 完全变质
12、【答案】过滤;2NaOH+MgCl2=Mg(OH)2↓+2NaCl;NaOH价格较贵,使成本过高;
Na2CO3;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;确保Ca2+完全沉降;NaCl、Na2CO3、NaOH;挥发2-1-c-n-j-y
【解析】:(1)粗盐提纯时,第一步是将 ( http: / / www.21cnjy.com )混合物溶解然后过滤除去泥沙等杂质的过程,故答案为:过滤;
(2)粗盐提纯时,加入氢氧化钠可以将镁离子沉淀下来,即2NaOH+MgCl2=Mg(OH)2↓+2NaCl,但是氢氧化钠的价格高于氢氧化钙,导致提纯时的成本太高,
故答案为:2NaOH+MgCl2=Mg(OH)2↓+2NaCl;NaOH价格较贵,使成本过高;
(3)碳酸钠可以将粗盐中的杂质离子钙离子沉淀,反应为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,加入试剂过量能保证钙离子沉淀完全,经过第Ⅲ步除去不溶物后,所得溶液的所有溶质有粗盐中的氯化钠,加入的过量的碳酸钠的剩余部分以及上一步除去镁离子所加的过量的氢氧化钠,(4)经过加热蒸发,盐酸也可以除去,应为盐酸具有挥发性,故答案为:挥发.【出处:21教育名师】
( http: / / www.21cnjy.com / )
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://www.21cnjy.com/" 版权所有@21世纪教育网(www.21cnjy.com)
