湖南省益阳市大通湖区第二中学九年级化学课件:第五单元课题三 利用化学方程式的简单计算 (共36张PPT)
文档属性
| 名称 | 湖南省益阳市大通湖区第二中学九年级化学课件:第五单元课题三 利用化学方程式的简单计算 (共36张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 600.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-09-24 16:28:35 | ||
图片预览











文档简介
(共36张PPT)
(1)表示化学反应的反应物、生成物和反应条件;
(2)表示化学反应的各物质的质量关系;
(3)表示各反应物、生成物之间的粒子个数之比。
化学方程式的含义
复习提问:
以电解水的反应为例
2H2O 2H2↑+O2↑
通电
1、表示水通电生成氢气和氧气。
2、表示每36份质量的水完全反应,生成4份质量的氢气和32份质量的氧气。
2×18=36
2×2=4
32
18g
?
?
3、表示水分子、氢分子和氧分子的个数比为2:2:1。
2g
16g
说明:在化学反应中,反应物与生成物之间的质量比成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(反应物)。
2H2 + O2 ====== 2 H2O
2×2 : 32 : 2 ×18
4 : 32 : 36
若: 4克 :( )克 : ( ) 克
点燃
若:( )克 :( )克 : 18 克
32
36
16
2
“神 舟 五 号” 升 空
你 会 做 吗 ?
假如你是长征系列火箭
推进器的设计师,已知,火
箭升空至少要携带100kg
的液氢,充分燃烧才能
获得足够的能量。你会
在火箭助燃仓中填充
多少千克的液氧来满足
这些液氢的完全燃烧?
课题3
利用化学方程式的
简单计算
学习目标
1、进一步认识化学方程式的意义,在正确书写化学方程式的基础上会进行简单的计算。
2、掌握有关化学方程式计算的思路和规范解题的格式。
3、有关化学方程式计算的基本题型
例题1
:加热分解6g高锰酸钾,可以得到多少克氧气
步骤:
1、设未知量
设:可以得到氧气的质量为X
2、写出反应的化学方程式并配平
KMnO4 = K2MnO4 +MnO2 + O2
2
3、写出相关物质的 质量关系和 已知量、未知量
2Χ158
32
6g
4、列比例式求解
x
32
2Χ158
6g
x
_______
___
=
X=0.6g
5、简明地写出答案
答:可以得到0.6克氧气
1、根据化学方程式进行计算的步骤
(1)设未知数 ……………....…设
(2)写出化学方程式并配平 ...….方
(3) 标出有关物质的量
(4) 列比例式,求解 …...….…..比
(5) 简明地写出答案 ….…...答
………………….….标
上标相对分子质量乘系数
下标已知质量和未知数
2.注意事项:
⑴.设未知量时一定要注意质量单位,已知量和未知量单位不一致的一定要进行单位换算,单位必须一致才能计算。
⑵.写出方程式要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明。
⑶.相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
⑷.计算结果的小数位保留按题中要求进行,若题中没有要求,一般保留一位小数。
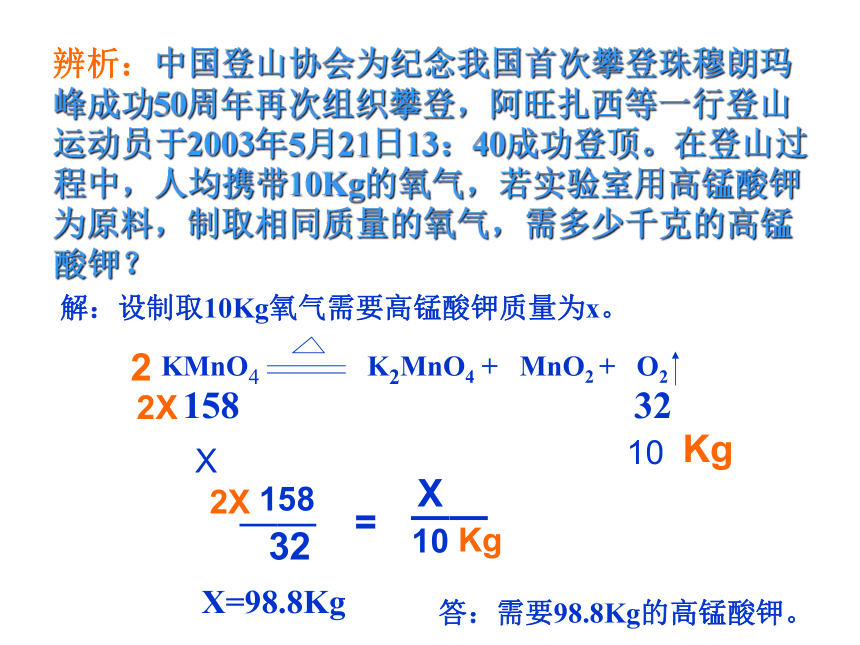
辨析:中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年再次组织攀登,阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。在登山过程中,人均携带10Kg的氧气,若实验室用高锰酸钾为原料,制取相同质量的氧气,需多少千克的高锰酸钾?
KMnO4 K2MnO4 + MnO2 + O2
解:设制取10Kg氧气需要高锰酸钾的质量为X
x
10
答:需要49Kg的高锰酸钾。
X=49Kg
158
32
x
——
158
=
10
——
32
KMnO4 K2MnO4 + MnO2 + O2
解:设制取10Kg氧气需要高锰酸钾质量为x。
158
32
答:需要98.8Kg的高锰酸钾。
X=98.8Kg
X
10
158
——
32
=
X
——
10
2
2X
Kg
2X
Kg
辨析:中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年再次组织攀登,阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。在登山过程中,人均携带10Kg的氧气,若实验室用高锰酸钾为原料,制取相同质量的氧气,需多少千克的高锰酸钾?
电解9g水,能得到氢气的质量为多少?小明的解法如下:
解:设能得到氢气xg
H2O H2 + O2
18 2 32
9g xg
18 32
9g xg
32×9g
18
答:能得到氢气16克。
X =
=16
通电
=
找出下列
所解答案
中的错误
例2:工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取10 t氧化钙,需要碳酸钙多少吨
解:设需要碳酸钙的质量为x。
CaCO3 CaO+CO2↑
100
56
x
10t
=
解得x = 18t
答:需要碳酸钙18t。
现 在 你 会 做 吗 ?
假如你是长征系列火箭推进器的设计师,已知,火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100Kg液氢所需氧气质量为X.
2H2 + O2 点 燃 2H2O
4
32
100Kg
X
4
100Kg
32
x
_______
=
X=800Kg
答:-------。
请根据上述计算步骤计算:电解4.5 t水可制得氢气多少吨 同时得到多少吨氧气
解:设制得氢气的质量为x,同时得到氧气的质量为y。
2H2O 2H2↑+ O2↑
36 4 32
4.5吨 x y
36∶4=4.5吨∶x 36∶32=4.5吨∶y
x=0.5吨 y=4吨
答:略。
练习
3、化学方程式计算的三个要领和三个关键。
三个要领:
①步骤要完整;②格式要规范;③得数要准确。
三个关键:
①准确书写化学式; ②化学方程式要配平; ③准确计算相对分子质量。
课堂作业:P101页习题
1、 氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢气需要氯气多少克?生成氯化氢气体多少克?
2、大家知道食盐是常见的调味品,但你知道吗?它还是一种重要的化工原料。利用食盐可以来制取氢氧化钠、氢气和氯气等,化学反应方程式为:
2NaCl+ 2H2O 通 电 Cl2 + H2 + 2NaOH
若某厂每天生产氯气71kg,问:
1、该厂每天至少需要氯化钠固体多少千克?
2、同时能生产氢氧化钠多少千克?
课题3
利用化学方程式的简单计算
第二课时
2.会利用化学方程式求混合物中某物质的质量分数。
学习目标
1.熟练掌握有关化学方程式计算,提高思维能力
和解题能力。
在进行化学方程式计算时常会出现以下一些错误:
①不认真审题,答非所问。
②元素符号或化学式写错。
③化学方程式写错或没配平。
④相对分子质量计算错误,导致质量比错误。
⑤同一种物质不用相同的单位或单位不统一。
⑥张冠李戴,物质的量代错。
⑦把不纯物当做纯净物。
⑧把物质的体积直接代入化学方程式。
例题:足量的镁带在标准状况下与11.2升的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
32
------ = ------
16g
80
X
X = ------------
80×16g
32
= 40g
答:充分燃烧后可生成氧化镁 40 克。
依题意,可知:
m(O2)=ρV=1.43g/L×11.2L=16g
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
------ = ------
依题意,可知:
解:设可生成氧化镁的质量为X
依题意,可知:
32
m(O2)=ρV=1.43g/L×11.2L=16g
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
------ = ------
解:设可生成氧化镁的质量为X
依题意,可知:
注意:如果已知体积或要算体积时,要用密度公式换算成质量才代入。
一、关于质量和体积间的换算
练习
1、 医疗上需要160千克氧气,如果用电解水的方法来制取,那么同时可以得到多少千克氢气?这些氢气在标准状况下占多大的体积?(ρH2=0.09克/升)
气体的质量=气体的体积×气体的密度
2、饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱。空运观赏鱼,必须密封。为了解决鱼的吸氧问题,可以在水中入过氧化钙(CaO2 ),过氧化钙与水反应,生成氢氧化钙[ Ca(OH)2 ]和氧气。
(1)写出过氧化钙与水反应的化学方程式:
(2)一个养鱼爱好者想从上海空运观赏鱼到广州,在整个过中鱼需要氧气224L(密度为1.43g/L),试计算需要多少克过氧化钙?
(3)已知过氧化钙售价为0.5元/克,问上述整个空运观赏鱼的过程需要多少钱
二、有关不纯反应物或生成物的计算。
1.化学反应方程式中不管是反应物还是生成物,代入的都是纯物质的质量.如果遇到不纯反应物或生成物,应将不纯物质换算成纯物质的质量.
2.不纯物质和纯物质质量间的换算.
纯物质的质量 = 不纯物质的质量 ×纯度(质量分数)
例:将15.5 g含氯酸钾和二氧化锰的混合物加热,反应完全后,冷却,称得残余固体的质量为10.7 g。根据质量守恒定律可知,生成氧气的质量为多少 剩余固体中二氧化锰的质量为多少
比一比!
把干燥的氯酸钾和二氧化锰固体混合物31g装入大试管中加热制取氧气,待反应不再产生气体为止,取出固体剩余物,烘干、称量,得到21.4g。
计算:(1)制得多少克氧气?
(2)21.4g固体中含有哪些物质?质量各为多少克?
(相对原子质量:K—39 ,O—16, Cl—35.5)
答案:(1)9.6克
(2)21.4g固体中含有氯化钾和
二氧化锰,质量分别为14.9g和6.5g。
某石灰石中含碳酸钙的质量分数是85%。现取100g石灰石跟足量的稀盐酸反应,能制得二氧化碳多少克?
解:设制得二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
100
44
100g×85%
x
X = 37.4 g
答:能制得二氧化碳的质量为37.4g
=
100
44
x
100g×85%
从中你受到的启示是什么?
讨论:若将1g氢气和10g氧气混合在一密闭的容器中使之充分反应,生成水的质量为多少?
(思考:你代入的应是氢气的质量还是氧气的质量)
三、涉及某些物质过量的化学方程式的计算:
某些反应物在反应后有剩余,我们说这些物质在反应中过量,因为它们没有都参加反应,因此计算时,不能用此物质进行求算。
某同学把3g碳放在给定的氧气中充分燃烧,实验数据如下:
第一次 第二次 第三次
给定氧气的质量 4g 13g 8g
生成二氧化碳的质量 5.5g 11g 11g
(1)从以上数据说明,这三次实验中第 次恰好完全反应。
(2)第 次实验碳有剩余,剩余 g。
(3)第 次实验中氧气有剩余,剩余 g。
C:12 O:16
三
一
1.5
二
5
提高题:
练习:若氢气、氧气混合气体共20克,点燃后还有2克的气体剩余,则原混合气体中氢气和氧气的质量比
A. 1:4 B. 1:9
C. 4:1或1:9 D. 1:4或1:9
2H2+ O2===2H2O
4 :32
点燃
有两种情况:
一是氢气过量,氢气和氧气的质量比 (2+2):16=1 : 4
二是氧气过量,氢气和氧气的质量比 2:( 2+16)=1 : 9
答案:D
为测定实验中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.8g二氧化锰混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体质量,记录数据如下:
加热时间 t1 t2 t3 t4
剩余固体质量/g 2.48 2.41 2.34 2.34
仔细分析实验数据,回答下列问题:
(1)在 时间后,该样品的氯酸钾已完全分解。
(2)求完全反应后放出氧气的质量?
(3)求该样品氯酸钾的质量分数?
四.有关表格和图表的化学方程式的计算
金属铜和氧化铜的混合物0.92克在不断通入氢气的情况下加热,充分反应后,停止加热并继续通氢气直到试管冷却,称量得到0.76克固体物质。求反应前混合物中氧化铜的质量?
方法一:
解:设混合物中原有金属铜质量为x
CuO + H2 ==== Cu + H2O
80 64
0.92克–x 0.76克–x
氧化铜的质量= 0.92克–0.12克= 0.8克
答:混合物中有氧化铜的质量为0.8克。
方法二:
解:氧化铜中的氧元素的质量为
0.92克 – 0.76克= 0.16克
氧化铜的质量= 0.16克÷
= 0.16克÷(16/80)
=0.8克
答:原混合物中氧化铜的质量为0.8克。
方法三:设参加CuO的量为x
CuO + H2====Cu + H2O m
80 64 16
x 0.92g-0.72g
答:原混合物中氧化铜的质量为0.8克。
有关物质差量的计算
计算的依据
小结:根据化学方程式的计算时
化学方程要配平,应把纯量代方程。
上下单位要相同,左右关系相适应。
如有两个已知量,要按不足来计算。
上下左右列比例,求解作答才完备。
(1)表示化学反应的反应物、生成物和反应条件;
(2)表示化学反应的各物质的质量关系;
(3)表示各反应物、生成物之间的粒子个数之比。
化学方程式的含义
复习提问:
以电解水的反应为例
2H2O 2H2↑+O2↑
通电
1、表示水通电生成氢气和氧气。
2、表示每36份质量的水完全反应,生成4份质量的氢气和32份质量的氧气。
2×18=36
2×2=4
32
18g
?
?
3、表示水分子、氢分子和氧分子的个数比为2:2:1。
2g
16g
说明:在化学反应中,反应物与生成物之间的质量比成正比例关系。因此,利用正比例关系根据化学方程式和已知的一种反应物(或生成物)的质量,可求生成物(反应物)。
2H2 + O2 ====== 2 H2O
2×2 : 32 : 2 ×18
4 : 32 : 36
若: 4克 :( )克 : ( ) 克
点燃
若:( )克 :( )克 : 18 克
32
36
16
2
“神 舟 五 号” 升 空
你 会 做 吗 ?
假如你是长征系列火箭
推进器的设计师,已知,火
箭升空至少要携带100kg
的液氢,充分燃烧才能
获得足够的能量。你会
在火箭助燃仓中填充
多少千克的液氧来满足
这些液氢的完全燃烧?
课题3
利用化学方程式的
简单计算
学习目标
1、进一步认识化学方程式的意义,在正确书写化学方程式的基础上会进行简单的计算。
2、掌握有关化学方程式计算的思路和规范解题的格式。
3、有关化学方程式计算的基本题型
例题1
:加热分解6g高锰酸钾,可以得到多少克氧气
步骤:
1、设未知量
设:可以得到氧气的质量为X
2、写出反应的化学方程式并配平
KMnO4 = K2MnO4 +MnO2 + O2
2
3、写出相关物质的 质量关系和 已知量、未知量
2Χ158
32
6g
4、列比例式求解
x
32
2Χ158
6g
x
_______
___
=
X=0.6g
5、简明地写出答案
答:可以得到0.6克氧气
1、根据化学方程式进行计算的步骤
(1)设未知数 ……………....…设
(2)写出化学方程式并配平 ...….方
(3) 标出有关物质的量
(4) 列比例式,求解 …...….…..比
(5) 简明地写出答案 ….…...答
………………….….标
上标相对分子质量乘系数
下标已知质量和未知数
2.注意事项:
⑴.设未知量时一定要注意质量单位,已知量和未知量单位不一致的一定要进行单位换算,单位必须一致才能计算。
⑵.写出方程式要注意配平,而且要注意方程式的完整,反应条件、气体和沉淀的符号要注意标明。
⑶.相关物质的相对分子质量写在相应化学式的下面,一定要注意用相对分子质量乘以化学式前面的系数,已知量和未知量写在相应相对分子质量的下边。
⑷.计算结果的小数位保留按题中要求进行,若题中没有要求,一般保留一位小数。
辨析:中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年再次组织攀登,阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。在登山过程中,人均携带10Kg的氧气,若实验室用高锰酸钾为原料,制取相同质量的氧气,需多少千克的高锰酸钾?
KMnO4 K2MnO4 + MnO2 + O2
解:设制取10Kg氧气需要高锰酸钾的质量为X
x
10
答:需要49Kg的高锰酸钾。
X=49Kg
158
32
x
——
158
=
10
——
32
KMnO4 K2MnO4 + MnO2 + O2
解:设制取10Kg氧气需要高锰酸钾质量为x。
158
32
答:需要98.8Kg的高锰酸钾。
X=98.8Kg
X
10
158
——
32
=
X
——
10
2
2X
Kg
2X
Kg
辨析:中国登山协会为纪念我国首次攀登珠穆朗玛峰成功50周年再次组织攀登,阿旺扎西等一行登山运动员于2003年5月21日13:40成功登顶。在登山过程中,人均携带10Kg的氧气,若实验室用高锰酸钾为原料,制取相同质量的氧气,需多少千克的高锰酸钾?
电解9g水,能得到氢气的质量为多少?小明的解法如下:
解:设能得到氢气xg
H2O H2 + O2
18 2 32
9g xg
18 32
9g xg
32×9g
18
答:能得到氢气16克。
X =
=16
通电
=
找出下列
所解答案
中的错误
例2:工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳,如果要制取10 t氧化钙,需要碳酸钙多少吨
解:设需要碳酸钙的质量为x。
CaCO3 CaO+CO2↑
100
56
x
10t
=
解得x = 18t
答:需要碳酸钙18t。
现 在 你 会 做 吗 ?
假如你是长征系列火箭推进器的设计师,已知,火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100Kg液氢所需氧气质量为X.
2H2 + O2 点 燃 2H2O
4
32
100Kg
X
4
100Kg
32
x
_______
=
X=800Kg
答:-------。
请根据上述计算步骤计算:电解4.5 t水可制得氢气多少吨 同时得到多少吨氧气
解:设制得氢气的质量为x,同时得到氧气的质量为y。
2H2O 2H2↑+ O2↑
36 4 32
4.5吨 x y
36∶4=4.5吨∶x 36∶32=4.5吨∶y
x=0.5吨 y=4吨
答:略。
练习
3、化学方程式计算的三个要领和三个关键。
三个要领:
①步骤要完整;②格式要规范;③得数要准确。
三个关键:
①准确书写化学式; ②化学方程式要配平; ③准确计算相对分子质量。
课堂作业:P101页习题
1、 氢气在氯气中燃烧生成氯化氢气体,燃烧100g氢气需要氯气多少克?生成氯化氢气体多少克?
2、大家知道食盐是常见的调味品,但你知道吗?它还是一种重要的化工原料。利用食盐可以来制取氢氧化钠、氢气和氯气等,化学反应方程式为:
2NaCl+ 2H2O 通 电 Cl2 + H2 + 2NaOH
若某厂每天生产氯气71kg,问:
1、该厂每天至少需要氯化钠固体多少千克?
2、同时能生产氢氧化钠多少千克?
课题3
利用化学方程式的简单计算
第二课时
2.会利用化学方程式求混合物中某物质的质量分数。
学习目标
1.熟练掌握有关化学方程式计算,提高思维能力
和解题能力。
在进行化学方程式计算时常会出现以下一些错误:
①不认真审题,答非所问。
②元素符号或化学式写错。
③化学方程式写错或没配平。
④相对分子质量计算错误,导致质量比错误。
⑤同一种物质不用相同的单位或单位不统一。
⑥张冠李戴,物质的量代错。
⑦把不纯物当做纯净物。
⑧把物质的体积直接代入化学方程式。
例题:足量的镁带在标准状况下与11.2升的氧气(密度为1.43g/L) 充分燃烧,可以生成多少克氧化镁?
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
32
------ = ------
16g
80
X
X = ------------
80×16g
32
= 40g
答:充分燃烧后可生成氧化镁 40 克。
依题意,可知:
m(O2)=ρV=1.43g/L×11.2L=16g
解:设可生成氧化镁的质量为X
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
------ = ------
依题意,可知:
解:设可生成氧化镁的质量为X
依题意,可知:
32
m(O2)=ρV=1.43g/L×11.2L=16g
2 Mg + O 2 ====== 2 Mg O
点燃
32 80
16g X
------ = ------
解:设可生成氧化镁的质量为X
依题意,可知:
注意:如果已知体积或要算体积时,要用密度公式换算成质量才代入。
一、关于质量和体积间的换算
练习
1、 医疗上需要160千克氧气,如果用电解水的方法来制取,那么同时可以得到多少千克氢气?这些氢气在标准状况下占多大的体积?(ρH2=0.09克/升)
气体的质量=气体的体积×气体的密度
2、饲养观赏鱼,可以陶冶人的情操,增进人们对生活的热爱。空运观赏鱼,必须密封。为了解决鱼的吸氧问题,可以在水中入过氧化钙(CaO2 ),过氧化钙与水反应,生成氢氧化钙[ Ca(OH)2 ]和氧气。
(1)写出过氧化钙与水反应的化学方程式:
(2)一个养鱼爱好者想从上海空运观赏鱼到广州,在整个过中鱼需要氧气224L(密度为1.43g/L),试计算需要多少克过氧化钙?
(3)已知过氧化钙售价为0.5元/克,问上述整个空运观赏鱼的过程需要多少钱
二、有关不纯反应物或生成物的计算。
1.化学反应方程式中不管是反应物还是生成物,代入的都是纯物质的质量.如果遇到不纯反应物或生成物,应将不纯物质换算成纯物质的质量.
2.不纯物质和纯物质质量间的换算.
纯物质的质量 = 不纯物质的质量 ×纯度(质量分数)
例:将15.5 g含氯酸钾和二氧化锰的混合物加热,反应完全后,冷却,称得残余固体的质量为10.7 g。根据质量守恒定律可知,生成氧气的质量为多少 剩余固体中二氧化锰的质量为多少
比一比!
把干燥的氯酸钾和二氧化锰固体混合物31g装入大试管中加热制取氧气,待反应不再产生气体为止,取出固体剩余物,烘干、称量,得到21.4g。
计算:(1)制得多少克氧气?
(2)21.4g固体中含有哪些物质?质量各为多少克?
(相对原子质量:K—39 ,O—16, Cl—35.5)
答案:(1)9.6克
(2)21.4g固体中含有氯化钾和
二氧化锰,质量分别为14.9g和6.5g。
某石灰石中含碳酸钙的质量分数是85%。现取100g石灰石跟足量的稀盐酸反应,能制得二氧化碳多少克?
解:设制得二氧化碳的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2 ↑
100
44
100g×85%
x
X = 37.4 g
答:能制得二氧化碳的质量为37.4g
=
100
44
x
100g×85%
从中你受到的启示是什么?
讨论:若将1g氢气和10g氧气混合在一密闭的容器中使之充分反应,生成水的质量为多少?
(思考:你代入的应是氢气的质量还是氧气的质量)
三、涉及某些物质过量的化学方程式的计算:
某些反应物在反应后有剩余,我们说这些物质在反应中过量,因为它们没有都参加反应,因此计算时,不能用此物质进行求算。
某同学把3g碳放在给定的氧气中充分燃烧,实验数据如下:
第一次 第二次 第三次
给定氧气的质量 4g 13g 8g
生成二氧化碳的质量 5.5g 11g 11g
(1)从以上数据说明,这三次实验中第 次恰好完全反应。
(2)第 次实验碳有剩余,剩余 g。
(3)第 次实验中氧气有剩余,剩余 g。
C:12 O:16
三
一
1.5
二
5
提高题:
练习:若氢气、氧气混合气体共20克,点燃后还有2克的气体剩余,则原混合气体中氢气和氧气的质量比
A. 1:4 B. 1:9
C. 4:1或1:9 D. 1:4或1:9
2H2+ O2===2H2O
4 :32
点燃
有两种情况:
一是氢气过量,氢气和氧气的质量比 (2+2):16=1 : 4
二是氧气过量,氢气和氧气的质量比 2:( 2+16)=1 : 9
答案:D
为测定实验中氯酸钾样品的纯度,某学习小组取2.5g该样品与0.8g二氧化锰混合,加热该混合物t1时间后(假设杂质不参加反应),冷却,称量剩余固体质量,重复以上操作,依次称得加热t1、t2、t3、t4时间后剩余固体质量,记录数据如下:
加热时间 t1 t2 t3 t4
剩余固体质量/g 2.48 2.41 2.34 2.34
仔细分析实验数据,回答下列问题:
(1)在 时间后,该样品的氯酸钾已完全分解。
(2)求完全反应后放出氧气的质量?
(3)求该样品氯酸钾的质量分数?
四.有关表格和图表的化学方程式的计算
金属铜和氧化铜的混合物0.92克在不断通入氢气的情况下加热,充分反应后,停止加热并继续通氢气直到试管冷却,称量得到0.76克固体物质。求反应前混合物中氧化铜的质量?
方法一:
解:设混合物中原有金属铜质量为x
CuO + H2 ==== Cu + H2O
80 64
0.92克–x 0.76克–x
氧化铜的质量= 0.92克–0.12克= 0.8克
答:混合物中有氧化铜的质量为0.8克。
方法二:
解:氧化铜中的氧元素的质量为
0.92克 – 0.76克= 0.16克
氧化铜的质量= 0.16克÷
= 0.16克÷(16/80)
=0.8克
答:原混合物中氧化铜的质量为0.8克。
方法三:设参加CuO的量为x
CuO + H2====Cu + H2O m
80 64 16
x 0.92g-0.72g
答:原混合物中氧化铜的质量为0.8克。
有关物质差量的计算
计算的依据
小结:根据化学方程式的计算时
化学方程要配平,应把纯量代方程。
上下单位要相同,左右关系相适应。
如有两个已知量,要按不足来计算。
上下左右列比例,求解作答才完备。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
