1.2物质的酸碱性
图片预览











文档简介
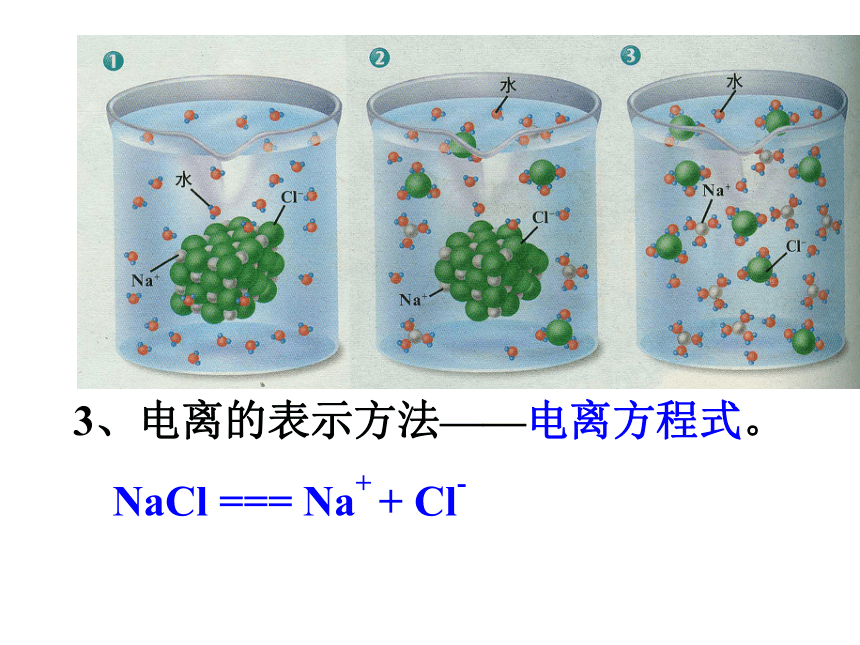
课件39张PPT。第二节 探索酸的性质酸。一、什么是酸 你若有呕吐的经历,你会感受到胃液是酸的。在日常生活中,有酸味的物质还有醋、放置时间过长的面包、杏、苹果、橘子等。我们知道:食醋——醋酸,胃液——盐酸,柠檬、柑橘等水果中含有柠檬酸。一、 物质的电离 2、电离:带电的原子或原子集团。1、离子:一些物质溶解于水或受热熔化时,产生自由移动离子的过程,叫做电离。带正电荷的叫阳离子。带负电荷的叫阴离子。 3、电离的表示方法——电离方程式。NaCl === Na+ + Cl-4、一些物质电离时产生的阴阳离子所带电荷的总数一定相等。所以,这些物质的溶液不显电性。5、电离方程式书写时,不必写条件,但要配平,使电荷总数,而原子团不能拆开。 这些物质在水中电离时,生成的阳离子全部都是氢离子(H+)。那么,为什么说这些物质都是酸呢?盐酸的电离:HCl = H+ + Cl-H+H+H+盐酸:
硝酸:
硫酸:HCI = H + + CI-电离方程式:H NO3 = H + + NO3-H2SO4 = 2H + + SO 42-
电离通式:酸= H + 酸根阴离子1、强酸:盐酸(HCl)、硫酸(H2SO4)、
硝酸(HNO3)
2、弱酸:醋酸(CH3COOH)、碳酸(H2co3)一、什么是酸:在水中电离时,生成的阳离子全部都是氢离子(H+)的化合物。: 强 酸弱 酸 性 物 质 王水( 又称“王酸”、“硝基盐酸”。是一种腐蚀性非常强、冒黄色雾的液体,是浓盐酸(HCl)和浓硝酸(HNO?)按体积比为3:1组成的混合物。
它是少数几种能够溶解金(Au)物质的液体之一,它名字正是由于它的腐蚀性之强而来。
王水一般用在蚀刻工艺和一些检测分析过程中,不过一些金属单质如钽(Ta)、无机盐如氯化银、硫酸钡,有机物中的塑料之王——聚四氟乙烯、蜡烛等高级烷烃,无机界的重要物质——硅(Si),不受王水腐蚀。
王水极易变质,有氯气的气味,因此必须现配现使用。你去尝一个未成熟的柿子,会有什么感觉?这是因为柿子里含有 物质碱性食用碱性食品时会感到涩味,洗澡时不小心有肥皂泡溅到嘴里也有这种感觉。你知道生活中碱性的食物 吗?思 考三.什么是碱1.未成熟的柿子中存在碱性物质,家用的洗涤剂中也存在着碱性物质;常见的物质中,NaOH、Ca(OH)2、氨水等物质都属于碱。思考:电离产物的共同之处是什么?NaOH = Na+ + OH–
请试试写下KOH Ca(OH)2 Ba(OH)2的电离方程式 Ca(OH)2 = Ca2+ + 2OH– Ba(OH)2 = Ba2++ 2OH– KOH = K + + OH–3.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。2.碱的电离4.电离通式:碱→金属阳离子 + OH–强 碱弱 碱 性 物 质
酸碱指示剂 四、酸碱指示剂1、定义:在酸或碱溶液里能显示出不同颜色的物质。 2、常见的酸碱指示剂有:紫色石蕊试液无色酚酞试液
酸性溶液都能使紫色石蕊变红吗?实验一
碱性溶液都能使紫色石蕊变蓝吗?
氢氧化钾溶液实验二氢氧化钠 (烧碱)、氢氧化钙(熟石灰) 、
氢氧化钾、氢氧化钡 等是常见的碱性物质。3、酸碱指示剂可以定性地测定溶液的
酸碱性。4、常见指示剂在酸、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色石蕊遇酸变红, 遇碱变蓝;
酚酞遇酸不变色,遇碱变红.科学家的发现 英国著名科学家波义耳在做实验时,不小心将盐酸溅到了紫罗兰的花瓣上 。转眼间,紫罗兰变成了“红罗兰”,这一发现立即引起他极大的关注:“盐酸能使紫罗兰变红,其它的酸性溶液能使它变红吗?”当即,波义耳就用不同的酸液试验了起来。 实验结果是“酸性溶液都可以使紫罗 兰变成红色。”“酸液能使紫罗兰变 红,那么碱液能否使它变色呢?变 成什么颜色?”“紫罗兰能变色,别 的花能变色吗?” 经过一连串的思考 与实验,石蕊试液就被作为酸碱指示 剂正式确定了下来。自制酸碱指示剂1、取一些月季花、菊花、丝瓜花、一串红等植物的花、果、枝叶切碎、捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂。2、取食盐水、白醋、石灰水加以试验。并记录变色情况。溶液的酸碱性的强弱程度石蕊试液虽然能够测定物质的酸碱性,但不能反应酸碱性的强弱程度,我们需要测定物质酸碱性的强弱pH是反应物质酸碱性强弱的指标溶液酸碱性的强弱程度1.pH是反应物质酸碱性强弱的指标。它的范围通常在0至14之间。
2.pH与溶液酸碱性之间的关系。
pH<7 溶液呈酸性, pH越小,酸性越强pH=7 溶液呈中性
pH>7 溶液呈碱性, pH越大,碱性越强
01234567891011121314试纸标准比色卡中性78910111213146543210pH试纸使用方法 1.用洁净的玻棒棒蘸取待测液体,滴在pH试纸上,2.将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定待测溶液的pH。3.若要接着测另一种溶液的pH值,应将玻
棒换一头或用蒸馏水洗一下(要檫干) 酸度计 分析比较可食用与非食用物质的pH值,
有何启示? 酸性或碱性太强的物质即pH太大或太
小的物质均不可食用,因为它们有强烈的
腐蚀性。 pH>7,碱性; pH =7,中性;pH<7,酸性。那么,你知道还有什么方法可以测定物质的酸碱性?二、酸碱指示剂:石蕊遇酸变红,遇碱变蓝;(酸红碱蓝)
酚酞遇酸不变色,遇碱变红。(酸无碱红)1、下列物质不属于酸的是 ( )
A、HNO3 B、NaHCO3
C、H3PO4 D、HI
2、用简单的方法区别水和硫酸,并写出实验步骤。
3、B练习:4.下列各组离子属于酸电离产生的是( )
A.H+、NO3-、SO42- B.OH-、Ba2+
C.H+、Na+、SO42- D. Na+ 、Ba2+、 Cl-
5.某一溶液的pH=2,该溶液呈 性,它能使紫色石蕊试液 色,无色酚酞试液 ,使蓝色石蕊试纸变 色。
6.下表列出了家庭中某些物质的pH:
上述物质能使无色酚酞试液变红色的是 。 A酸红不变色蓝牙膏、 肥皂水7.将一定质量分数的硫酸溶液加水稀释,
下图正确表示pH变化的是( )
A
硝酸:
硫酸:HCI = H + + CI-电离方程式:H NO3 = H + + NO3-H2SO4 = 2H + + SO 42-
电离通式:酸= H + 酸根阴离子1、强酸:盐酸(HCl)、硫酸(H2SO4)、
硝酸(HNO3)
2、弱酸:醋酸(CH3COOH)、碳酸(H2co3)一、什么是酸:在水中电离时,生成的阳离子全部都是氢离子(H+)的化合物。: 强 酸弱 酸 性 物 质 王水( 又称“王酸”、“硝基盐酸”。是一种腐蚀性非常强、冒黄色雾的液体,是浓盐酸(HCl)和浓硝酸(HNO?)按体积比为3:1组成的混合物。
它是少数几种能够溶解金(Au)物质的液体之一,它名字正是由于它的腐蚀性之强而来。
王水一般用在蚀刻工艺和一些检测分析过程中,不过一些金属单质如钽(Ta)、无机盐如氯化银、硫酸钡,有机物中的塑料之王——聚四氟乙烯、蜡烛等高级烷烃,无机界的重要物质——硅(Si),不受王水腐蚀。
王水极易变质,有氯气的气味,因此必须现配现使用。你去尝一个未成熟的柿子,会有什么感觉?这是因为柿子里含有 物质碱性食用碱性食品时会感到涩味,洗澡时不小心有肥皂泡溅到嘴里也有这种感觉。你知道生活中碱性的食物 吗?思 考三.什么是碱1.未成熟的柿子中存在碱性物质,家用的洗涤剂中也存在着碱性物质;常见的物质中,NaOH、Ca(OH)2、氨水等物质都属于碱。思考:电离产物的共同之处是什么?NaOH = Na+ + OH–
请试试写下KOH Ca(OH)2 Ba(OH)2的电离方程式 Ca(OH)2 = Ca2+ + 2OH– Ba(OH)2 = Ba2++ 2OH– KOH = K + + OH–3.碱的涵义:碱是电离时产生的阴离子全部是OH-的化合物。2.碱的电离4.电离通式:碱→金属阳离子 + OH–强 碱弱 碱 性 物 质
酸碱指示剂 四、酸碱指示剂1、定义:在酸或碱溶液里能显示出不同颜色的物质。 2、常见的酸碱指示剂有:紫色石蕊试液无色酚酞试液
酸性溶液都能使紫色石蕊变红吗?实验一
碱性溶液都能使紫色石蕊变蓝吗?
氢氧化钾溶液实验二氢氧化钠 (烧碱)、氢氧化钙(熟石灰) 、
氢氧化钾、氢氧化钡 等是常见的碱性物质。3、酸碱指示剂可以定性地测定溶液的
酸碱性。4、常见指示剂在酸、碱性溶液中的颜色红色红色红色无色蓝色蓝色不变色不变色石蕊遇酸变红, 遇碱变蓝;
酚酞遇酸不变色,遇碱变红.科学家的发现 英国著名科学家波义耳在做实验时,不小心将盐酸溅到了紫罗兰的花瓣上 。转眼间,紫罗兰变成了“红罗兰”,这一发现立即引起他极大的关注:“盐酸能使紫罗兰变红,其它的酸性溶液能使它变红吗?”当即,波义耳就用不同的酸液试验了起来。 实验结果是“酸性溶液都可以使紫罗 兰变成红色。”“酸液能使紫罗兰变 红,那么碱液能否使它变色呢?变 成什么颜色?”“紫罗兰能变色,别 的花能变色吗?” 经过一连串的思考 与实验,石蕊试液就被作为酸碱指示 剂正式确定了下来。自制酸碱指示剂1、取一些月季花、菊花、丝瓜花、一串红等植物的花、果、枝叶切碎、捣烂,用酒精浸制,所得的浸出液可以作为酸碱指示剂。2、取食盐水、白醋、石灰水加以试验。并记录变色情况。溶液的酸碱性的强弱程度石蕊试液虽然能够测定物质的酸碱性,但不能反应酸碱性的强弱程度,我们需要测定物质酸碱性的强弱pH是反应物质酸碱性强弱的指标溶液酸碱性的强弱程度1.pH是反应物质酸碱性强弱的指标。它的范围通常在0至14之间。
2.pH与溶液酸碱性之间的关系。
pH<7 溶液呈酸性, pH越小,酸性越强pH=7 溶液呈中性
pH>7 溶液呈碱性, pH越大,碱性越强
01234567891011121314试纸标准比色卡中性78910111213146543210pH试纸使用方法 1.用洁净的玻棒棒蘸取待测液体,滴在pH试纸上,2.将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定待测溶液的pH。3.若要接着测另一种溶液的pH值,应将玻
棒换一头或用蒸馏水洗一下(要檫干) 酸度计 分析比较可食用与非食用物质的pH值,
有何启示? 酸性或碱性太强的物质即pH太大或太
小的物质均不可食用,因为它们有强烈的
腐蚀性。 pH>7,碱性; pH =7,中性;pH<7,酸性。那么,你知道还有什么方法可以测定物质的酸碱性?二、酸碱指示剂:石蕊遇酸变红,遇碱变蓝;(酸红碱蓝)
酚酞遇酸不变色,遇碱变红。(酸无碱红)1、下列物质不属于酸的是 ( )
A、HNO3 B、NaHCO3
C、H3PO4 D、HI
2、用简单的方法区别水和硫酸,并写出实验步骤。
3、B练习:4.下列各组离子属于酸电离产生的是( )
A.H+、NO3-、SO42- B.OH-、Ba2+
C.H+、Na+、SO42- D. Na+ 、Ba2+、 Cl-
5.某一溶液的pH=2,该溶液呈 性,它能使紫色石蕊试液 色,无色酚酞试液 ,使蓝色石蕊试纸变 色。
6.下表列出了家庭中某些物质的pH:
上述物质能使无色酚酞试液变红色的是 。 A酸红不变色蓝牙膏、 肥皂水7.将一定质量分数的硫酸溶液加水稀释,
下图正确表示pH变化的是( )
A
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
