专题2.1+化学反应速率(课件)-2017-2018学年高二化学同步精品课堂(选修4)
文档属性
| 名称 | 专题2.1+化学反应速率(课件)-2017-2018学年高二化学同步精品课堂(选修4) |
|
|
| 格式 | zip | ||
| 文件大小 | 146.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-06 00:00:00 | ||
图片预览






文档简介
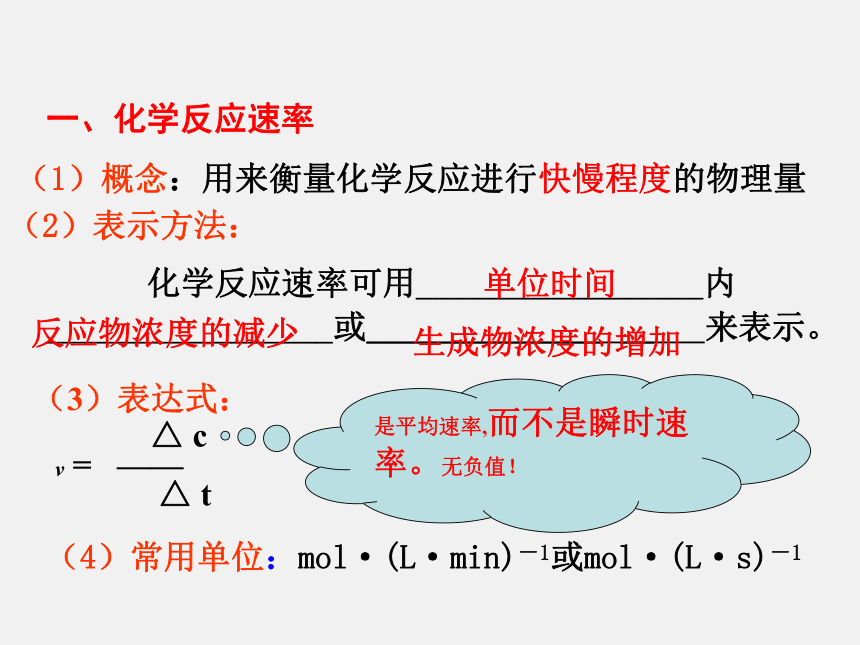
课件13张PPT。(3)表达式:
△ c
v = ——
△ t
化学反应速率可用_________________内 _________________或______________ __ 来表示。 (4)常用单位:mol·(L·min)-1或mol·(L·s)-1 一、化学反应速率是平均速率,而不是瞬时速率。无负值!(1)概念:用来衡量化学反应进行快慢程度的物理量 (2)表示方法: 例:在2L的密闭容器中,加入1mol和3mol的H2和N2,发生 N2 + 3H2 2NH3 ,在2s末时,测得容器中含有0.4mo l的NH3,求用不同物质计算该反应的化学反应速率。 1 3 0 2.40.8 0.2 0.6 0.4v(N2)=△c/△t= 0.1mol/L/2s = 0.05mol/(L·s)
v(H2) = △c/△ t = 0.3mol/L / 2sn = 0.15mol/(L·s)
v(NH3) = △c/△ t = 0.2mol/L / 2min = 0.1 mol/(L·s)0.4化学反应速率 V
mol/(L·s) 0.4 1.2 0.8 思考:以上三者数值是否相等?是否矛盾?有何规律?在同一个反应中,各物质的反应速率之比等于方程式中的化学计量数(系数)之比。即:
v (N2 ):v (H2 ): v (NH3 )= 1 :3 :2 aA+Bb=cC+Dd
v(A):v(B):v(C):v(D)=a:b:c:d N2 + 3H2 2NH3注意:(1)化学反应速率表示的是平均速率,不是瞬时速率;(2)无论浓度增加还是减少,一般取正值,因此化学反应速率一般为正值;(3)固体和纯液体的浓度视为常数(保持不变),一般不用固体物质与液体物质表示反应速率。(4)在同一反应体系中用不同物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。(5)对于同一容器中的一般反应,化学反应速率之比等于浓度的变化比,等于化学计量数之比。练 习1.对于反应Fe+2HCl=FeCl2+H2,2s内FeCl2的
物质的量浓度由2mol/L变为4mol/L,试用
FeCl2的物质的量浓度的变化来描述此反应的
快慢。
解:
v = △ c/ △t =( 4mol/L-2mol/L)/2s
= 2 mol /(L · s)根据下图回答:1、反应物是__________.2、2min内A的平均速率是___________3、写出化学方程式A、B2.5mol/(L·min)练习解析:反应物随着反应进行,物质的量或物质的量浓度减小,生成物的物质的量或物质的量浓度增大,因此A、B为反应物,C为生成物;根据化学反应速率的数学表达式v(A)=(6-1)/2mol/(L·min)=2.5 mol/(L·min);根据化学反应速率之比等于变化浓度比,等于化学计量数之比,即计量数之比为( 6-1 )( 7-3):4=5:4:4 ④﹥ ②= ③﹥ ①注意:在同一反应中,反应速率的大小不能单纯地看数值大小,因为速率大小与表示速率的物质在反应中的化学计量有关;同时注意单位。完成课本实验2-1 按图安装两套装置,在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL 1mol/L和40mL 4mL/L的硫酸,比较二者收集10mLH2所用的时间。实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、观察收集10mLH2所用的时间 注意事项:
1、注意安全,团结协作
2、如何检查装置的气密性
3、何时计时,用何仪器计时
4、稀硫酸滴入时注意:
a:保持导气管顺畅
b:液体快速滴下
c:滴完后迅速关闭分液漏斗活塞结论: 锌跟硫酸反应产生气泡,收集10 mL气体。浓硫酸所用的时间比稀硫酸所用的时间短实验数据:实验现象:4mol/L的硫酸与锌反应比1mol/L的硫酸
与锌反应快。 测量化学反应速率的常见方法1、量气法2、比色法3、电导法4、激光技术法讨论:除本实验测定速率的方法外,可行的方案还有哪些?测定一定时间内:
△ c
v = ——
△ t
化学反应速率可用_________________内 _________________或______________ __ 来表示。 (4)常用单位:mol·(L·min)-1或mol·(L·s)-1 一、化学反应速率是平均速率,而不是瞬时速率。无负值!(1)概念:用来衡量化学反应进行快慢程度的物理量 (2)表示方法: 例:在2L的密闭容器中,加入1mol和3mol的H2和N2,发生 N2 + 3H2 2NH3 ,在2s末时,测得容器中含有0.4mo l的NH3,求用不同物质计算该反应的化学反应速率。 1 3 0 2.40.8 0.2 0.6 0.4v(N2)=△c/△t= 0.1mol/L/2s = 0.05mol/(L·s)
v(H2) = △c/△ t = 0.3mol/L / 2sn = 0.15mol/(L·s)
v(NH3) = △c/△ t = 0.2mol/L / 2min = 0.1 mol/(L·s)0.4化学反应速率 V
mol/(L·s) 0.4 1.2 0.8 思考:以上三者数值是否相等?是否矛盾?有何规律?在同一个反应中,各物质的反应速率之比等于方程式中的化学计量数(系数)之比。即:
v (N2 ):v (H2 ): v (NH3 )= 1 :3 :2 aA+Bb=cC+Dd
v(A):v(B):v(C):v(D)=a:b:c:d N2 + 3H2 2NH3注意:(1)化学反应速率表示的是平均速率,不是瞬时速率;(2)无论浓度增加还是减少,一般取正值,因此化学反应速率一般为正值;(3)固体和纯液体的浓度视为常数(保持不变),一般不用固体物质与液体物质表示反应速率。(4)在同一反应体系中用不同物质来表示反应速率时,其数值是可以不同的,但是这些数值都表示同一个反应速率。因此化学反应速率的表示必须说明用哪种物质来做标准。(5)对于同一容器中的一般反应,化学反应速率之比等于浓度的变化比,等于化学计量数之比。练 习1.对于反应Fe+2HCl=FeCl2+H2,2s内FeCl2的
物质的量浓度由2mol/L变为4mol/L,试用
FeCl2的物质的量浓度的变化来描述此反应的
快慢。
解:
v = △ c/ △t =( 4mol/L-2mol/L)/2s
= 2 mol /(L · s)根据下图回答:1、反应物是__________.2、2min内A的平均速率是___________3、写出化学方程式A、B2.5mol/(L·min)练习解析:反应物随着反应进行,物质的量或物质的量浓度减小,生成物的物质的量或物质的量浓度增大,因此A、B为反应物,C为生成物;根据化学反应速率的数学表达式v(A)=(6-1)/2mol/(L·min)=2.5 mol/(L·min);根据化学反应速率之比等于变化浓度比,等于化学计量数之比,即计量数之比为( 6-1 )( 7-3):4=5:4:4 ④﹥ ②= ③﹥ ①注意:在同一反应中,反应速率的大小不能单纯地看数值大小,因为速率大小与表示速率的物质在反应中的化学计量有关;同时注意单位。完成课本实验2-1 按图安装两套装置,在锥形瓶内各盛有2g锌粒(颗粒大小基本相同),然后通过分液漏斗分别加入40mL 1mol/L和40mL 4mL/L的硫酸,比较二者收集10mLH2所用的时间。实验步骤:
1、连接实验装置
2、检查装置的气密性
3、先向锥形瓶中加入锌粒,然后再向分液漏斗中加入稀硫酸
4、使稀硫酸滴入锥形瓶与锌粒反应
5、观察收集10mLH2所用的时间 注意事项:
1、注意安全,团结协作
2、如何检查装置的气密性
3、何时计时,用何仪器计时
4、稀硫酸滴入时注意:
a:保持导气管顺畅
b:液体快速滴下
c:滴完后迅速关闭分液漏斗活塞结论: 锌跟硫酸反应产生气泡,收集10 mL气体。浓硫酸所用的时间比稀硫酸所用的时间短实验数据:实验现象:4mol/L的硫酸与锌反应比1mol/L的硫酸
与锌反应快。 测量化学反应速率的常见方法1、量气法2、比色法3、电导法4、激光技术法讨论:除本实验测定速率的方法外,可行的方案还有哪些?测定一定时间内:
