专题2.3.3+化学平衡常数及相关计算(课件)-2017-2018学年高二化学同步精品课堂(选修4)
文档属性
| 名称 | 专题2.3.3+化学平衡常数及相关计算(课件)-2017-2018学年高二化学同步精品课堂(选修4) |
|
|
| 格式 | zip | ||
| 文件大小 | 93.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-06 00:00:00 | ||
图片预览







文档简介
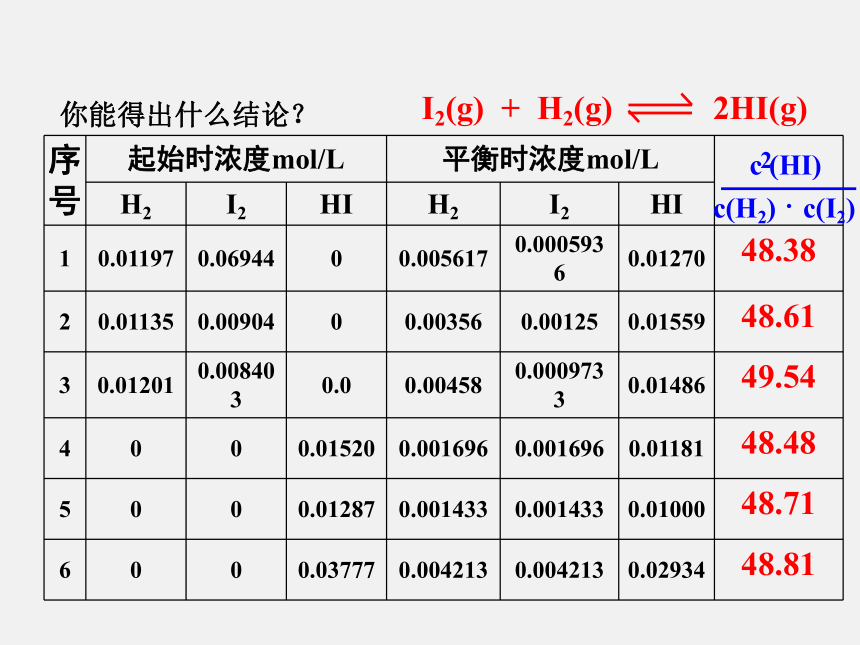
课件14张PPT。你能得出什么结论? 通过分析实验数据得出:化学平衡常数只与温度有关 (2)常数K与反应物的起始浓度大小无关; (3)常数K与正向建立还是逆向建立平衡无关。一定温度下,对于已达平衡的反应体系中,生成物以它的化学计量数为乘幂的浓度之积除以反应物以它的化学计量数为乘幂的浓度之积是个常数。1、定义:化学平衡常数:2、平衡常数的数学表达式及单位: 浓度的单位为mol·L-1 K的单位为(mol·L-1)?n;其中c为各组分的平衡浓度 化学平衡常数只与温度有关,而与反应物或生成物的浓度无关。1、化学平衡关系式中只包括气态物质和溶液中各溶质的浓度。反应中有固体和纯液体参加,它们的浓度是固定不变的,例:CaCO3(s) CaO(s)+CO2(g)K=c(CO2)2、同一化学反应,可以用不同的化学反应式来表示,每个化学方程式都有自己的平衡常数关系式及相应的平衡常数。 3、多重平衡规则
若干方程式相加(减),总反应的平衡常数等于分步平衡常数之积(商)例: 2NO2(g) N2O4(g)、N2O4(g) 2NO2(g)K1 ? K2 ,
K1 = 1/K2K1= (1)平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。 K值越大,正向反应进行的程度越大。 (2)平衡常数数值大小,只能大致反映一个可逆反应的正向反应进行的最大程度,并不能预示反应达到平衡所需要的时间。一般:
K >105,认为正反应进行得较完全
K <10-5 认为 正反应很难进行(逆反应较完全)
10-5 ≤K ≤ 105 认为是可逆反应(3)利用K值可判断某状态是否处于平衡状态 Q<K ,V正>V逆,反应向正方向进行Q=K ,V正=V逆,反应处于平衡状态Q>K ,V正<V逆,反应向逆方向进行则:(4)利用温度改变时K值的变化可判断反应的热效应若升高温度,K增大,则正反应为吸热反应;若升高温度,K减小,则正反应为放热反应。平衡常数表达式与方程式的关系⑴纯液体(如水)和固体不出现在K表达式中(2)K表达式与化学方程式书写形式有关(3)同一化学反应,正、逆反应的平衡常数互为倒数已知反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) △H>0
其平衡常数为:_______________。已知1100℃,K=0.263。1100℃时,测得c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应_______(填“是”或“否”) 处于平衡状态。利用K可判断反应是否建立平衡状态Qc=c(CO2)/c(CO)① QC<K ,反应向正方向进行② QC=K ,反应处于平衡状态③QC>K ,反应向逆方向进行K=c(CO2)/c(CO)否 在一定条件下,可逆反应达化学平衡状态时,某一反应物消耗量占该反应物起始量的质量分数,叫该反应物的转化率。 公式:a=△c/c始×100% 转化率化学平衡的有关计算 例1: ? 445℃时,将0.1mol I2与0.02mol H2通入2L密闭容器中,达平衡后有0.03molHI生成。求:各物质的起始浓度与平衡浓度 。 提示:
c始(mol/L)?? 0.01 0.05??????????? 0
c变(mol/L)????? x ?? x? ????????????2x
c平(mol/L)????0.015
0+2x=0.015 mol/L?
x=0.0075mol/L 平衡浓度:
c(I2)平=C(I2)始-△C(I2)
=0.05 mol/L -0.0075 mol/L
=0.0425mol/Lc(H2)平=0.01-0.0075=0.0025mol/L
c(HI)平=c(HI)始+△c(HI)
=0.015mol/L 例2:一定条件下,在密闭容器内将N2和H2以体积比为1∶3混合,当反应达平衡时,混合气中氨占25%(体积比),若混合前有100mol N2,求平衡后N2、H2、NH3的物质的量及N2的转化率。 提示:设反应消耗xmolN2
△n(始) 100? 300? ???????0
△n????? ?? x?? 3x?? ???????2x
n(平) 100-x 300-3x? ?2x(mol)
x=40mol
n(N2)平=100mol-xmol=100mol-40mol
=60mol
n(H2)平=300mol-3xmol=180mol
n(NH3)平= 2x=80mol
a=40/100×100%=40%
若干方程式相加(减),总反应的平衡常数等于分步平衡常数之积(商)例: 2NO2(g) N2O4(g)、N2O4(g) 2NO2(g)K1 ? K2 ,
K1 = 1/K2K1= (1)平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。 K值越大,正向反应进行的程度越大。 (2)平衡常数数值大小,只能大致反映一个可逆反应的正向反应进行的最大程度,并不能预示反应达到平衡所需要的时间。一般:
K >105,认为正反应进行得较完全
K <10-5 认为 正反应很难进行(逆反应较完全)
10-5 ≤K ≤ 105 认为是可逆反应(3)利用K值可判断某状态是否处于平衡状态 Q<K ,V正>V逆,反应向正方向进行Q=K ,V正=V逆,反应处于平衡状态Q>K ,V正<V逆,反应向逆方向进行则:(4)利用温度改变时K值的变化可判断反应的热效应若升高温度,K增大,则正反应为吸热反应;若升高温度,K减小,则正反应为放热反应。平衡常数表达式与方程式的关系⑴纯液体(如水)和固体不出现在K表达式中(2)K表达式与化学方程式书写形式有关(3)同一化学反应,正、逆反应的平衡常数互为倒数已知反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) △H>0
其平衡常数为:_______________。已知1100℃,K=0.263。1100℃时,测得c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应_______(填“是”或“否”) 处于平衡状态。利用K可判断反应是否建立平衡状态Qc=c(CO2)/c(CO)① QC<K ,反应向正方向进行② QC=K ,反应处于平衡状态③QC>K ,反应向逆方向进行K=c(CO2)/c(CO)否 在一定条件下,可逆反应达化学平衡状态时,某一反应物消耗量占该反应物起始量的质量分数,叫该反应物的转化率。 公式:a=△c/c始×100% 转化率化学平衡的有关计算 例1: ? 445℃时,将0.1mol I2与0.02mol H2通入2L密闭容器中,达平衡后有0.03molHI生成。求:各物质的起始浓度与平衡浓度 。 提示:
c始(mol/L)?? 0.01 0.05??????????? 0
c变(mol/L)????? x ?? x? ????????????2x
c平(mol/L)????0.015
0+2x=0.015 mol/L?
x=0.0075mol/L 平衡浓度:
c(I2)平=C(I2)始-△C(I2)
=0.05 mol/L -0.0075 mol/L
=0.0425mol/Lc(H2)平=0.01-0.0075=0.0025mol/L
c(HI)平=c(HI)始+△c(HI)
=0.015mol/L 例2:一定条件下,在密闭容器内将N2和H2以体积比为1∶3混合,当反应达平衡时,混合气中氨占25%(体积比),若混合前有100mol N2,求平衡后N2、H2、NH3的物质的量及N2的转化率。 提示:设反应消耗xmolN2
△n(始) 100? 300? ???????0
△n????? ?? x?? 3x?? ???????2x
n(平) 100-x 300-3x? ?2x(mol)
x=40mol
n(N2)平=100mol-xmol=100mol-40mol
=60mol
n(H2)平=300mol-3xmol=180mol
n(NH3)平= 2x=80mol
a=40/100×100%=40%
