专题2.3.1+氧化还原反应(课件)-2017-2018学年高一化学同步精品课堂(必修1)
文档属性
| 名称 | 专题2.3.1+氧化还原反应(课件)-2017-2018学年高一化学同步精品课堂(必修1) |
|
|
| 格式 | zip | ||
| 文件大小 | 897.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-07 00:00:00 | ||
图片预览










文档简介
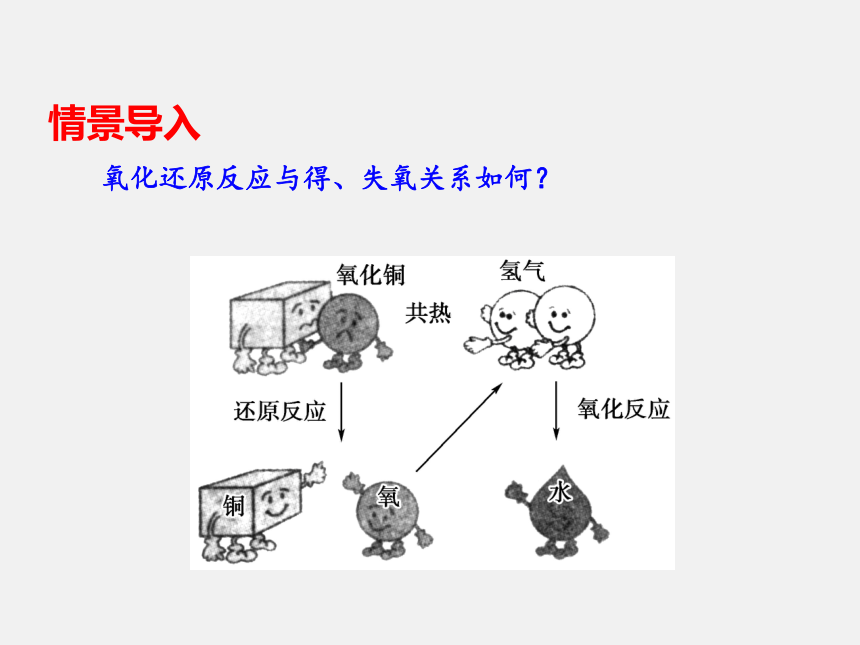
课件44张PPT。氧化还原反应与得、失氧关系如何?情景导入学习目标1.了解氧化反应、还原反应的概念。
2.从化合价升降、电子的得失或电子对偏移角度理解氧化还原反应。
3.培养由现象到本质的科学探究意识。一、氧化还原反应基础梳理1.概念
(1)反应类型
①氧化反应:物质所含元素化合价___________的反应
②还原反应:物质所含元素化合价___________的反应
③氧化还原反应:__________________的化学反应升高降低有元素化合价升降(2)反应物
①氧化剂:在反应中_______电子(或电子对______)的物质
②还原剂:在反应中_______电子(或电子对______)的物质
(3)产物
①氧化产物:_________反应得到的产物
②还原产物:_________反应得到的产物得到失去氧化还原偏向偏离(4)物质性质
①氧化性:氧化剂所表现出的_________电子的性质。
②还原性:还原剂所表现出的_________电子的性质。得失2.特征
一种或几种元素的_________发生变化。
3.实质
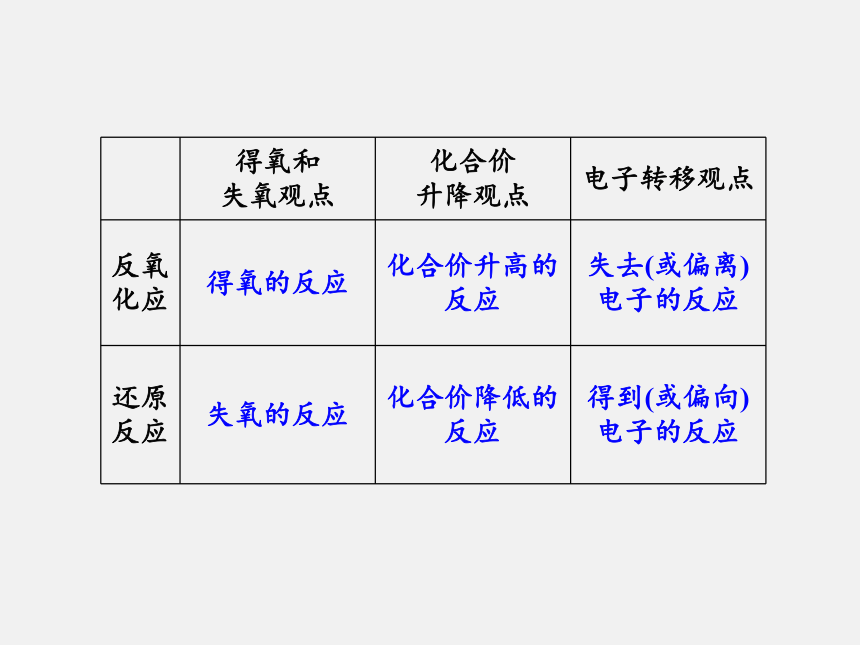
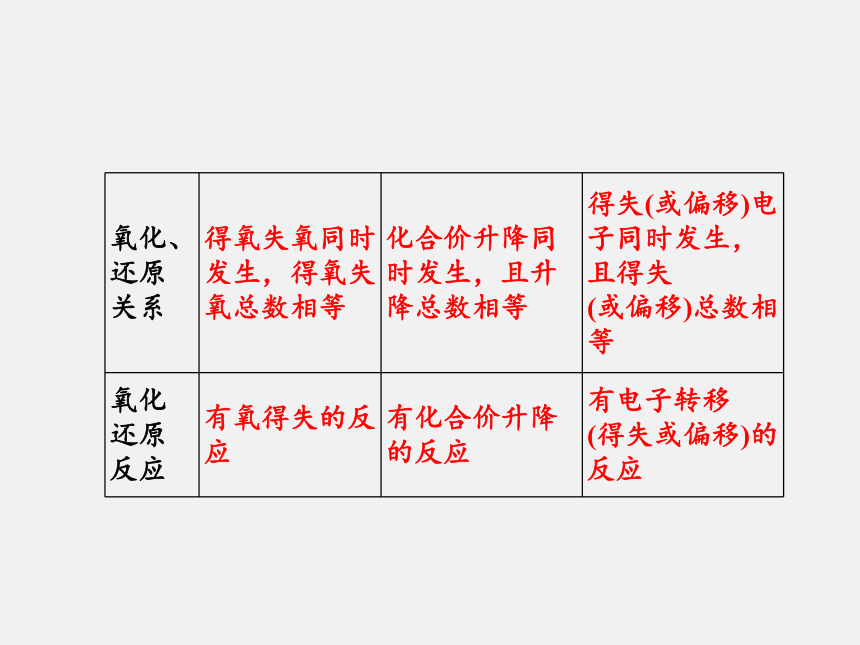
氧化还原反应的实质是电子的_____(即电子的____或_____)。化合价转移得失偏移拓展延伸从不同角度认识氧化还原反应1.得氧失氧的角度:初中是从得氧和失氧的角度分析,凡得氧的反应为氧化反应,失氧的反应为还原反应。发生得失氧的反应均为氧化还原反应。2.化合价升降的角度(特征)
氧化还原反应必有化合价的变化,元素化合价升高的反应为氧化反应,元素化合价降低的反应为还原反应。这可作为判断氧化还原反应的依据。3.电子转移的角度(本质)
凡是有电子转移(得失或偏移)的反应都是氧化还原反应。
凡是没有电子转移的反应都是非氧化还原反应。这是氧化还原反应的本质。三种角度的比较如下表:典型例题分析1.下列关于氧化还原反应的叙述,正确的是( )
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.作氧化剂的物质不能作还原剂二、氧化还原反应与四种基本反应类型的关系1.化学反应的分类拓展延伸2.氧化还原反应与四种基本反应类型的关系
如图所示:【解析】有元素化合价的改变,且无单质参加和生成
的反应。
【答案】A典型例题分析二、氧化还原反应概念之间的关系+1氧化-1Cl2Na基础梳理共用电子对+1-1还原三、氧化还原反应各概念之间有何关系1.氧化还原反应各概念之间的关系拓展延伸理解氧化还原反应概念时,要理清两条主线:
还(还原剂)→升(化合价升高)→失(失去电子)→氧(被氧化)→氧(氧化产物)
氧(氧化剂)→降(化合价降低)→得(得电子)→还(被还原)→还(还原产物)
2.化合价的升降是氧化还原反应的表现特征,电子得失(或偏移)是氧化还原反应的本质。3.在Fe+CuSO4=FeSO4+Cu反应中,________是还原剂,________是氧化剂,________被氧化,________被还原,Cu是________产物,FeSO4是________产物。典型例题分析四、氧化还原反应中电子转移的表示方法1.双线桥法
表明反应前后同一元素原子间的电子转移情况。
(1)双线桥法的基本步骤(2)注意事项
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③还原剂失去电子总数与氧化剂得到电子总数相等。2.单线桥法
表明反应前后不同元素原子的电子转移情况。
(1)单线桥法的基本步骤(2)注意事项
①单线桥表示氧化剂和还原剂中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移数目;
③箭头标明电子转移的方向;
④单线桥箭头从还原剂中失电子的元素原子指向氧化剂中得电子的元素原子。典型例题分析针对训练1.工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是(多选)( )
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂
D.1 mol氧化剂在反应中得到1 mol电子【答案】AD【名师点睛】分析氧化还原反应中基本概念及其关系的解题方法:
(1)能正确标出反应前后变价元素的化合价。
(2)熟记氧化还原反应中各概念之间的对应关系。
(3)在分析电子转移总数时,不能将氧化剂得电子数和失电子数加和作为转移电子数。解这类问题应注意:
(1)准确判断给出的化学反应是否为氧化还原反应。
(2)明确用双线桥法表示电子转移的方法及注意事项。
(3)明确用单线桥法表示电子转移的方法及注意事项。【名师点睛】3.下列过程中发生了氧化还原反应的是( )【解析】A、B、C项均未发生化学变化。D项为燃料燃烧反应。属于氧化还原反应。
【答案】D【解析】A、B、D中各元素的化合价都没有发生变化,不是氧化还原反应;C中锰、氧元素化合价发生了变化,是氧化还原反应。
【答案】C5.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是( )【解析】 化学反应的分类应按照一定的标准。除分为四种基本类型以外,还可根据有无离子参加分为离子反应、非离子反应,根据有无电子得失分为氧化还原反应、非氧化还原反应。四种基本反应类型中均有离子反应、非离子反应,在氧化还原反应中也有离子反应和非离子反应。复分解反应一定不是氧化还原反应,置换反应一定是氧化还原反应。
【答案】 A
2.从化合价升降、电子的得失或电子对偏移角度理解氧化还原反应。
3.培养由现象到本质的科学探究意识。一、氧化还原反应基础梳理1.概念
(1)反应类型
①氧化反应:物质所含元素化合价___________的反应
②还原反应:物质所含元素化合价___________的反应
③氧化还原反应:__________________的化学反应升高降低有元素化合价升降(2)反应物
①氧化剂:在反应中_______电子(或电子对______)的物质
②还原剂:在反应中_______电子(或电子对______)的物质
(3)产物
①氧化产物:_________反应得到的产物
②还原产物:_________反应得到的产物得到失去氧化还原偏向偏离(4)物质性质
①氧化性:氧化剂所表现出的_________电子的性质。
②还原性:还原剂所表现出的_________电子的性质。得失2.特征
一种或几种元素的_________发生变化。
3.实质
氧化还原反应的实质是电子的_____(即电子的____或_____)。化合价转移得失偏移拓展延伸从不同角度认识氧化还原反应1.得氧失氧的角度:初中是从得氧和失氧的角度分析,凡得氧的反应为氧化反应,失氧的反应为还原反应。发生得失氧的反应均为氧化还原反应。2.化合价升降的角度(特征)
氧化还原反应必有化合价的变化,元素化合价升高的反应为氧化反应,元素化合价降低的反应为还原反应。这可作为判断氧化还原反应的依据。3.电子转移的角度(本质)
凡是有电子转移(得失或偏移)的反应都是氧化还原反应。
凡是没有电子转移的反应都是非氧化还原反应。这是氧化还原反应的本质。三种角度的比较如下表:典型例题分析1.下列关于氧化还原反应的叙述,正确的是( )
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.作氧化剂的物质不能作还原剂二、氧化还原反应与四种基本反应类型的关系1.化学反应的分类拓展延伸2.氧化还原反应与四种基本反应类型的关系
如图所示:【解析】有元素化合价的改变,且无单质参加和生成
的反应。
【答案】A典型例题分析二、氧化还原反应概念之间的关系+1氧化-1Cl2Na基础梳理共用电子对+1-1还原三、氧化还原反应各概念之间有何关系1.氧化还原反应各概念之间的关系拓展延伸理解氧化还原反应概念时,要理清两条主线:
还(还原剂)→升(化合价升高)→失(失去电子)→氧(被氧化)→氧(氧化产物)
氧(氧化剂)→降(化合价降低)→得(得电子)→还(被还原)→还(还原产物)
2.化合价的升降是氧化还原反应的表现特征,电子得失(或偏移)是氧化还原反应的本质。3.在Fe+CuSO4=FeSO4+Cu反应中,________是还原剂,________是氧化剂,________被氧化,________被还原,Cu是________产物,FeSO4是________产物。典型例题分析四、氧化还原反应中电子转移的表示方法1.双线桥法
表明反应前后同一元素原子间的电子转移情况。
(1)双线桥法的基本步骤(2)注意事项
①箭头、箭尾对应化合价变化的同种元素。
②必须注明“得到”或“失去”的字样。
③还原剂失去电子总数与氧化剂得到电子总数相等。2.单线桥法
表明反应前后不同元素原子的电子转移情况。
(1)单线桥法的基本步骤(2)注意事项
①单线桥表示氧化剂和还原剂中变价元素原子得失电子的情况;
②不需标明“得”或“失”,只标明电子转移数目;
③箭头标明电子转移的方向;
④单线桥箭头从还原剂中失电子的元素原子指向氧化剂中得电子的元素原子。典型例题分析针对训练1.工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是(多选)( )
A.SO2在反应中被氧化
B.NaClO3在反应中失去电子
C.H2SO4在反应中作氧化剂
D.1 mol氧化剂在反应中得到1 mol电子【答案】AD【名师点睛】分析氧化还原反应中基本概念及其关系的解题方法:
(1)能正确标出反应前后变价元素的化合价。
(2)熟记氧化还原反应中各概念之间的对应关系。
(3)在分析电子转移总数时,不能将氧化剂得电子数和失电子数加和作为转移电子数。解这类问题应注意:
(1)准确判断给出的化学反应是否为氧化还原反应。
(2)明确用双线桥法表示电子转移的方法及注意事项。
(3)明确用单线桥法表示电子转移的方法及注意事项。【名师点睛】3.下列过程中发生了氧化还原反应的是( )【解析】A、B、C项均未发生化学变化。D项为燃料燃烧反应。属于氧化还原反应。
【答案】D【解析】A、B、D中各元素的化合价都没有发生变化,不是氧化还原反应;C中锰、氧元素化合价发生了变化,是氧化还原反应。
【答案】C5.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,正确的是( )【解析】 化学反应的分类应按照一定的标准。除分为四种基本类型以外,还可根据有无离子参加分为离子反应、非离子反应,根据有无电子得失分为氧化还原反应、非氧化还原反应。四种基本反应类型中均有离子反应、非离子反应,在氧化还原反应中也有离子反应和非离子反应。复分解反应一定不是氧化还原反应,置换反应一定是氧化还原反应。
【答案】 A
