第二节 化学计量在实验中的应用 第3课时 1.2.3 物质的量在化学实验中的应用(知识点与同步练习)
文档属性
| 名称 | 第二节 化学计量在实验中的应用 第3课时 1.2.3 物质的量在化学实验中的应用(知识点与同步练习) |

|
|
| 格式 | zip | ||
| 文件大小 | 722.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-10 00:00:00 | ||
图片预览


文档简介
1.2.3
物质的量在化学实验中的应用
一、物质的量浓度
注意:在公式c(B)=中V指溶液的体积而非溶剂的体积。
二、一定物质的量浓度溶液的配制
以配制100
mL
1.00
mol·L-1
NaCl溶液为例。
1.主要仪器
(1)托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、100
mL容量瓶。
(2)容量瓶
注意:容量瓶使用前要检查是否漏水。
2.实验步骤
(1)计算:根据n=c×V可知,n(NaCl)=0.1
mol,m(NaCl)=5.85
g。
(2)称量。
(3)溶解。
注意:溶解过程中要用玻璃棒搅拌,溶解结束后要冷却至室温。
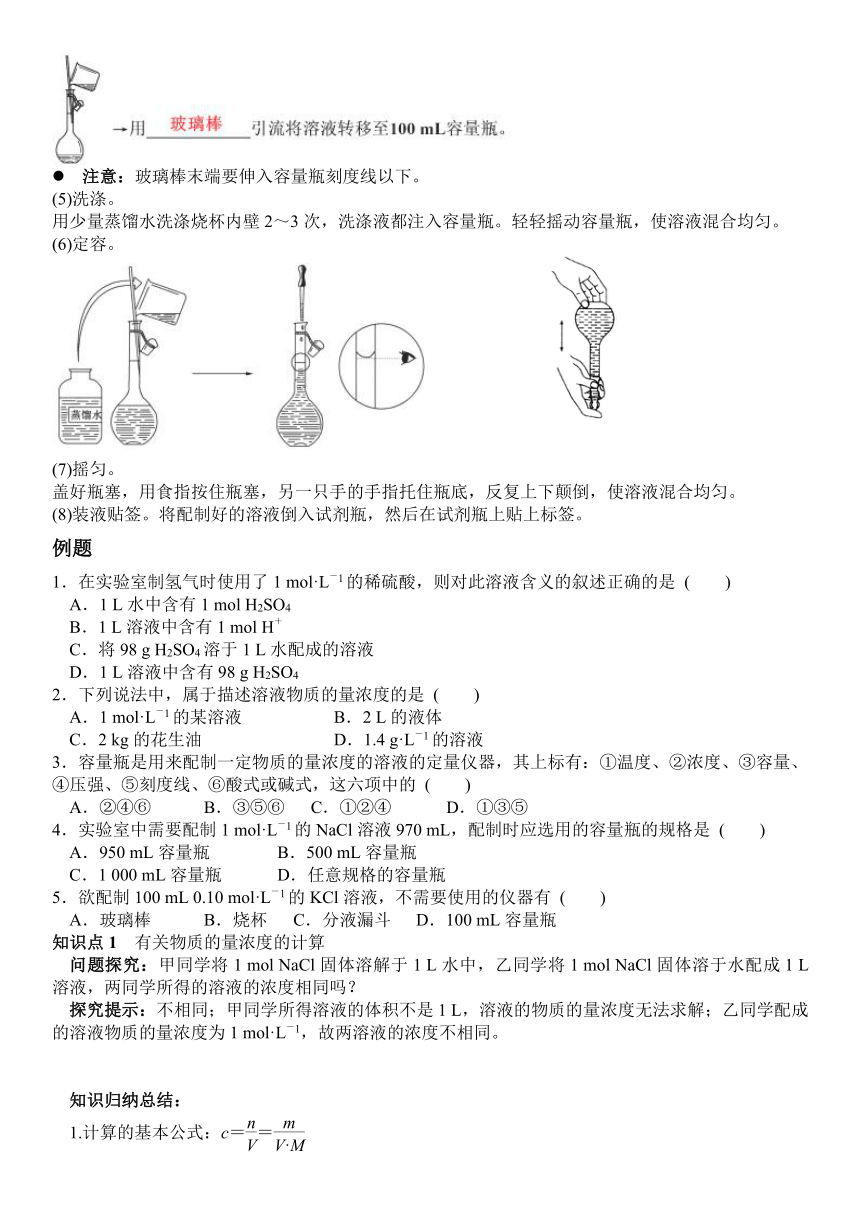
(4)移液。
注意:玻璃棒末端要伸入容量瓶刻度线以下。
(5)洗涤。
用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
(6)定容。
(7)摇匀。
盖好瓶塞,用食指按住瓶塞,另一只手的手指托住瓶底,反复上下颠倒,使溶液混合均匀。
(8)装液贴签。将配制好的溶液倒入试剂瓶,然后在试剂瓶上贴上标签。
例题
1.在实验室制氢气时使用了1
mol·L-1的稀硫酸,则对此溶液含义的叙述正确的是
( )
A.1
L水中含有1
mol
H2SO4
B.1
L溶液中含有1
mol
H+
C.将98
g
H2SO4溶于1
L水配成的溶液
D.1
L溶液中含有98
g
H2SO4
2.下列说法中,属于描述溶液物质的量浓度的是
( )
A.1
mol·L-1的某溶液
B.2
L的液体
C.2
kg的花生油
D.1.4
g·L-1的溶液
3.容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式,这六项中的
( )
A.②④⑥
B.③⑤⑥
C.①②④
D.①③⑤
4.实验室中需要配制1
mol·L-1的NaCl溶液970
mL,配制时应选用的容量瓶的规格是
( )
A.950
mL容量瓶
B.500
mL容量瓶
C.1
000
mL容量瓶
D.任意规格的容量瓶
5.欲配制100
mL
0.10
mol·L-1的KCl溶液,不需要使用的仪器有
( )
A.玻璃棒
B.烧杯
C.分液漏斗
D.100
mL容量瓶
知识点1 有关物质的量浓度的计算
问题探究:甲同学将1
mol
NaCl固体溶解于1
L水中,乙同学将1
mol
NaCl固体溶于水配成1
L溶液,两同学所得的溶液的浓度相同吗?
探究提示:不相同;甲同学所得溶液的体积不是1
L,溶液的物质的量浓度无法求解;乙同学配成的溶液物质的量浓度为1
mol·L-1,故两溶液的浓度不相同。
知识归纳总结:
1.计算的基本公式:c==
其中n为溶质的物质的量,m为溶质的质量,M为溶质的摩尔质量,c为溶质的物质的量浓度,V为溶液的体积。
2.计算的基本类型和方法:
(1)已知溶质的质量。
eq
\o(――→,\s\up20(n=))eq
\x(n)eq
\o(――→,\s\up20(n=))eq
\x(c)
(2)已知溶液中某种粒子的数目。
eq
\o(――→,\s\up20(n=))eq
\x(n)eq
\o(――→,\s\up20(n=))eq
\x(c)
(3)标准状况下,气体溶质的物质的量浓度的计算。
c=
3.物质的量浓度与溶质的质量分数的换算:
(1)换算公式:cB=
mol·L-1
M:溶质B的摩尔质量ρ:溶液密度(g·mL-1)
(2)推导方法
设溶液体积为1
L,则
cB===
mol·L-1
4.溶液的稀释与混合:
(1)稀释规律。
①语言描述:将浓溶液加水稀释,稀释前后溶质的物质的量和质量都保持不变。
②公式:c(浓)·V(浓)=c(稀)·V(稀)
(2)混合规律。
①语言描述:同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)。
②公式:c1·V1+c2·V2=c(混)·V(混)
注意
(1)进行物质的量浓度的有关计算时,各种情况下最终落脚点是物质的量浓度的定义式c=,要充分利用有关物质的量的各种计算公式,发挥物质的量的桥梁作用。
(2)用公式c=进行换算时,要注意ρ的单位为g/mL,c的单位为mol/L。
例题
1.
密度为d
g/cm3的溶液V
mL含有摩尔质量为M的溶质m
g,其物质的量浓度为c
mol/L,质量分数为W%,下列表示式不正确的是( )
A.c=1
000m/(VM)
B.m=d·V·W/100
C.d=cM/(10W)
D.W%=(cM/1
000d)%
2.
如图是某校化学实验室中硫酸试剂标签上的部分内容。据此下列说法错误的是
( )
A.该硫酸的物质的量浓度为9.2
mol·L-1
B.100
mL该硫酸的质量是184
g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.取该硫酸62.5
mL稀释至250
mL,得到稀硫酸的浓度为4.6
mol·L-1
知识点2 一定物质的量浓度溶液的配制
问题探究:1.在配制NaCl溶液的实验中,玻璃棒用到了几次,其作用分别是什么?
2.为什么要洗涤烧杯内壁及玻璃棒,并将洗涤液也注入容量瓶?
探究提示:1.实验中用到了3次玻璃棒,其作用有2种:(1)搅拌,加快NaCl固体溶解;
(2)引流(①转移NaCl溶液,②转移蒸馏水)。
2.为保证溶质不损失,应将烧杯内壁及玻璃棒洗涤2~3次,且将洗涤液也注入容量瓶。
知识归纳总结:
1.容量瓶的使用:
(1)使用前必须检查是否漏水。其操作为向容量瓶注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把容量瓶倒立,观察瓶塞周围是否漏水。如不漏,将容量瓶正立并将瓶塞旋转180°后塞紧,再检查是否漏水。
(2)容量瓶使用的四个“不能”。
①不能将固体或浓溶液直接在容量瓶中溶解或稀释;
②不能作为反应容器或用来长期贮存溶液;
③不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的;
④不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
2.溶液配制过程中的误差分析:
(1)原理依据——公式法:c(B)==,c(B)的误差取决于m和V的值是否准确。
(2)误差分析
以配制一定物质的量浓度的NaOH溶液为例
注意:配制一定物质的量浓度溶液的操作步骤及所用仪器
例题
1.
实验室需配制250
mL
0.1
mol·L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制250
mL
0.1
mol·L-1的Na2CO3溶液
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30
mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,并轻轻摇匀
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2
cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________,溶液注入容量瓶前需恢复到室温,这是因为____________________
_________。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或”无影响”)
若容量瓶中有少量蒸馏水________;
若定容时俯视刻度线______。
2.
下列有关操作或说法正确的是
( )
A.配制一定物质的量浓度的NaOH溶液(如下图1)
B.配制一定物质的量浓度的NaOH溶液(如下图2)
C.称取2.0
g
NaOH的操作:先在托盘上各放1张滤纸,
然后在右盘上添加2
g砝码,左盘上添加NaOH固体
D.配制0.1
mol·L-1NaOH溶液,
应用蒸馏水将容量瓶洗涤干净才能使用
溶液组成中的三个守恒
1.溶质质量守恒
(1)溶液稀释或浓缩前后,m(溶质)不变,即:m(浓溶液)·ω(浓溶液)=m(稀溶液)·ω(稀溶液)
(2)若溶液密度为ρg·mL-1,溶质质量分数为ω,溶质摩尔质量为M(单位:g·mol-1),根据溶质质量相等,得:cB·V·M=1
000×ρ·V·ω,等式两边同除以M,得:cB=
2.溶质物质的量守恒
溶液稀释或浓缩前后,n(溶质)不变,即:c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
3.溶液浓度守恒
将一份溶液分为若干份,各份的浓度(包括质量分数和物质的量浓度)均与原溶液浓度相等。
例题
1.
请回答下列问题:
(1)向20
mL质量分数为98%、密度为1.836
g·mL-1的浓硫酸中加入80
mL水,冷却至室温,所得溶液中H2SO4的物质的量浓度____(填“是”或“否”)等于3.672
mol·L-1,理由是_______________________。
(2)向20
mL
0.2
mol·L-1的HCl溶液中滴入10
mL
0.2
mol·L-1的NaOH溶液,再加水稀释至100
mL常温下的溶液,其中溶质的物质的量浓度是_____________________________________。
习题
1.实验室需用2
mol·L-1硫酸铜溶液450
mL,配制时应称取的固体质量是
( )
A.144.0
g CuSO4
B.144.0
g CuSO4·5H2O
C.225.0
g CuSO4·5H2O
D.250.0
g CuSO4·5H2O
2.用氢氧化钠固体配制0.10
mol·L-1的氢氧化钠溶液,下列说法中错误的是
( )
A.定容时仰视容量瓶刻度线,会造成所配溶液浓度偏小
B.移液时不慎有部分液体溅出,会造成所配溶液浓度偏小
C.称量时托盘上要垫上干净的称量纸
D.定容摇匀后发现液面下降,不应再加蒸馏水
3.在80
g密度为d
g·cm-3的硫酸铁溶液中,含有2.8
g
Fe3+,则此溶液中SO的物质的量浓度为(单位为mol·L-1)
( )
A.d
B.d
C.d
D.d
4.某同学将标准状况下44.8
L的HCl气体溶于水,配成500
mL的溶液。
(1)根据公式_
__,可知该HCl气体的物质的量为__
。
(2)根据公式__
,可知所配成的盐酸溶液的物质的量浓度为_
。
(3)100
mL盐酸中含HCl的物质的量为_
。
图2
图1
物质的量在化学实验中的应用
一、物质的量浓度
注意:在公式c(B)=中V指溶液的体积而非溶剂的体积。
二、一定物质的量浓度溶液的配制
以配制100
mL
1.00
mol·L-1
NaCl溶液为例。
1.主要仪器
(1)托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、100
mL容量瓶。
(2)容量瓶
注意:容量瓶使用前要检查是否漏水。
2.实验步骤
(1)计算:根据n=c×V可知,n(NaCl)=0.1
mol,m(NaCl)=5.85
g。
(2)称量。
(3)溶解。
注意:溶解过程中要用玻璃棒搅拌,溶解结束后要冷却至室温。
(4)移液。
注意:玻璃棒末端要伸入容量瓶刻度线以下。
(5)洗涤。
用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
(6)定容。
(7)摇匀。
盖好瓶塞,用食指按住瓶塞,另一只手的手指托住瓶底,反复上下颠倒,使溶液混合均匀。
(8)装液贴签。将配制好的溶液倒入试剂瓶,然后在试剂瓶上贴上标签。
例题
1.在实验室制氢气时使用了1
mol·L-1的稀硫酸,则对此溶液含义的叙述正确的是
( )
A.1
L水中含有1
mol
H2SO4
B.1
L溶液中含有1
mol
H+
C.将98
g
H2SO4溶于1
L水配成的溶液
D.1
L溶液中含有98
g
H2SO4
2.下列说法中,属于描述溶液物质的量浓度的是
( )
A.1
mol·L-1的某溶液
B.2
L的液体
C.2
kg的花生油
D.1.4
g·L-1的溶液
3.容量瓶是用来配制一定物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式,这六项中的
( )
A.②④⑥
B.③⑤⑥
C.①②④
D.①③⑤
4.实验室中需要配制1
mol·L-1的NaCl溶液970
mL,配制时应选用的容量瓶的规格是
( )
A.950
mL容量瓶
B.500
mL容量瓶
C.1
000
mL容量瓶
D.任意规格的容量瓶
5.欲配制100
mL
0.10
mol·L-1的KCl溶液,不需要使用的仪器有
( )
A.玻璃棒
B.烧杯
C.分液漏斗
D.100
mL容量瓶
知识点1 有关物质的量浓度的计算
问题探究:甲同学将1
mol
NaCl固体溶解于1
L水中,乙同学将1
mol
NaCl固体溶于水配成1
L溶液,两同学所得的溶液的浓度相同吗?
探究提示:不相同;甲同学所得溶液的体积不是1
L,溶液的物质的量浓度无法求解;乙同学配成的溶液物质的量浓度为1
mol·L-1,故两溶液的浓度不相同。
知识归纳总结:
1.计算的基本公式:c==
其中n为溶质的物质的量,m为溶质的质量,M为溶质的摩尔质量,c为溶质的物质的量浓度,V为溶液的体积。
2.计算的基本类型和方法:
(1)已知溶质的质量。
eq
\o(――→,\s\up20(n=))eq
\x(n)eq
\o(――→,\s\up20(n=))eq
\x(c)
(2)已知溶液中某种粒子的数目。
eq
\o(――→,\s\up20(n=))eq
\x(n)eq
\o(――→,\s\up20(n=))eq
\x(c)
(3)标准状况下,气体溶质的物质的量浓度的计算。
c=
3.物质的量浓度与溶质的质量分数的换算:
(1)换算公式:cB=
mol·L-1
M:溶质B的摩尔质量ρ:溶液密度(g·mL-1)
(2)推导方法
设溶液体积为1
L,则
cB===
mol·L-1
4.溶液的稀释与混合:
(1)稀释规律。
①语言描述:将浓溶液加水稀释,稀释前后溶质的物质的量和质量都保持不变。
②公式:c(浓)·V(浓)=c(稀)·V(稀)
(2)混合规律。
①语言描述:同一溶质不同浓度的两溶液相混合,混合后,溶质的总物质的量(或总质量)等于混合前两溶液中溶质的物质的量之和(或质量之和)。
②公式:c1·V1+c2·V2=c(混)·V(混)
注意
(1)进行物质的量浓度的有关计算时,各种情况下最终落脚点是物质的量浓度的定义式c=,要充分利用有关物质的量的各种计算公式,发挥物质的量的桥梁作用。
(2)用公式c=进行换算时,要注意ρ的单位为g/mL,c的单位为mol/L。
例题
1.
密度为d
g/cm3的溶液V
mL含有摩尔质量为M的溶质m
g,其物质的量浓度为c
mol/L,质量分数为W%,下列表示式不正确的是( )
A.c=1
000m/(VM)
B.m=d·V·W/100
C.d=cM/(10W)
D.W%=(cM/1
000d)%
2.
如图是某校化学实验室中硫酸试剂标签上的部分内容。据此下列说法错误的是
( )
A.该硫酸的物质的量浓度为9.2
mol·L-1
B.100
mL该硫酸的质量是184
g
C.硫酸的摩尔质量与磷酸(H3PO4)的摩尔质量相同
D.取该硫酸62.5
mL稀释至250
mL,得到稀硫酸的浓度为4.6
mol·L-1
知识点2 一定物质的量浓度溶液的配制
问题探究:1.在配制NaCl溶液的实验中,玻璃棒用到了几次,其作用分别是什么?
2.为什么要洗涤烧杯内壁及玻璃棒,并将洗涤液也注入容量瓶?
探究提示:1.实验中用到了3次玻璃棒,其作用有2种:(1)搅拌,加快NaCl固体溶解;
(2)引流(①转移NaCl溶液,②转移蒸馏水)。
2.为保证溶质不损失,应将烧杯内壁及玻璃棒洗涤2~3次,且将洗涤液也注入容量瓶。
知识归纳总结:
1.容量瓶的使用:
(1)使用前必须检查是否漏水。其操作为向容量瓶注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把容量瓶倒立,观察瓶塞周围是否漏水。如不漏,将容量瓶正立并将瓶塞旋转180°后塞紧,再检查是否漏水。
(2)容量瓶使用的四个“不能”。
①不能将固体或浓溶液直接在容量瓶中溶解或稀释;
②不能作为反应容器或用来长期贮存溶液;
③不能将过冷或过热的溶液转移到容量瓶中,因为容量瓶的容积是在瓶身所标温度下确定的;
④不能配制任意体积的溶液,只能配制容量瓶上规定容积的溶液。
2.溶液配制过程中的误差分析:
(1)原理依据——公式法:c(B)==,c(B)的误差取决于m和V的值是否准确。
(2)误差分析
以配制一定物质的量浓度的NaOH溶液为例
注意:配制一定物质的量浓度溶液的操作步骤及所用仪器
例题
1.
实验室需配制250
mL
0.1
mol·L-1的Na2CO3溶液,填空并回答下列问题:
(1)配制250
mL
0.1
mol·L-1的Na2CO3溶液
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)____________。
A.用30
mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,并轻轻摇匀
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面最低点恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2
cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是_________________________,溶液注入容量瓶前需恢复到室温,这是因为____________________
_________。
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或”无影响”)
若容量瓶中有少量蒸馏水________;
若定容时俯视刻度线______。
2.
下列有关操作或说法正确的是
( )
A.配制一定物质的量浓度的NaOH溶液(如下图1)
B.配制一定物质的量浓度的NaOH溶液(如下图2)
C.称取2.0
g
NaOH的操作:先在托盘上各放1张滤纸,
然后在右盘上添加2
g砝码,左盘上添加NaOH固体
D.配制0.1
mol·L-1NaOH溶液,
应用蒸馏水将容量瓶洗涤干净才能使用
溶液组成中的三个守恒
1.溶质质量守恒
(1)溶液稀释或浓缩前后,m(溶质)不变,即:m(浓溶液)·ω(浓溶液)=m(稀溶液)·ω(稀溶液)
(2)若溶液密度为ρg·mL-1,溶质质量分数为ω,溶质摩尔质量为M(单位:g·mol-1),根据溶质质量相等,得:cB·V·M=1
000×ρ·V·ω,等式两边同除以M,得:cB=
2.溶质物质的量守恒
溶液稀释或浓缩前后,n(溶质)不变,即:c(浓溶液)·V(浓溶液)=c(稀溶液)·V(稀溶液)
3.溶液浓度守恒
将一份溶液分为若干份,各份的浓度(包括质量分数和物质的量浓度)均与原溶液浓度相等。
例题
1.
请回答下列问题:
(1)向20
mL质量分数为98%、密度为1.836
g·mL-1的浓硫酸中加入80
mL水,冷却至室温,所得溶液中H2SO4的物质的量浓度____(填“是”或“否”)等于3.672
mol·L-1,理由是_______________________。
(2)向20
mL
0.2
mol·L-1的HCl溶液中滴入10
mL
0.2
mol·L-1的NaOH溶液,再加水稀释至100
mL常温下的溶液,其中溶质的物质的量浓度是_____________________________________。
习题
1.实验室需用2
mol·L-1硫酸铜溶液450
mL,配制时应称取的固体质量是
( )
A.144.0
g CuSO4
B.144.0
g CuSO4·5H2O
C.225.0
g CuSO4·5H2O
D.250.0
g CuSO4·5H2O
2.用氢氧化钠固体配制0.10
mol·L-1的氢氧化钠溶液,下列说法中错误的是
( )
A.定容时仰视容量瓶刻度线,会造成所配溶液浓度偏小
B.移液时不慎有部分液体溅出,会造成所配溶液浓度偏小
C.称量时托盘上要垫上干净的称量纸
D.定容摇匀后发现液面下降,不应再加蒸馏水
3.在80
g密度为d
g·cm-3的硫酸铁溶液中,含有2.8
g
Fe3+,则此溶液中SO的物质的量浓度为(单位为mol·L-1)
( )
A.d
B.d
C.d
D.d
4.某同学将标准状况下44.8
L的HCl气体溶于水,配成500
mL的溶液。
(1)根据公式_
__,可知该HCl气体的物质的量为__
。
(2)根据公式__
,可知所配成的盐酸溶液的物质的量浓度为_
。
(3)100
mL盐酸中含HCl的物质的量为_
。
图2
图1
