四川省成都市龙泉中学2017-2018学年高中化学(人教版必修一)《物质的量浓度》(PPT课件共19张)
文档属性
| 名称 | 四川省成都市龙泉中学2017-2018学年高中化学(人教版必修一)《物质的量浓度》(PPT课件共19张) |

|
|
| 格式 | zip | ||
| 文件大小 | 297.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-10 00:00:00 | ||
图片预览






文档简介
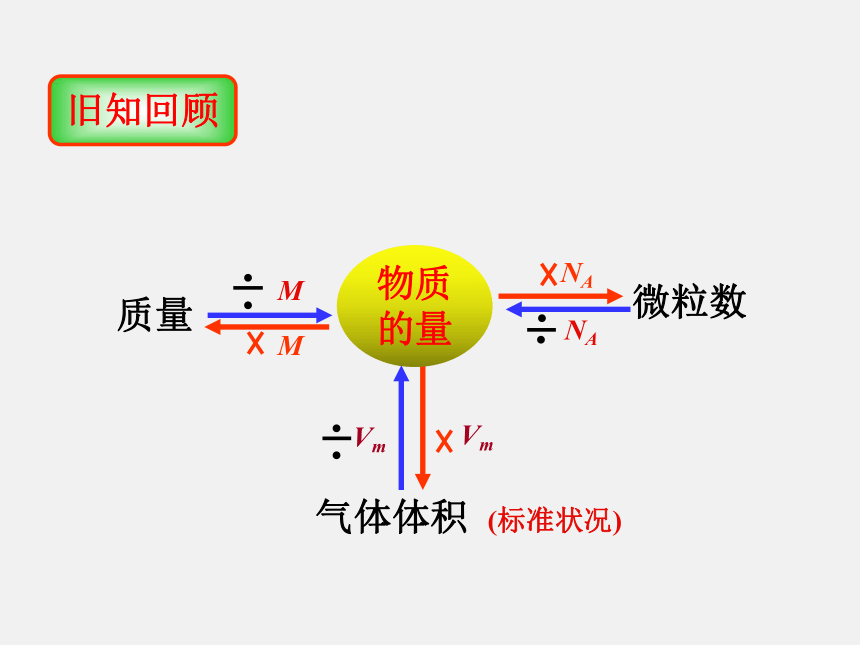
课件19张PPT。第三课时 物质的量浓度第二节化学计量在实验中的应用旧知回顾微粒数 NANAMM质量
气体体积 (标准状况)Vm物质的量2、标准状况下,11.2升氢气是 molH21、4克氢氧化钠相当于 molNaOH m = n?M0.10.5N=n?NA3、3.01×1023个H+相当于 mol H+0.5 但是,很多化学反应都在溶液中进行,对于溶液我们通常不称其质量,而是量它的体积。同时,在化学反应中,反应物与生成物之间的比例关系是由化学方程式中的化学计量数所决定的.例如:
2KOH + H2SO4 === K2SO4 + 2H2O
2mol :1mol : 1mol : 2mol
想一想
如果知道一定体积的溶液中溶质的物质的量,运算起来很方便.对于计算化学反应中各物质之间量的关系是非常便利的.因此,用质量分数并不方便,需引入新的物理量—物质的量浓度.一、物质的量浓度 以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。3、表达式:物质的量浓度=溶质的物质的量溶液的体积CB=摩尔/升( mol/L)4、单位:nBV2、符号:CB1、定义:5.特别注意:(1)体积是指溶液的体积,而不是溶剂的体积;
(2)溶质是用物质的量而不是用质量表示(3)在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变,但所含溶质的物质的量或质量因体积的不同而不同(4)溶质可以是单质、化合物,也可以是离子或其他特定组合。 如 c(MgCl2)=0.1mol/L
c(Clˉ) =0.2mol/L c(Mg 2+)=0.1mol/L二、有关物质的量浓度的计算1、1LNaOH溶液里含有O. 5molNaOH,则氢氧化钠溶液的物质的量浓度为( )2、2mol/L的NaCl溶液1000ml,含溶质NaCl的物质的
量为( )3、已知某硫酸钠溶液的物质的量浓度为1mol/L,该
溶液中含硫酸钠的物质的量为3moL,则该溶液的体
积为( ) 0.5mol/L2mol 3L课堂训练1、将1mol NaOH溶于2L水中配成溶液,其物质的量浓度是0.5mol/L?2、从100mL3mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度是多少?答:否,体积指的是溶液的体积,而不是溶剂的体积。答:3mol/L (在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变)1、将10克NaOH溶解在250ml水中,所得溶液中溶质的物质的量浓度是否为1mol/L?类型1:假设上述溶液的密度ρg/L答:否,体积指的是溶液的体积,而不是溶剂的体积。2、若要将上题的物质的量浓度算出来还需哪些条件?c (NaOH)=n (NaOH)V (NaOH)=10g40g/mol10g+250gρg/L思考交流例.某市售浓硫酸中的溶质的质量分数为98%,密度为1.84g/ml。计算该市售浓硫酸中H2SO4的物质的量浓度。结论: C=1000ρ ω/M思考: 若质量分数为ω,密度为ρg/ml,则其物质的量的浓度的公式可以表示为?类型2:变形公式计算结论: C=ρ ω/M (注: ρg/l) 18.4mol/L结论: C=ρ S/M(S+100) 若知道某物质的溶解度为S,溶液的密度为ρ(g/L)。则物质的量浓度C的计算公式为?类型3:变形公式计算稀释浓溶液时,溶液的质量或体积要发生变化,但溶质的量(质量或物质的量)均不变。c (浓溶液)·V (浓溶液)=c (稀溶液)·V (稀溶液)
C1·V1=C2·V2类型4:溶液稀释计算【例1】要配制500mL 0.6mol/L 的NaOH溶液,需
6 mol/L 的NaOH溶液多少毫升?解:设需6 mol/L NaOH 溶液的体积为V6 mol/L×V = 0.6mol/L ×500mL V = 50 mL 答:需6 mol/L的NaOH溶液50mL 。分析:稀释前后溶质的质量和物质的量不变,故有: C1V1 = C2V2 ( 体积单位不一定用升,相同则可)练习:要把12mol/L的盐酸10ml稀释成60ml的盐酸,则此时的盐酸的物质的量浓度是多少?2mol/L对应训练物质的量浓度与质量分数比较C=1000ρ ω/M×100%相同不同相同不同cB(溶液)×V(aq)÷V(aq)课堂小结课堂检测1.下列溶液中物质的量浓度为1 mol/L的是( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol/L浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL2.1 mol/L的FeCl3溶液与1 mol/L的KCl溶液中Cl-的物质的量浓度之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3DC3.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A.1∶2∶3 B.1∶6∶9
C.1∶3∶3 D.1∶3∶6
4.现需5 mol/L的盐酸200 mL,下列方法一定可以实现的是( )
A.将22.4 L HCl气体溶于水稀释至200 mL
B.将36.5 g HCl气体溶于200 mL水中
C.取10 mol/L的盐酸100 mL加水100 mL
D.取10 mol/L的盐酸100 mL加水稀释至200 mLBD
气体体积 (标准状况)Vm物质的量2、标准状况下,11.2升氢气是 molH21、4克氢氧化钠相当于 molNaOH m = n?M0.10.5N=n?NA3、3.01×1023个H+相当于 mol H+0.5 但是,很多化学反应都在溶液中进行,对于溶液我们通常不称其质量,而是量它的体积。同时,在化学反应中,反应物与生成物之间的比例关系是由化学方程式中的化学计量数所决定的.例如:
2KOH + H2SO4 === K2SO4 + 2H2O
2mol :1mol : 1mol : 2mol
想一想
如果知道一定体积的溶液中溶质的物质的量,运算起来很方便.对于计算化学反应中各物质之间量的关系是非常便利的.因此,用质量分数并不方便,需引入新的物理量—物质的量浓度.一、物质的量浓度 以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度。3、表达式:物质的量浓度=溶质的物质的量溶液的体积CB=摩尔/升( mol/L)4、单位:nBV2、符号:CB1、定义:5.特别注意:(1)体积是指溶液的体积,而不是溶剂的体积;
(2)溶质是用物质的量而不是用质量表示(3)在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变,但所含溶质的物质的量或质量因体积的不同而不同(4)溶质可以是单质、化合物,也可以是离子或其他特定组合。 如 c(MgCl2)=0.1mol/L
c(Clˉ) =0.2mol/L c(Mg 2+)=0.1mol/L二、有关物质的量浓度的计算1、1LNaOH溶液里含有O. 5molNaOH,则氢氧化钠溶液的物质的量浓度为( )2、2mol/L的NaCl溶液1000ml,含溶质NaCl的物质的
量为( )3、已知某硫酸钠溶液的物质的量浓度为1mol/L,该
溶液中含硫酸钠的物质的量为3moL,则该溶液的体
积为( ) 0.5mol/L2mol 3L课堂训练1、将1mol NaOH溶于2L水中配成溶液,其物质的量浓度是0.5mol/L?2、从100mL3mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度是多少?答:否,体积指的是溶液的体积,而不是溶剂的体积。答:3mol/L (在一定物质的量浓度溶液中取出任意体积的溶液,其物质的量浓度不变)1、将10克NaOH溶解在250ml水中,所得溶液中溶质的物质的量浓度是否为1mol/L?类型1:假设上述溶液的密度ρg/L答:否,体积指的是溶液的体积,而不是溶剂的体积。2、若要将上题的物质的量浓度算出来还需哪些条件?c (NaOH)=n (NaOH)V (NaOH)=10g40g/mol10g+250gρg/L思考交流例.某市售浓硫酸中的溶质的质量分数为98%,密度为1.84g/ml。计算该市售浓硫酸中H2SO4的物质的量浓度。结论: C=1000ρ ω/M思考: 若质量分数为ω,密度为ρg/ml,则其物质的量的浓度的公式可以表示为?类型2:变形公式计算结论: C=ρ ω/M (注: ρg/l) 18.4mol/L结论: C=ρ S/M(S+100) 若知道某物质的溶解度为S,溶液的密度为ρ(g/L)。则物质的量浓度C的计算公式为?类型3:变形公式计算稀释浓溶液时,溶液的质量或体积要发生变化,但溶质的量(质量或物质的量)均不变。c (浓溶液)·V (浓溶液)=c (稀溶液)·V (稀溶液)
C1·V1=C2·V2类型4:溶液稀释计算【例1】要配制500mL 0.6mol/L 的NaOH溶液,需
6 mol/L 的NaOH溶液多少毫升?解:设需6 mol/L NaOH 溶液的体积为V6 mol/L×V = 0.6mol/L ×500mL V = 50 mL 答:需6 mol/L的NaOH溶液50mL 。分析:稀释前后溶质的质量和物质的量不变,故有: C1V1 = C2V2 ( 体积单位不一定用升,相同则可)练习:要把12mol/L的盐酸10ml稀释成60ml的盐酸,则此时的盐酸的物质的量浓度是多少?2mol/L对应训练物质的量浓度与质量分数比较C=1000ρ ω/M×100%相同不同相同不同cB(溶液)×V(aq)÷V(aq)课堂小结课堂检测1.下列溶液中物质的量浓度为1 mol/L的是( )
A.将40 g NaOH溶解在1 L水中
B.将22.4 L HCl气体溶于水配成1 L溶液
C.将1 L 10 mol/L浓盐酸加入9 L水中
D.将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL2.1 mol/L的FeCl3溶液与1 mol/L的KCl溶液中Cl-的物质的量浓度之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3DC3.等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1∶2∶3,则三种硫酸盐的物质的量浓度之比为( )
A.1∶2∶3 B.1∶6∶9
C.1∶3∶3 D.1∶3∶6
4.现需5 mol/L的盐酸200 mL,下列方法一定可以实现的是( )
A.将22.4 L HCl气体溶于水稀释至200 mL
B.将36.5 g HCl气体溶于200 mL水中
C.取10 mol/L的盐酸100 mL加水100 mL
D.取10 mol/L的盐酸100 mL加水稀释至200 mLBD
