人教版化学必修二2.1 化学能与热能 课件
文档属性
| 名称 | 人教版化学必修二2.1 化学能与热能 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 973.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-15 00:00:00 | ||
图片预览







文档简介
课件25张PPT。一飞冲天:“神舟”号发射实况回放
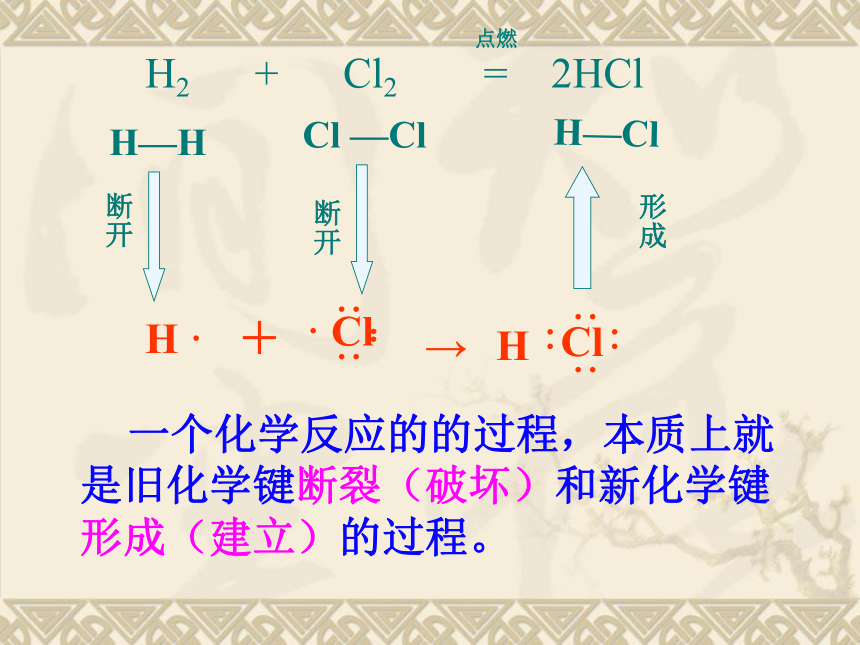
1967年6月17日1964年10月16日新课标人教版化学必修Ⅱ 2018年10月16日星期二第二章 第一节 化学能与热能第一节 化学能与热能一、化学键与化学反应中能量变化的关系1、化学反应的本质是?
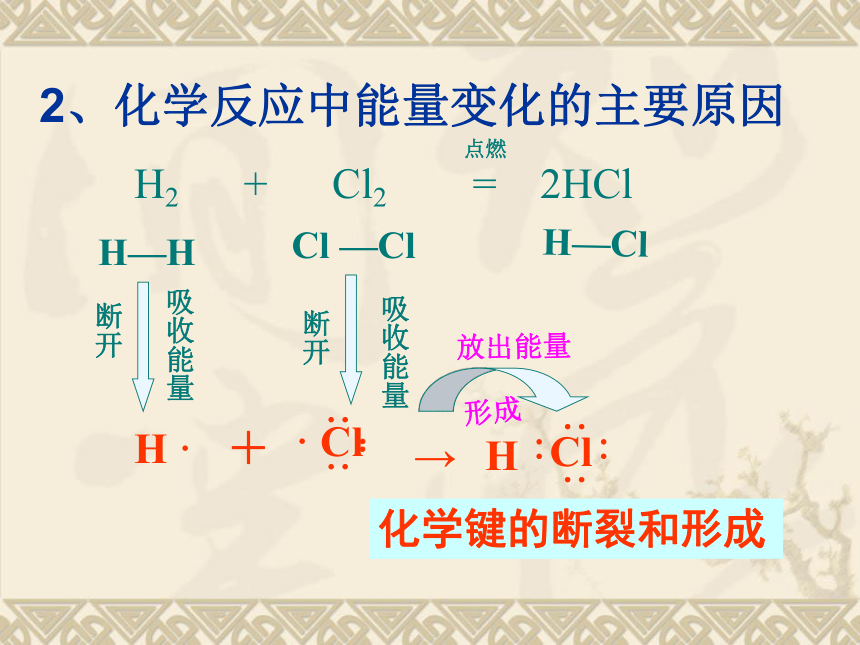
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。H2 + Cl2 = 2HClH—H Cl —ClH—Cl断开断开点燃 一个化学反应的的过程,本质上就是旧化学键断裂(破坏)和新化学键形成(建立)的过程。形成2、化学反应中能量变化的主要原因H2 + Cl2 = 2HClH—H Cl —ClH—Cl吸收能量断开断开吸收能量形成放出能量点燃化学键的断裂和形成3. 从化学键的观点来分析能量的变化所以:一个化学反应是否为放热还是吸热取决于什么呢?取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小 在反应H2 + Cl2 =2HCl中,已知H-H
键能为436kJ,Cl-Cl键能为247kJ,
H-Cl键能为431kJ,判断该反应是
反应
课堂练习反应物的能量之和
E反生成物的能量之和
E生(1)若E反> E生,(2)若E反< E生,放出能量。吸收能量。小结:能量公式化E(反应物)=E(生成物)+Q(能量守恒定律)E(反应物)-E(生成物)=QQ > 0为放热反应Q < 0为吸热反应判断:
(1)加热的反应一定是吸热反应
(2)一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物
的总能量的相对大小有关。
(3)化学反应中的能量变化都表现为
热能变化.1、当物质发生化学反应时,断开反应物中
的化学键要 ;而形成生成物中
的化学键要 。一个化学反应是
释放能量还是吸收能量取决于
。吸收能量放出能量反应物总能量与生成物总能量的相对大小 课堂练习:2、若反应物的总能量>生成物的总能量,
化学反应 能量。
若反应物的总能量<生成物的总能量,
化学反应 能量。放出吸收二、化学能与热能的相互转化 a. 化学反应的能量变化
主要表现为热量的变化吸热放热[实验探究2—1] 镁条与盐酸的反应 一、说明化学反应存在 变化;
二、铝片与盐酸的反应是 反应。
在一支试管中加入2-3mL6mol/L的盐酸,再插入用砂纸打磨光的镁条,观察现象,并用试探溶液温度的变化.得出结论:能量放热Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O[实验2—2探究] :Ba(OH)2·8H2O与NH4Cl的反应现象与结论:化学方程式: 1、玻璃片(小木板)与小烧杯粘结在一起
2、有少许刺激性气味气体产生
3、有水生成实验2-3反应后温度升高室温室温H+ + OH- = H2O(中和反应本质)可推测:中和反应都放热二、化学能与热能的相互转化放热反应:金属和酸反应、氧化还原反应、
酸碱中和反应、大多数化合反应等。
浓硫酸稀释、氢氧化钠固体溶解等吸热反应:大多数分解反应,焦炭和CO2生成CO、
铵盐溶解等b. 总结二、化学能与热能的相互转化 c. 中和热:酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热思考与交流:
在设计实验装置和操作时应该注意哪些问题?(1)用隔热装置,尽量减少热量散失;(2)酸碱的量要准确:n=C×Va、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管(3)温度计越精确越好(4)注意控制反应时间(5)多做几次,取平均值随堂练习 1. 下列说法正确的是 ( )
A. 大多数的化合反应是释放能量的反应
B. 大多数分解反应是吸收能量的反应
C. 释放能量的反应都不需要加热
D. 吸收能量的反应都需要加热AB2. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
C练习:1、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应
结果是放热还是吸热
D.吸热反应在一定条件下才能发生反应CD
1967年6月17日1964年10月16日新课标人教版化学必修Ⅱ 2018年10月16日星期二第二章 第一节 化学能与热能第一节 化学能与热能一、化学键与化学反应中能量变化的关系1、化学反应的本质是?
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。H2 + Cl2 = 2HClH—H Cl —ClH—Cl断开断开点燃 一个化学反应的的过程,本质上就是旧化学键断裂(破坏)和新化学键形成(建立)的过程。形成2、化学反应中能量变化的主要原因H2 + Cl2 = 2HClH—H Cl —ClH—Cl吸收能量断开断开吸收能量形成放出能量点燃化学键的断裂和形成3. 从化学键的观点来分析能量的变化所以:一个化学反应是否为放热还是吸热取决于什么呢?取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小 在反应H2 + Cl2 =2HCl中,已知H-H
键能为436kJ,Cl-Cl键能为247kJ,
H-Cl键能为431kJ,判断该反应是
反应
课堂练习反应物的能量之和
E反生成物的能量之和
E生(1)若E反> E生,(2)若E反< E生,放出能量。吸收能量。小结:能量公式化E(反应物)=E(生成物)+Q(能量守恒定律)E(反应物)-E(生成物)=QQ > 0为放热反应Q < 0为吸热反应判断:
(1)加热的反应一定是吸热反应
(2)一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物
的总能量的相对大小有关。
(3)化学反应中的能量变化都表现为
热能变化.1、当物质发生化学反应时,断开反应物中
的化学键要 ;而形成生成物中
的化学键要 。一个化学反应是
释放能量还是吸收能量取决于
。吸收能量放出能量反应物总能量与生成物总能量的相对大小 课堂练习:2、若反应物的总能量>生成物的总能量,
化学反应 能量。
若反应物的总能量<生成物的总能量,
化学反应 能量。放出吸收二、化学能与热能的相互转化 a. 化学反应的能量变化
主要表现为热量的变化吸热放热[实验探究2—1] 镁条与盐酸的反应 一、说明化学反应存在 变化;
二、铝片与盐酸的反应是 反应。
在一支试管中加入2-3mL6mol/L的盐酸,再插入用砂纸打磨光的镁条,观察现象,并用试探溶液温度的变化.得出结论:能量放热Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3↑+10H2O[实验2—2探究] :Ba(OH)2·8H2O与NH4Cl的反应现象与结论:化学方程式: 1、玻璃片(小木板)与小烧杯粘结在一起
2、有少许刺激性气味气体产生
3、有水生成实验2-3反应后温度升高室温室温H+ + OH- = H2O(中和反应本质)可推测:中和反应都放热二、化学能与热能的相互转化放热反应:金属和酸反应、氧化还原反应、
酸碱中和反应、大多数化合反应等。
浓硫酸稀释、氢氧化钠固体溶解等吸热反应:大多数分解反应,焦炭和CO2生成CO、
铵盐溶解等b. 总结二、化学能与热能的相互转化 c. 中和热:酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热思考与交流:
在设计实验装置和操作时应该注意哪些问题?(1)用隔热装置,尽量减少热量散失;(2)酸碱的量要准确:n=C×Va、浓度要越精确越好
b、量体积的容器越精确越好,最好用移液管(3)温度计越精确越好(4)注意控制反应时间(5)多做几次,取平均值随堂练习 1. 下列说法正确的是 ( )
A. 大多数的化合反应是释放能量的反应
B. 大多数分解反应是吸收能量的反应
C. 释放能量的反应都不需要加热
D. 吸收能量的反应都需要加热AB2. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应
C练习:1、下列说法正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了反应
结果是放热还是吸热
D.吸热反应在一定条件下才能发生反应CD
