2017-2018学年鲁科版必修1 第3章第4节 海水中的元素 课件(37张)
文档属性
| 名称 | 2017-2018学年鲁科版必修1 第3章第4节 海水中的元素 课件(37张) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-20 21:28:52 | ||
图片预览









文档简介
课件37张PPT。第4节 海水中的元素 尝过海水的人都知道,海水又苦又咸,不能直接饮用。看来,海水中除了含有氢、氧元素外,一定还含有其他元素。那么,海水中还含有哪些元素?它们在海水中是以什么形式存在的?它们在海水中的含量如何?人类是怎样提取并利用它们的呢?2.了解海水提镁的流程和发生的主要反应,认识镁
单质的性质。(重点)
3.了解溴、碘及其化合物的性质和主要用途。(重点)
4.以海水提溴为例,了解化学方法在实现物质间转
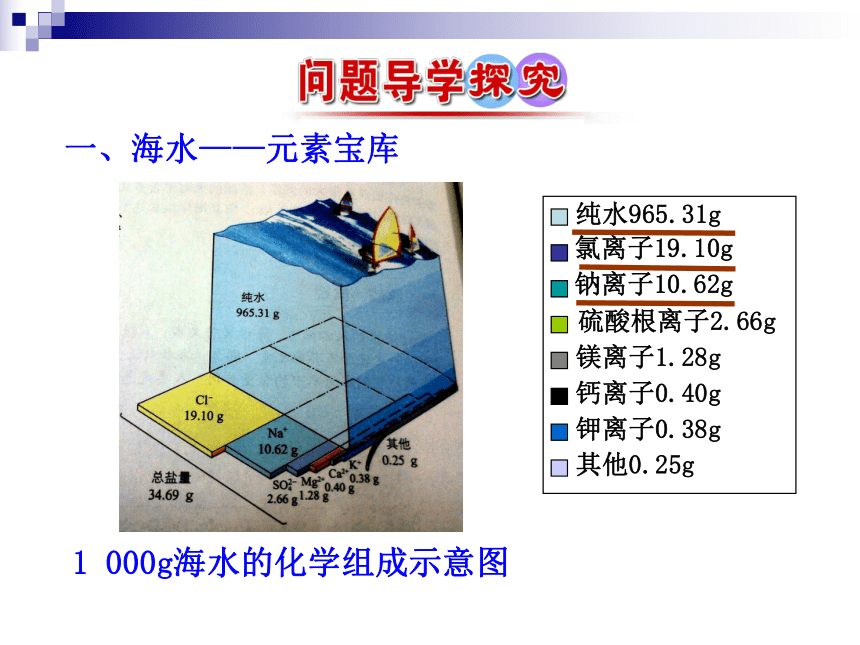
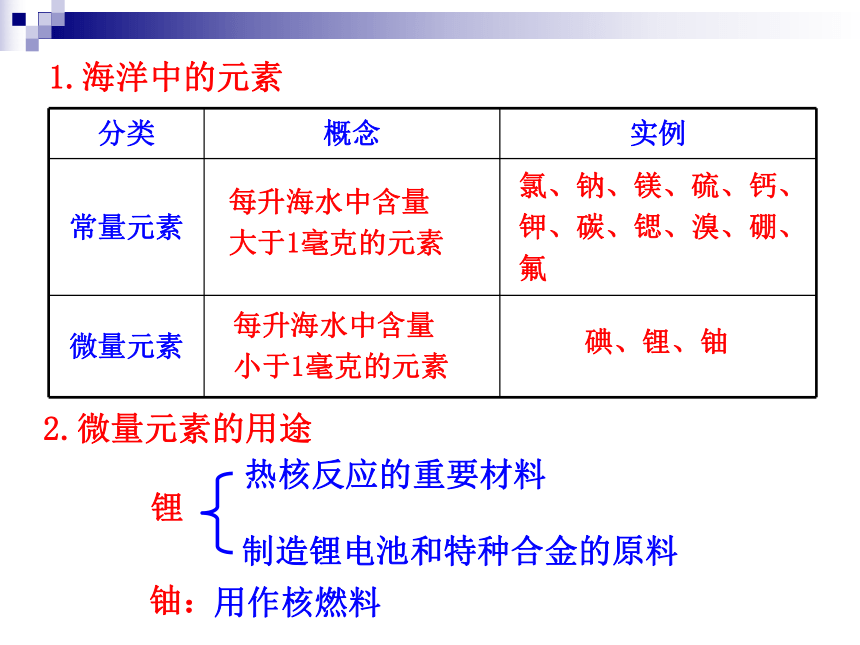
化中的作用。1.了解海水中元素的存在形式和用途,认识海水综合开发利用的意义。1 000g海水的化学组成示意图一、海水——元素宝库有关海水组成的惊人数字80多种11种2.5×1010t5×1016t2.6×1016t2.5×1011t9.3×1010t4.5×109t2×1015t1.海洋中的元素每升海水中含量
大于1毫克的元素氯、钠、镁、硫、钙、钾、碳、锶、溴、硼、氟每升海水中含量
小于1毫克的元素碘、锂、铀2.微量元素的用途锂铀:热核反应的重要材料制造锂电池和特种合金的原料用作核燃料 碘元素——被称为“聪明的元素”
与人体内一种激素(甲状腺素)的合成有关,甲状腺素对人体的智力发育有影响:儿童缺乏得呆小症,成年人缺乏得大脖子病。我国政府规定:
在食盐中必须加入
一定量的_______。
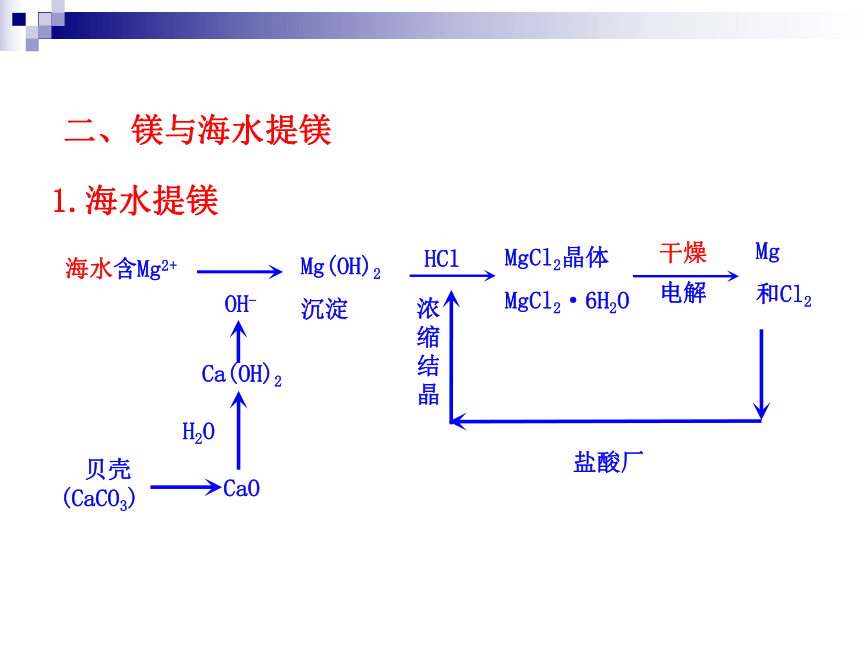
(化学式______ )。碘酸钾 KIO3氯碱工业简介原理:原料:饱和食盐水产品和用途:氯化物合成金属冶炼有机合成盐酸HCl农药电解饱和食盐水碱液湿氯气湿氢气NaOH含氯漂白剂Cl2H2有机合成造纸玻璃肥皂纺织印染有机合成Mg(OH)2沉淀MgCl2晶体
MgCl2·6H2OMg
和Cl2海水含Mg2+盐酸厂1.海水提镁二、镁与海水提镁【提示】贝壳起到提供碱——消石灰的作用。主要成分发生的化学变化有:CaO+H2O ==== Ca(OH)2(1)海水提镁要用到海滩上的贝壳。那么,贝壳在生产流程中起什么作用?其主要成分发生了怎样的化学变化?【思考与交流】 【提示】经历的化学变化有:
Mg2++2OH- ==== Mg(OH)2↓
Mg(OH)2+2HCl ==== MgCl2+2H2OMgCl2 (熔融)==== Mg+Cl2↑通电(2)从海水中的镁离子到金属镁,经历了哪些化学
变化?(3)在用上述方法提镁的过程中,采取了哪些措施
来提高经济效益?这对你有什么启示?【提示】就地取材——利用海滩上的贝壳;
节约原料——循环利用氯元素(1)物理性质银白色、密度比较小,有金属光泽、质软。具有很好的延展性、导电性、导热性。
其合金的强度高、机械性能好,被称为“国防金属”。2.镁用途:可用于制造汽车、飞机、火箭。②与非金属单质反应①与非氧化性酸反应生成氢气(2)化学性质 Mg+2H+ ==== Mg2+ + H2↑③与二氧化碳反应现象:镁条在CO2中继续燃烧,发出耀眼白光,在瓶内壁附着有黑色的固体。由镁引起的火灾能否用泡沫灭火器灭火?【提示】不能【想一想】④与盐反应——置换反应Mg+Cu2+ ==== Mg2+ + Cu地球上99%的溴元素以Br-的形式存在于海水中。
溴元素又被称为“海洋元素”三、溴与海水提溴F2Cl2Br2I2颜色状态溶解性溶液颜色水酒精CCl4浅黄绿色橙(黄)色橙红色橙红色黄色紫红色褐色不易溶于水,易溶于有机溶剂浅黄绿色黄绿色深红棕色紫黑色气态气态液态固态1.物理性质【接下页表格】易挥发易升华;
遇淀粉溶液变蓝用棕色瓶密封保
存加入少量水密封保存
于广口瓶中水封碘的特性——升华溴在水中溶解度不大,如何来提取溴呢?【提示】利用萃取的方法【想一想】利用某种物质(溶质)在互不相溶的溶剂里溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。萃取已知溴在酒精中的溶解度大于溴在水中的溶解度,加入酒精能否实现溴和水的分离?【提示】不能。酒精与水互溶【学与用】①与金属反应2Fe+3Br2 ==== 2FeBr32.化学性质(X表示Cl、Br、I)低价态金
属碘化物②与非金属反应(如:H2)③与水反应④与碱反应X2+H2O ==== HX+HXOX2+2NaOH ==== NaX+NaXO+H2O氯、溴、碘单质的氧化性强弱氧化性: Cl2>Br22NaBr+Cl2====2NaCl+Br2还原性:Br- > Cl-氯溴单质氧化性强弱比较:溴碘单质氧化性强弱比较:2KI+Br2 ==== 2KBr+I2氧化性: Br2>I2还原性: I- > Br-氯碘单质氧化性强弱比较:2KI+Cl2====2KCl+I2氧化性: Cl2>I2还原性: I- > Cl-3.Cl-、Br-、I-的检验如何鉴别NaCl、NaBr、KI三瓶无色溶液?【提示】方法一:分别滴加AgNO3溶液和稀硝酸,产生白色沉淀的为NaCl溶液,产生淡黄色沉淀的为NaBr溶液,产生黄色沉淀的为KI溶液。
方法二:分别滴加氯水,再加入少量四氯化碳,振荡,下层无色的为NaCl溶液,下层为橙红色的为NaBr溶液,下层为紫红色的为KI溶液。【想一想】溴2Br-+Cl2====Br2+2Cl-4.海水提溴(浓缩、氧化、提取)利用Br2的易
挥发的性质5.海水的综合利用镁氯化钾、硫
酸钠等溴及其化合物氯化镁苦卤食盐碘锂、金等铀1.镁的化学性质与酸反应置换氢气
与氧气反应
与二氧化碳反应
与氮气反应Mg+2HCl=MgCl2+H2↑2.氯、溴、碘单质氧化性强弱比较:氧化性:Cl2>Br2>I2还原性:I->Br->Cl-3.海水提溴的原理:Cl2+2Br- ==== 2Cl-+Br2海水提溴的过程:4.海水的综合利用1.下列海水中的元素中,对其用途的叙述不正确的
是( )
A.锂是热核反应的重要原料之一
B.碘可用于制药,如制碘酒,食盐加碘可预防甲状腺肿大
C.镁可用于制造飞机、汽车、火箭,有“国防金属”的美誉
D.铀是制造原子弹和氢弹的主要原料D2.镁粉在焰火、闪光粉中是不可少的原料,工业制
造镁粉是将镁蒸气在气体中冷却,下列 ①空气
②CO2 ③Ar ④H2 ⑤N2可作为冷却气体的是( )
A.①② B.②③
C.③④ D.④⑤C 空气、CO2、N2都能与镁发生反应! 3.从化学原理和经济利益角度分析下列从海水中提取镁单质的方法最可行的是( )
A.海水 Mg(OH)2 Mg
B.海水 MgCl2 Mg
C.海水 Mg(OH)2 Mg
D.海水 Mg(OH)2 MgCl2 Mg DD4. 将少量氯水加入KI溶液中振荡,再加CCl4,振荡,静置后观察到的现象是( )
A.形成均匀的蓝色溶液
B.有紫色沉淀析出
C.液体分层,上层呈紫红色
D.液体分层,下层呈紫红色
单质的性质。(重点)
3.了解溴、碘及其化合物的性质和主要用途。(重点)
4.以海水提溴为例,了解化学方法在实现物质间转
化中的作用。1.了解海水中元素的存在形式和用途,认识海水综合开发利用的意义。1 000g海水的化学组成示意图一、海水——元素宝库有关海水组成的惊人数字80多种11种2.5×1010t5×1016t2.6×1016t2.5×1011t9.3×1010t4.5×109t2×1015t1.海洋中的元素每升海水中含量
大于1毫克的元素氯、钠、镁、硫、钙、钾、碳、锶、溴、硼、氟每升海水中含量
小于1毫克的元素碘、锂、铀2.微量元素的用途锂铀:热核反应的重要材料制造锂电池和特种合金的原料用作核燃料 碘元素——被称为“聪明的元素”
与人体内一种激素(甲状腺素)的合成有关,甲状腺素对人体的智力发育有影响:儿童缺乏得呆小症,成年人缺乏得大脖子病。我国政府规定:
在食盐中必须加入
一定量的_______。
(化学式______ )。碘酸钾 KIO3氯碱工业简介原理:原料:饱和食盐水产品和用途:氯化物合成金属冶炼有机合成盐酸HCl农药电解饱和食盐水碱液湿氯气湿氢气NaOH含氯漂白剂Cl2H2有机合成造纸玻璃肥皂纺织印染有机合成Mg(OH)2沉淀MgCl2晶体
MgCl2·6H2OMg
和Cl2海水含Mg2+盐酸厂1.海水提镁二、镁与海水提镁【提示】贝壳起到提供碱——消石灰的作用。主要成分发生的化学变化有:CaO+H2O ==== Ca(OH)2(1)海水提镁要用到海滩上的贝壳。那么,贝壳在生产流程中起什么作用?其主要成分发生了怎样的化学变化?【思考与交流】 【提示】经历的化学变化有:
Mg2++2OH- ==== Mg(OH)2↓
Mg(OH)2+2HCl ==== MgCl2+2H2OMgCl2 (熔融)==== Mg+Cl2↑通电(2)从海水中的镁离子到金属镁,经历了哪些化学
变化?(3)在用上述方法提镁的过程中,采取了哪些措施
来提高经济效益?这对你有什么启示?【提示】就地取材——利用海滩上的贝壳;
节约原料——循环利用氯元素(1)物理性质银白色、密度比较小,有金属光泽、质软。具有很好的延展性、导电性、导热性。
其合金的强度高、机械性能好,被称为“国防金属”。2.镁用途:可用于制造汽车、飞机、火箭。②与非金属单质反应①与非氧化性酸反应生成氢气(2)化学性质 Mg+2H+ ==== Mg2+ + H2↑③与二氧化碳反应现象:镁条在CO2中继续燃烧,发出耀眼白光,在瓶内壁附着有黑色的固体。由镁引起的火灾能否用泡沫灭火器灭火?【提示】不能【想一想】④与盐反应——置换反应Mg+Cu2+ ==== Mg2+ + Cu地球上99%的溴元素以Br-的形式存在于海水中。
溴元素又被称为“海洋元素”三、溴与海水提溴F2Cl2Br2I2颜色状态溶解性溶液颜色水酒精CCl4浅黄绿色橙(黄)色橙红色橙红色黄色紫红色褐色不易溶于水,易溶于有机溶剂浅黄绿色黄绿色深红棕色紫黑色气态气态液态固态1.物理性质【接下页表格】易挥发易升华;
遇淀粉溶液变蓝用棕色瓶密封保
存加入少量水密封保存
于广口瓶中水封碘的特性——升华溴在水中溶解度不大,如何来提取溴呢?【提示】利用萃取的方法【想一想】利用某种物质(溶质)在互不相溶的溶剂里溶解度的不同,用一种溶剂把它从溶解度较小的溶剂转移到溶解度较大的溶剂中的方法。萃取已知溴在酒精中的溶解度大于溴在水中的溶解度,加入酒精能否实现溴和水的分离?【提示】不能。酒精与水互溶【学与用】①与金属反应2Fe+3Br2 ==== 2FeBr32.化学性质(X表示Cl、Br、I)低价态金
属碘化物②与非金属反应(如:H2)③与水反应④与碱反应X2+H2O ==== HX+HXOX2+2NaOH ==== NaX+NaXO+H2O氯、溴、碘单质的氧化性强弱氧化性: Cl2>Br22NaBr+Cl2====2NaCl+Br2还原性:Br- > Cl-氯溴单质氧化性强弱比较:溴碘单质氧化性强弱比较:2KI+Br2 ==== 2KBr+I2氧化性: Br2>I2还原性: I- > Br-氯碘单质氧化性强弱比较:2KI+Cl2====2KCl+I2氧化性: Cl2>I2还原性: I- > Cl-3.Cl-、Br-、I-的检验如何鉴别NaCl、NaBr、KI三瓶无色溶液?【提示】方法一:分别滴加AgNO3溶液和稀硝酸,产生白色沉淀的为NaCl溶液,产生淡黄色沉淀的为NaBr溶液,产生黄色沉淀的为KI溶液。
方法二:分别滴加氯水,再加入少量四氯化碳,振荡,下层无色的为NaCl溶液,下层为橙红色的为NaBr溶液,下层为紫红色的为KI溶液。【想一想】溴2Br-+Cl2====Br2+2Cl-4.海水提溴(浓缩、氧化、提取)利用Br2的易
挥发的性质5.海水的综合利用镁氯化钾、硫
酸钠等溴及其化合物氯化镁苦卤食盐碘锂、金等铀1.镁的化学性质与酸反应置换氢气
与氧气反应
与二氧化碳反应
与氮气反应Mg+2HCl=MgCl2+H2↑2.氯、溴、碘单质氧化性强弱比较:氧化性:Cl2>Br2>I2还原性:I->Br->Cl-3.海水提溴的原理:Cl2+2Br- ==== 2Cl-+Br2海水提溴的过程:4.海水的综合利用1.下列海水中的元素中,对其用途的叙述不正确的
是( )
A.锂是热核反应的重要原料之一
B.碘可用于制药,如制碘酒,食盐加碘可预防甲状腺肿大
C.镁可用于制造飞机、汽车、火箭,有“国防金属”的美誉
D.铀是制造原子弹和氢弹的主要原料D2.镁粉在焰火、闪光粉中是不可少的原料,工业制
造镁粉是将镁蒸气在气体中冷却,下列 ①空气
②CO2 ③Ar ④H2 ⑤N2可作为冷却气体的是( )
A.①② B.②③
C.③④ D.④⑤C 空气、CO2、N2都能与镁发生反应! 3.从化学原理和经济利益角度分析下列从海水中提取镁单质的方法最可行的是( )
A.海水 Mg(OH)2 Mg
B.海水 MgCl2 Mg
C.海水 Mg(OH)2 Mg
D.海水 Mg(OH)2 MgCl2 Mg DD4. 将少量氯水加入KI溶液中振荡,再加CCl4,振荡,静置后观察到的现象是( )
A.形成均匀的蓝色溶液
B.有紫色沉淀析出
C.液体分层,上层呈紫红色
D.液体分层,下层呈紫红色
