2017-2018学年鲁科版必修1 第3章第1节 碳的多样性 课件(37张)
文档属性
| 名称 | 2017-2018学年鲁科版必修1 第3章第1节 碳的多样性 课件(37张) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-20 21:31:39 | ||
图片预览






文档简介
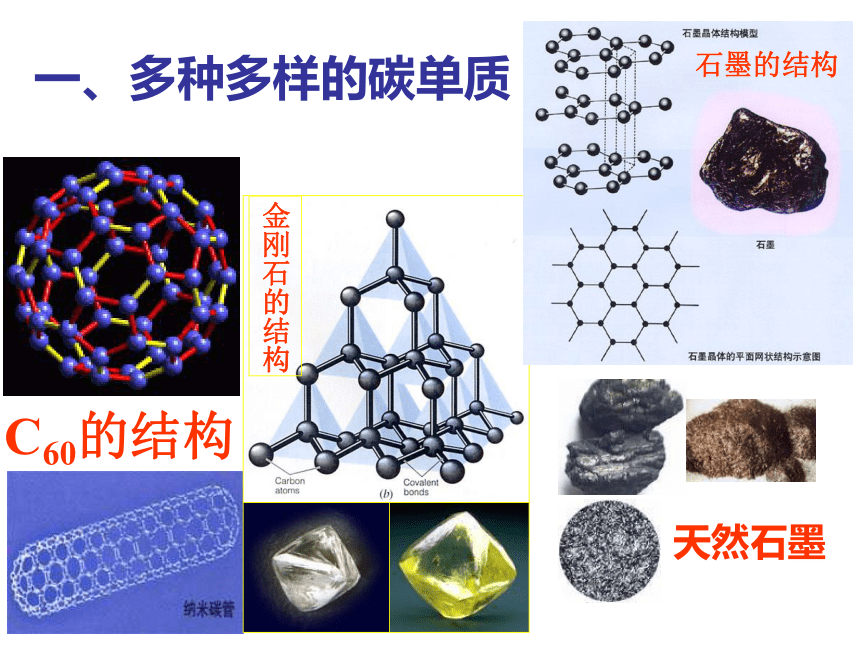
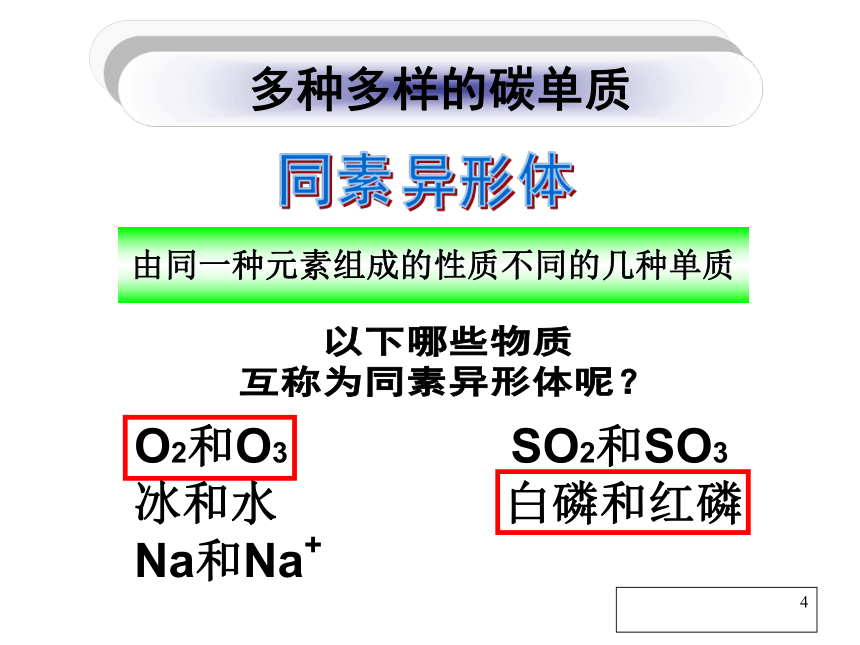
课件37张PPT。普通高中课程标准实验教科书 化学1(必修)第三章第一节 碳的多样性 一、多种多样的碳单质由同一种元素组成的性质不同的几种单质以下哪些物质
互称为同素异形体呢?O2和O3 SO2和SO3
冰和水 白磷和红磷
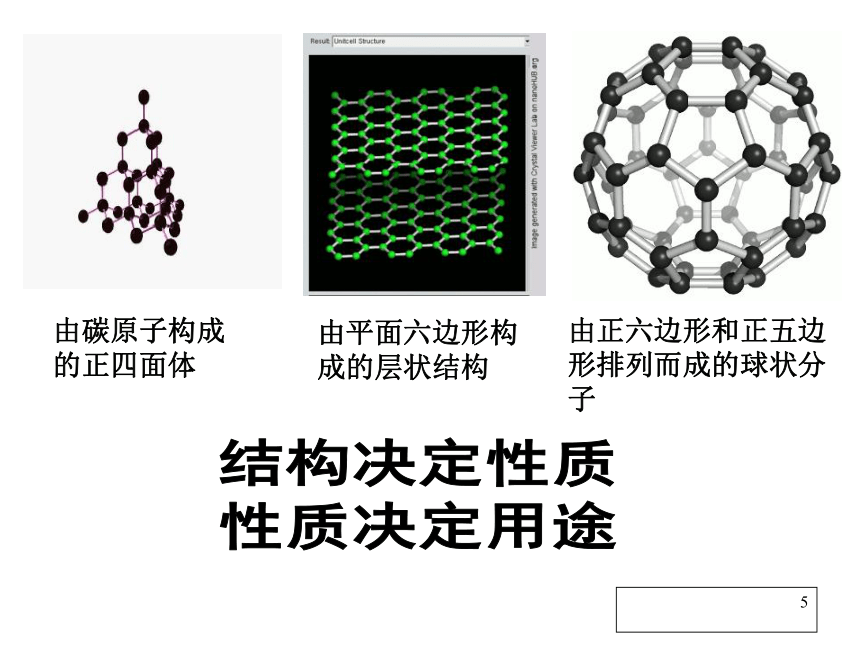
Na和Na+ 多种多样的碳单质1结构决定性质
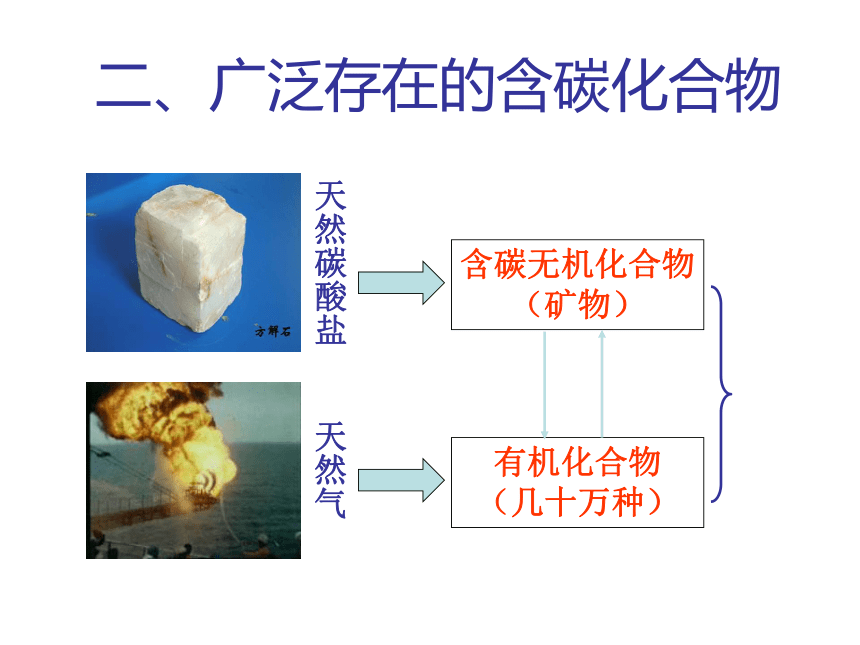
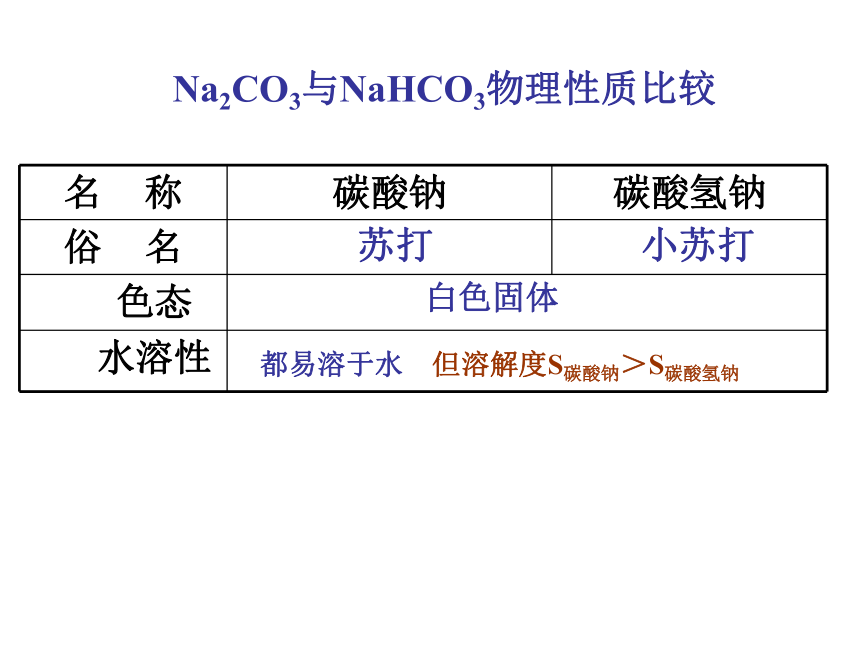
性质决定用途由碳原子构成的正四面体由平面六边形构成的层状结构由正六边形和正五边形排列而成的球状分子1二、广泛存在的含碳化合物含碳化合物1碳酸钠(纯碱、苏打)
白色固体粉末
碳酸氢钠(小苏打)
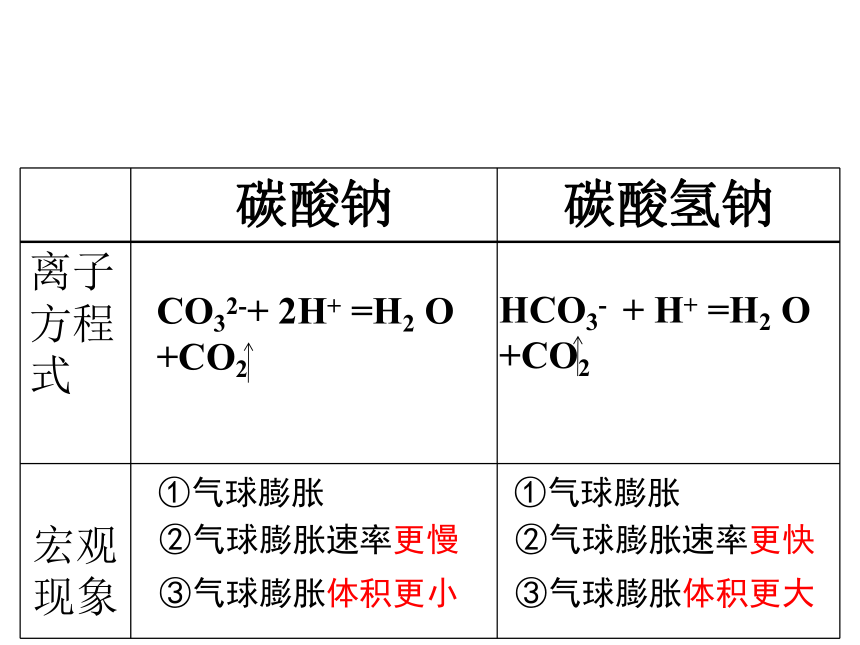
白色晶体Na2CO3与NaHCO3物理性质比较白色固体苏打小苏打都易溶于水 但溶解度S碳酸钠>S碳酸氢钠2、碳酸钠和碳酸氢钠化学性质将气球中粉末同时倒入锥形瓶中,观察现象。①气球膨胀②气球膨胀速率更慢③气球膨胀体积更小①气球膨胀②气球膨胀速率更快③气球膨胀体积更大CO32-+ 2H+ =H2 O +CO2 HCO3- + H+ =H2 O +CO2 2、碳酸钠和碳酸氢钠化学性质2.2 与酸反应Na2CO3与NaHCO3的化学性质比较产生气泡CO32-+2H+= CO2↑ + H2O
HCO3-+H+= CO2↑ +H2O无明显现象Na2CO3不反应
HCO3-+OH-= CO32- +H2O产生白色沉淀CO32-+Ca2+= Ca CO3↓
Ca2+ +HCO3-+OH- =
Ca CO3 ↓ +H2ONa2CO3产生白色沉淀
NaHCO3无现象CO32-+Ca2+= Ca CO3↓
NaHCO3不反应Na2CO3无现象
NaHCO3分解产生CO2碳酸氢钠受热分解实验装置:Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
_____________________________
⒉ NaHCO3转变成Na2CO3
①______________________________
②_______________________________Na2CO3NaHCO3CO2归纳BaCO3足量的HClHClNaOH或加热BaCl2Ba(OH)2少量的HCl1〖讨 论〗1、如何鉴别Na2CO3与NaHCO3 ?
2、如何除去Na2CO3中少量的NaHCO3?
3、如何除去NaHCO3中少量的Na2CO3?
加CaCl2溶液;加热加适量NaOH溶液;加热通入中量CO2如何鉴别NaHCO3和KHCO3? 鉴别物质,可以从它们的不同部分来思考,根据不同部分具有不同的性质这一点来进行鉴别。
那么 Na+ 和 K+ 有何不同呢?焰色反应 许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,在化学上叫焰色反应。 焰
色钠 黄色钾 紫色(透过蓝色钴玻璃)铜 绿色钙 砖红色焰 色 反 应操
作⑴ 点燃酒精灯(最好用煤气灯,火焰颜
色较浅)⑵ 铂丝在酒精灯上灼烧至没有颜色⑶ 铂丝蘸取固体或溶液灼烧,观察。 若是钾元素,应透过蓝色钴玻璃,滤去遮盖紫色的黄光。⑷ 铂丝用稀盐酸洗净,在火焰上灼烧至
没有颜色1.每次试验完后,为什么都要用盐酸洗净铂
丝,并灼烧至无色?2.除金属的化合物之外,单质能不能有同样
的现象呢? 因为金属氯化物灼烧时易气化而挥发,
灼烧至无色后能除去能起焰色反应的少量
杂质。 能,因为焰色反应是金属元素的性质,无论化合物还是单质,只要含有某种金属
元素,这种物质就具有这种金属元素的焰
色反应。3.焰色反应的主要作用是什么?4.焰色反应是物质的物理性质还是化学性质? 由于一般钠盐、钾盐易溶于水,在溶液中
又无颜色,无法通过其他反应进行检验“Na+”、
“K+ ”,所以常常用焰色反应来检验物理性质,属元素性质,与价态无关关于Na2CO3与NaHCO3混合物中各成份质量分数的计算。
〖例题〗将某碳酸钠和碳酸氢钠的混合物 2.74g 加热到质量不再变化时,剩余物质量为 2.12g 。求:
⑴混合物中碳酸氢钠与碳酸钠的物质的量;
⑵将这种混合物与足量的稀盐酸反应可以
生成标准状况下的气体体积。解:用差量法计算:
2NaHCO3==Na2CO3+CO2↑+H2O 固体质量减少
2mol 62.0g
n (NaHCO3) 0.620g
n (NaHCO3)=0.02mol
n (Na2CO3) =(2.74g-0.02mol×84g/mol)/106g·mol-1
=0.01mol
CO32-+2H+= CO2↑ + H2O HCO3-+H+= CO2↑ +H2O
∴ n (CO2)=n (NaHCO3) + n (Na2CO3)=0.03mol
V (CO2)= 0.03mol ×22.4L ·mol-1=0.672L三、自然界中碳及其化合物间的转化大气中的二氧化碳【活动·探究】模拟“溶洞的形成”实验方案及实验记录:开始出现白色沉淀
CO2过量时沉淀溶解出现白色沉淀Ca2+ + 2OH- + CO2 =
Ca CO3↓+ H2O
Ca CO3 +CO2+ H2O =
Ca2+ + 2 H CO3-四、生产和生活中碳及其化合物间的转化1、工业炼铁
2、木炭燃烧概括·整合练习--- 碳及其重要化合物知识回顾考 点整 合足球烯分子 1.碳单质。
(1)碳单质的存在形式主要有:金刚石、石墨、足球烯分子(如C60、C9、C120等),其中能溶于有机溶剂的是________、在死火山口存在较多的是________、能作电极材料的是________。
(2)碳单质主要化学性质:碳有较强的还原性,主要有如下反应:金刚石石墨Si+2CO↑考 点整 合2Cu+CO2↑2CO2SO2↑+2H2O+CO2↑4NO2↑+CO2↑+2H2O考 点整 合2.CO2与CO的比较。石灰水石灰水还原考 点整 合3.碳酸盐。
(1)常见碳酸盐俗称与主要化学成分:石灰石、蛋壳、贝壳、钟乳石________;纯碱、苏打________;小苏打________;碳铵(氮肥)________;硬水的主要成分______和__________;锅垢的主要成分________和______。
(2)碳酸氢钠与碳酸钠性质比较。
①有碳酸盐的通性,两者均与盐酸等反应生成二氧化碳,在反应时耗酸量及生成气体反应速率______。CaCO3Na2CO3NaHCO3NH4HCO3Ca(HCO3)2Mg(HCO3)2CaCO3Mg(OH)2不同考 点整 合②两种盐均能与石灰水或氢氧化钡溶液生成________沉淀。
③碳酸氢钠能跟氢氧化钠等碱反应,碳酸钠________与碱反应。
④碳酸钠跟氯化钙或氯化钡溶液反应生成碳酸盐________沉淀,碳酸氢钠跟氯化钙或氯化钡溶液________反应。
(3)碳酸及其盐稳定性规律:酸<酸式盐<正盐;如:H2CO3(4)碳酸盐溶解度规律:一般条件下,酸式盐>正盐,如Ca(HCO3)2>CaCO3;特例NaHCO3A.C60、C90、C120互为同位素
B.金刚石是自然界硬度最大,能导电的碳单质
C.CO2通入碳酸氢钠溶液中除去碳酸钠杂质
D.二氧化碳分子是保持干冰化学性质的最小微粒A项错误,C60、C90、C120是单质,不是核素,它们之间是互为同素异形体关系;B项错误,金刚石不导电。CD考 点整 合易错提醒:
1.相同条件下酸与碳酸钠反应的反应速率比酸与碳酸氢钠的反应速率小。
2.除去碳酸氢钠溶液中的碳酸钠可通CO2。
3.除去碳酸钠中碳酸氢钠杂质时,固体加热、溶液加NaOH。
4.除去二氧化碳中的氯化氢用饱和碳酸氢钠溶液,不能用碳酸钠溶液。课堂练习考 点整 合5.碳可以多种形式存在。金刚石、C60和石墨( )
A.互为同位素 B.为同一物质
C.互为同素异形体 D.互为同分异构体C金刚石、C60和石墨都是碳单质,互为同素异形体。 栏目链接考 点整 合6.下列方法,不能产生CO2的是( )
A.石灰石与盐酸反应
B.碳酸钠与硫酸反应
C.加热碳酸钠
D.加热碳酸氢钠C碳酸钠热稳定性强,加热不分解。作业:写出下列反应的化学方程式
互称为同素异形体呢?O2和O3 SO2和SO3
冰和水 白磷和红磷
Na和Na+ 多种多样的碳单质1结构决定性质
性质决定用途由碳原子构成的正四面体由平面六边形构成的层状结构由正六边形和正五边形排列而成的球状分子1二、广泛存在的含碳化合物含碳化合物1碳酸钠(纯碱、苏打)
白色固体粉末
碳酸氢钠(小苏打)
白色晶体Na2CO3与NaHCO3物理性质比较白色固体苏打小苏打都易溶于水 但溶解度S碳酸钠>S碳酸氢钠2、碳酸钠和碳酸氢钠化学性质将气球中粉末同时倒入锥形瓶中,观察现象。①气球膨胀②气球膨胀速率更慢③气球膨胀体积更小①气球膨胀②气球膨胀速率更快③气球膨胀体积更大CO32-+ 2H+ =H2 O +CO2 HCO3- + H+ =H2 O +CO2 2、碳酸钠和碳酸氢钠化学性质2.2 与酸反应Na2CO3与NaHCO3的化学性质比较产生气泡CO32-+2H+= CO2↑ + H2O
HCO3-+H+= CO2↑ +H2O无明显现象Na2CO3不反应
HCO3-+OH-= CO32- +H2O产生白色沉淀CO32-+Ca2+= Ca CO3↓
Ca2+ +HCO3-+OH- =
Ca CO3 ↓ +H2ONa2CO3产生白色沉淀
NaHCO3无现象CO32-+Ca2+= Ca CO3↓
NaHCO3不反应Na2CO3无现象
NaHCO3分解产生CO2碳酸氢钠受热分解实验装置:Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
_____________________________
⒉ NaHCO3转变成Na2CO3
①______________________________
②_______________________________Na2CO3NaHCO3CO2归纳BaCO3足量的HClHClNaOH或加热BaCl2Ba(OH)2少量的HCl1〖讨 论〗1、如何鉴别Na2CO3与NaHCO3 ?
2、如何除去Na2CO3中少量的NaHCO3?
3、如何除去NaHCO3中少量的Na2CO3?
加CaCl2溶液;加热加适量NaOH溶液;加热通入中量CO2如何鉴别NaHCO3和KHCO3? 鉴别物质,可以从它们的不同部分来思考,根据不同部分具有不同的性质这一点来进行鉴别。
那么 Na+ 和 K+ 有何不同呢?焰色反应 许多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,在化学上叫焰色反应。 焰
色钠 黄色钾 紫色(透过蓝色钴玻璃)铜 绿色钙 砖红色焰 色 反 应操
作⑴ 点燃酒精灯(最好用煤气灯,火焰颜
色较浅)⑵ 铂丝在酒精灯上灼烧至没有颜色⑶ 铂丝蘸取固体或溶液灼烧,观察。 若是钾元素,应透过蓝色钴玻璃,滤去遮盖紫色的黄光。⑷ 铂丝用稀盐酸洗净,在火焰上灼烧至
没有颜色1.每次试验完后,为什么都要用盐酸洗净铂
丝,并灼烧至无色?2.除金属的化合物之外,单质能不能有同样
的现象呢? 因为金属氯化物灼烧时易气化而挥发,
灼烧至无色后能除去能起焰色反应的少量
杂质。 能,因为焰色反应是金属元素的性质,无论化合物还是单质,只要含有某种金属
元素,这种物质就具有这种金属元素的焰
色反应。3.焰色反应的主要作用是什么?4.焰色反应是物质的物理性质还是化学性质? 由于一般钠盐、钾盐易溶于水,在溶液中
又无颜色,无法通过其他反应进行检验“Na+”、
“K+ ”,所以常常用焰色反应来检验物理性质,属元素性质,与价态无关关于Na2CO3与NaHCO3混合物中各成份质量分数的计算。
〖例题〗将某碳酸钠和碳酸氢钠的混合物 2.74g 加热到质量不再变化时,剩余物质量为 2.12g 。求:
⑴混合物中碳酸氢钠与碳酸钠的物质的量;
⑵将这种混合物与足量的稀盐酸反应可以
生成标准状况下的气体体积。解:用差量法计算:
2NaHCO3==Na2CO3+CO2↑+H2O 固体质量减少
2mol 62.0g
n (NaHCO3) 0.620g
n (NaHCO3)=0.02mol
n (Na2CO3) =(2.74g-0.02mol×84g/mol)/106g·mol-1
=0.01mol
CO32-+2H+= CO2↑ + H2O HCO3-+H+= CO2↑ +H2O
∴ n (CO2)=n (NaHCO3) + n (Na2CO3)=0.03mol
V (CO2)= 0.03mol ×22.4L ·mol-1=0.672L三、自然界中碳及其化合物间的转化大气中的二氧化碳【活动·探究】模拟“溶洞的形成”实验方案及实验记录:开始出现白色沉淀
CO2过量时沉淀溶解出现白色沉淀Ca2+ + 2OH- + CO2 =
Ca CO3↓+ H2O
Ca CO3 +CO2+ H2O =
Ca2+ + 2 H CO3-四、生产和生活中碳及其化合物间的转化1、工业炼铁
2、木炭燃烧概括·整合练习--- 碳及其重要化合物知识回顾考 点整 合足球烯分子 1.碳单质。
(1)碳单质的存在形式主要有:金刚石、石墨、足球烯分子(如C60、C9、C120等),其中能溶于有机溶剂的是________、在死火山口存在较多的是________、能作电极材料的是________。
(2)碳单质主要化学性质:碳有较强的还原性,主要有如下反应:金刚石石墨Si+2CO↑考 点整 合2Cu+CO2↑2CO2SO2↑+2H2O+CO2↑4NO2↑+CO2↑+2H2O考 点整 合2.CO2与CO的比较。石灰水石灰水还原考 点整 合3.碳酸盐。
(1)常见碳酸盐俗称与主要化学成分:石灰石、蛋壳、贝壳、钟乳石________;纯碱、苏打________;小苏打________;碳铵(氮肥)________;硬水的主要成分______和__________;锅垢的主要成分________和______。
(2)碳酸氢钠与碳酸钠性质比较。
①有碳酸盐的通性,两者均与盐酸等反应生成二氧化碳,在反应时耗酸量及生成气体反应速率______。CaCO3Na2CO3NaHCO3NH4HCO3Ca(HCO3)2Mg(HCO3)2CaCO3Mg(OH)2不同考 点整 合②两种盐均能与石灰水或氢氧化钡溶液生成________沉淀。
③碳酸氢钠能跟氢氧化钠等碱反应,碳酸钠________与碱反应。
④碳酸钠跟氯化钙或氯化钡溶液反应生成碳酸盐________沉淀,碳酸氢钠跟氯化钙或氯化钡溶液________反应。
(3)碳酸及其盐稳定性规律:酸<酸式盐<正盐;如:H2CO3
B.金刚石是自然界硬度最大,能导电的碳单质
C.CO2通入碳酸氢钠溶液中除去碳酸钠杂质
D.二氧化碳分子是保持干冰化学性质的最小微粒A项错误,C60、C90、C120是单质,不是核素,它们之间是互为同素异形体关系;B项错误,金刚石不导电。CD考 点整 合易错提醒:
1.相同条件下酸与碳酸钠反应的反应速率比酸与碳酸氢钠的反应速率小。
2.除去碳酸氢钠溶液中的碳酸钠可通CO2。
3.除去碳酸钠中碳酸氢钠杂质时,固体加热、溶液加NaOH。
4.除去二氧化碳中的氯化氢用饱和碳酸氢钠溶液,不能用碳酸钠溶液。课堂练习考 点整 合5.碳可以多种形式存在。金刚石、C60和石墨( )
A.互为同位素 B.为同一物质
C.互为同素异形体 D.互为同分异构体C金刚石、C60和石墨都是碳单质,互为同素异形体。 栏目链接考 点整 合6.下列方法,不能产生CO2的是( )
A.石灰石与盐酸反应
B.碳酸钠与硫酸反应
C.加热碳酸钠
D.加热碳酸氢钠C碳酸钠热稳定性强,加热不分解。作业:写出下列反应的化学方程式
