高中化学第3章物质在水溶液中的行为3.2.1弱电解质的电离平衡课件鲁科版选修4
文档属性
| 名称 | 高中化学第3章物质在水溶液中的行为3.2.1弱电解质的电离平衡课件鲁科版选修4 |

|
|
| 格式 | zip | ||
| 文件大小 | 817.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-22 11:46:04 | ||
图片预览







文档简介
课件25张PPT。第1节 弱电解质的电离 盐类的水解
第1课时 弱电解质的电离平衡第三章 物质在水溶液中的行为盐酸属于强酸,能与大多数金属盐类发生反应,醋酸也具有腐蚀性。如果用上述两种酸来清理卫生洁具,应该用盐酸还是醋酸?二者有何差别?学习目标1.会描述弱电解质的电离平衡,能正确书写弱电解质的电离方程式,会分析电离平衡的移动
2. 知道电离平衡常数的意义学习重点电离平衡的影响因素和电离平衡常数学习难点电离平衡的影响因素和电离平衡常数1. 将下列(Ⅰ)中的物质与(Ⅱ)、(Ⅲ)中的物质类型用短线连接起来。
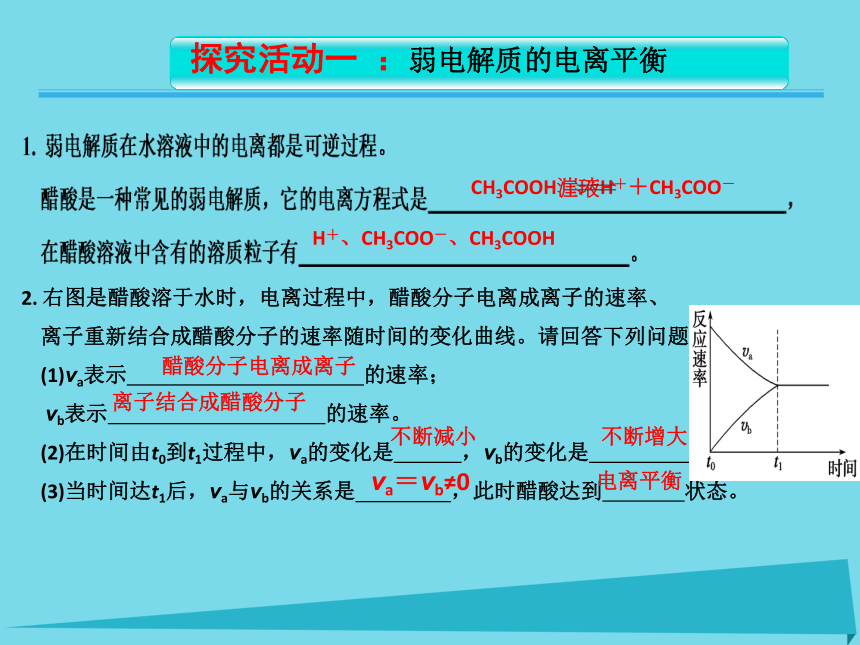
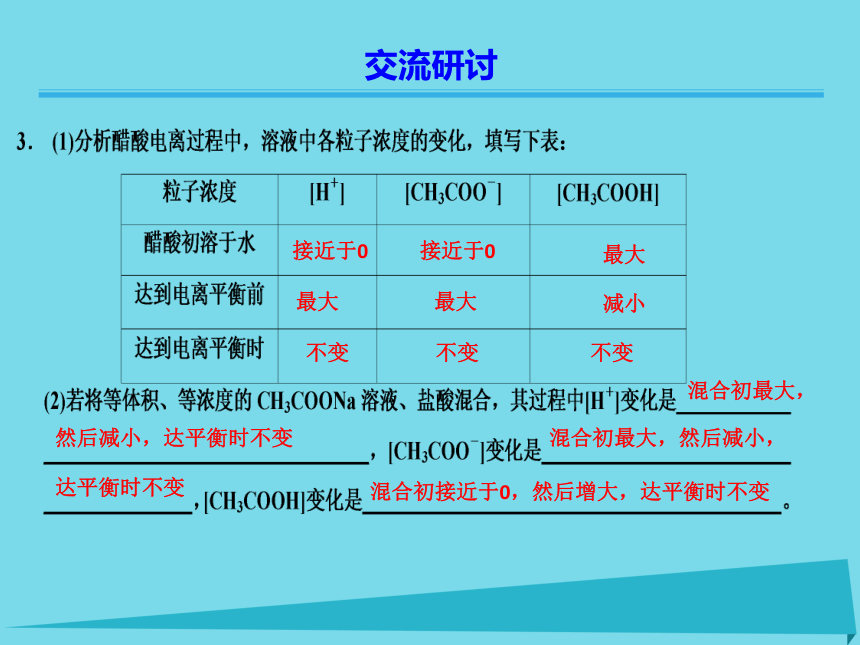
单质和混合物既不是电解质也不是非电解质温故知新Kw=[H+][OH-]增大 减小 10-12 mol·L-12或12 温故知新CH3COOH??H++CH3COO-H+、CH3COO-、CH3COOH2. 右图是醋酸溶于水时,电离过程中,醋酸分子电离成离子的速率、
离子重新结合成醋酸分子的速率随时间的变化曲线。请回答下列问题:
(1)va表示 的速率;
vb表示 的速率。
(2)在时间由t0到t1过程中,va的变化是 ,vb的变化是 。
(3)当时间达t1后,va与vb的关系是 ,此时醋酸达到 状态。醋酸分子电离成离子 离子结合成醋酸分子 不断减小 不断增大 va=vb≠0电离平衡 接近于0 接近于0 最大 减小 最大 最大 不变 不变 不变 然后减小,达平衡时不变 混合初最大,混合初最大,然后减小,混合初接近于0,然后增大,达平衡时不变 达平衡时不变交流研讨向右移动 向左移动 向右移动 向右移动 向左移动 增大 减小 增大 减小 减小 增大 减小 减小 增大 增大 勒·夏特列原理不但适用于化学平衡,也适用于其他平衡如:电离平衡、水解平衡、沉淀的溶解平衡等。交流研讨1.电离平衡状态2.电离平衡的特征率和离子结合成弱电解质分子的速率相等时,电离过程就达到了电离平衡状态。在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速(1)弱电解质的电离平衡是一种动态平衡,平衡时其电离过程并没有
停止,只是溶液中各分子和离子的浓度都保持不变。(2)外界条件发生变化,电离平衡随之发生变化。归纳总结加入含有弱电解质离子的强电解质,电离平衡向逆反应方向移动;加入能与弱电解质离子反应的物质时,电离平衡向正反应方向移动。由于电离过程吸热,升温,电离平衡向正反应方向移动;降温,电离平衡向逆反应方向移动。(1)温度:电解质溶液的浓度越小,它的电离程度就越大。(2)浓度:(3)其他因素:3. 影响电离平衡的因素归纳总结4.弱电解质的电离方程式的书写归纳总结判断电离达平衡的标志是:
一、V电离=V结合。
二、可变量达不变。
相等并不能证明达平衡,平衡也不一定相等。D 学以致用加入HCl时 H+的浓度变大,平衡向其减小的方向(也就是逆反应方向)移动,但最终 H+的浓度比未加 HCl 前还是要大加入 CH3COONa 固体,CH3COO- 的浓度增大,平衡向逆反应方向移动加入水促进弱电解质的电离加入NaOH固体, 与H+反应,H+的浓度变小,平衡向正反应方向移动
B 学以致用如CH3COOH的电离常数的表达式是
NH3·H2O的电离常数的表达式是1.电离平衡与化学平衡类似,根据化学平衡常数的表达
式,则弱电解质AB A++B-的电离平衡常数(简
称电离常数)的表达式为 2. 一元弱酸的电离常数用 Ka 表示,一元弱碱的电离常数
用 Kb 表示。对于一般的可逆反应,mA(g)+nB(g)??pC(g)+qD(g),当在一定温度下达到平衡时,化学平衡常数为[ ]3. 根据电离常数的表达式分析判断,电离常数 K 值越大,表示该弱电解质
越容易电离,所对应的弱酸的酸性相对较强(或弱碱的碱性相对较强)。交流研讨(3)多元弱酸分步电离,每一步电离都有各自的电离平衡常数。各级电离常数的大小关系是Ka1?Ka2?Ka3,所以其酸性主要决定于第一步电离。(1)电离常数的定义:指一定温度下,弱电解质达到电离平衡时,弱电解质电离生成的各种离子浓度的乘积与溶液中未电离的分子浓度之比(为一常数),简称电离常数,用K表示。电离常数与浓度无关,只与温度有关。由于电离是吸热的,所以电离平衡常数随着温度的升高而增大。(2)电离常数的意义:根据电离常数大小,可以判断弱电解质的相对强弱,K值越大,离子浓度越大,即表示该电解质越强。所以从Ka或Kb的大小,可以判断弱酸或弱碱的相对强弱。归纳总结电离平衡常数是温度的函数,与溶液浓度无关 酸中c(H+)既跟酸的电离常数有关,还跟酸的浓度有关 B 学以致用一定温度下,当溶液的浓度一定时,[H+]随电离常数的增大而增大。题中K(HF)>
K(CH3COOH)>K(HCN),故氢离子浓度HF溶液最大,余下的未电离的HF分子最少,而HCN溶液中未电离的HCN分子浓度最大。 HCN HF学以致用归纳总结ΔH>0CH3COOH CH3COO- + H+1.在0.1 mol·L-1的CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO―+H+。对于该平衡,下列叙述正确
的是( )
A.加入少量NaOH固体,平衡正向移动
B.加水,反应速率增大,平衡逆向移动
C.滴加少量0.1 mol·L-1HCl溶液,溶液中[H+]减少
D.加入少量CH3COONa固体,平衡正向移动 A当堂检测2.(双选)将0.1 mol·L-1的氨水稀释10倍,随着氨水浓度的
降低,下列数据逐渐增大的是( )
A.[H+] B.[OH-]
C.[OH-]/[NH3·H2O] D.[ ]
3.(双选)一定量的盐酸跟过量的铁粉反应时,为减缓反应
速率而不影响生成氢气的总量,可向盐酸中加入适量( )
A.NaOH(固) B.H2O
C.NH4Cl(固) D.CH3COONa (固)ACBD当堂检测4.已知次氯酸比碳酸酸性弱,反应Cl2+H2O HCl+HClO
达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.水
C.CaCO3固体 D.NaOH固体C当堂检测5.(1)有 pH相同 的三种酸:a.盐酸 b.硫酸 c.醋酸,物质
的量浓度由大到小是: 。(2)有物质的量浓度相同 的三种酸:a.盐酸 b.硫酸
c.醋酸,pH由小到大是 。ba>b当堂检测集腋成裘,聚沙成塔。几秒钟虽然不长,却能构成永恒长河中的伟大时代。
2. 知道电离平衡常数的意义学习重点电离平衡的影响因素和电离平衡常数学习难点电离平衡的影响因素和电离平衡常数1. 将下列(Ⅰ)中的物质与(Ⅱ)、(Ⅲ)中的物质类型用短线连接起来。
单质和混合物既不是电解质也不是非电解质温故知新Kw=[H+][OH-]增大 减小 10-12 mol·L-12或12 温故知新CH3COOH??H++CH3COO-H+、CH3COO-、CH3COOH2. 右图是醋酸溶于水时,电离过程中,醋酸分子电离成离子的速率、
离子重新结合成醋酸分子的速率随时间的变化曲线。请回答下列问题:
(1)va表示 的速率;
vb表示 的速率。
(2)在时间由t0到t1过程中,va的变化是 ,vb的变化是 。
(3)当时间达t1后,va与vb的关系是 ,此时醋酸达到 状态。醋酸分子电离成离子 离子结合成醋酸分子 不断减小 不断增大 va=vb≠0电离平衡 接近于0 接近于0 最大 减小 最大 最大 不变 不变 不变 然后减小,达平衡时不变 混合初最大,混合初最大,然后减小,混合初接近于0,然后增大,达平衡时不变 达平衡时不变交流研讨向右移动 向左移动 向右移动 向右移动 向左移动 增大 减小 增大 减小 减小 增大 减小 减小 增大 增大 勒·夏特列原理不但适用于化学平衡,也适用于其他平衡如:电离平衡、水解平衡、沉淀的溶解平衡等。交流研讨1.电离平衡状态2.电离平衡的特征率和离子结合成弱电解质分子的速率相等时,电离过程就达到了电离平衡状态。在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速(1)弱电解质的电离平衡是一种动态平衡,平衡时其电离过程并没有
停止,只是溶液中各分子和离子的浓度都保持不变。(2)外界条件发生变化,电离平衡随之发生变化。归纳总结加入含有弱电解质离子的强电解质,电离平衡向逆反应方向移动;加入能与弱电解质离子反应的物质时,电离平衡向正反应方向移动。由于电离过程吸热,升温,电离平衡向正反应方向移动;降温,电离平衡向逆反应方向移动。(1)温度:电解质溶液的浓度越小,它的电离程度就越大。(2)浓度:(3)其他因素:3. 影响电离平衡的因素归纳总结4.弱电解质的电离方程式的书写归纳总结判断电离达平衡的标志是:
一、V电离=V结合。
二、可变量达不变。
相等并不能证明达平衡,平衡也不一定相等。D 学以致用加入HCl时 H+的浓度变大,平衡向其减小的方向(也就是逆反应方向)移动,但最终 H+的浓度比未加 HCl 前还是要大加入 CH3COONa 固体,CH3COO- 的浓度增大,平衡向逆反应方向移动加入水促进弱电解质的电离加入NaOH固体, 与H+反应,H+的浓度变小,平衡向正反应方向移动
B 学以致用如CH3COOH的电离常数的表达式是
NH3·H2O的电离常数的表达式是1.电离平衡与化学平衡类似,根据化学平衡常数的表达
式,则弱电解质AB A++B-的电离平衡常数(简
称电离常数)的表达式为 2. 一元弱酸的电离常数用 Ka 表示,一元弱碱的电离常数
用 Kb 表示。对于一般的可逆反应,mA(g)+nB(g)??pC(g)+qD(g),当在一定温度下达到平衡时,化学平衡常数为[ ]3. 根据电离常数的表达式分析判断,电离常数 K 值越大,表示该弱电解质
越容易电离,所对应的弱酸的酸性相对较强(或弱碱的碱性相对较强)。交流研讨(3)多元弱酸分步电离,每一步电离都有各自的电离平衡常数。各级电离常数的大小关系是Ka1?Ka2?Ka3,所以其酸性主要决定于第一步电离。(1)电离常数的定义:指一定温度下,弱电解质达到电离平衡时,弱电解质电离生成的各种离子浓度的乘积与溶液中未电离的分子浓度之比(为一常数),简称电离常数,用K表示。电离常数与浓度无关,只与温度有关。由于电离是吸热的,所以电离平衡常数随着温度的升高而增大。(2)电离常数的意义:根据电离常数大小,可以判断弱电解质的相对强弱,K值越大,离子浓度越大,即表示该电解质越强。所以从Ka或Kb的大小,可以判断弱酸或弱碱的相对强弱。归纳总结电离平衡常数是温度的函数,与溶液浓度无关 酸中c(H+)既跟酸的电离常数有关,还跟酸的浓度有关 B 学以致用一定温度下,当溶液的浓度一定时,[H+]随电离常数的增大而增大。题中K(HF)>
K(CH3COOH)>K(HCN),故氢离子浓度HF溶液最大,余下的未电离的HF分子最少,而HCN溶液中未电离的HCN分子浓度最大。 HCN HF学以致用归纳总结ΔH>0CH3COOH CH3COO- + H+1.在0.1 mol·L-1的CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO―+H+。对于该平衡,下列叙述正确
的是( )
A.加入少量NaOH固体,平衡正向移动
B.加水,反应速率增大,平衡逆向移动
C.滴加少量0.1 mol·L-1HCl溶液,溶液中[H+]减少
D.加入少量CH3COONa固体,平衡正向移动 A当堂检测2.(双选)将0.1 mol·L-1的氨水稀释10倍,随着氨水浓度的
降低,下列数据逐渐增大的是( )
A.[H+] B.[OH-]
C.[OH-]/[NH3·H2O] D.[ ]
3.(双选)一定量的盐酸跟过量的铁粉反应时,为减缓反应
速率而不影响生成氢气的总量,可向盐酸中加入适量( )
A.NaOH(固) B.H2O
C.NH4Cl(固) D.CH3COONa (固)ACBD当堂检测4.已知次氯酸比碳酸酸性弱,反应Cl2+H2O HCl+HClO
达到平衡后,要使HClO浓度增大,可加入( )
A.NaCl固体 B.水
C.CaCO3固体 D.NaOH固体C当堂检测5.(1)有 pH相同 的三种酸:a.盐酸 b.硫酸 c.醋酸,物质
的量浓度由大到小是: 。(2)有物质的量浓度相同 的三种酸:a.盐酸 b.硫酸
c.醋酸,pH由小到大是 。b
