2017-2018学年度第一学期高一期中模拟化学试题
文档属性
| 名称 | 2017-2018学年度第一学期高一期中模拟化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 169.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-10-30 09:19:05 | ||
图片预览




文档简介
高一(上)期中测试
化学试题
可能用到的相对原子质量有:H一1
C一12
N一14
O一16
Na一23
S一32
Cl一35.5
K一39
Mn一55
Cu一64
第I卷
选择题
(共45分)
一、选择题(本大题共15小题,每小题只有一个正确选项,每小题3分,共45分)
1.己知金属钾投入水中会发生剧烈反应,并有氢气生成。运输金属钾的包装箱应贴有的图标是(
)
INCLUDEPICTURE
"http:///quiz/images/201508/100/39956cc6.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201508/100/39956cc6.png"
\
MERGEFORMATINET
A.易燃液体
INCLUDEPICTURE
"http:///quiz/images/201302/27/5d189f7a.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201302/27/5d189f7a.png"
\
MERGEFORMATINET
B.遇湿易燃物品
INCLUDEPICTURE
"http:///quiz/images/201312/207/d80728aa.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201312/207/d80728aa.png"
\
MERGEFORMATINET
C.氧化剂
INCLUDEPICTURE
"http:///quiz/images/201508/100/fc0dc338.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201508/100/fc0dc338.png"
\
MERGEFORMATINET
D.腐蚀品
2.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是(
)
A.蒸馏
B.升华
C.干馏
D.萃取
3.下列物质分类正确的是(
)
A.大理石、CuSO4·5H2O、氨水均为混合物
B.SO2、SiO2、CO均为酸性氧化物
C.稀豆浆、油水、氯化铁溶液均为胶体
D.HCl、纯碱、硫酸钡均为强电解质
4.下列说法正确的是(
)
A.胶体区别于其他分散系的本质依据是具有丁达尔效应
B.通电时溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动
C.纳米材料粒子直径一般在10﹣9m与10﹣7m之间,因此纳米材料属于胶体
D.在江河入海处容易形成沙洲与胶体的聚沉有关
5.下列实验过程的评价,正确的是(
)
A.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含有Cl-
B.某溶液中先滴加稀硝酸酸化,再滴加几滴Ba(NO3)2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
6.下列物质中属于电解质,且能导电的是(
)
A.固态氯化钠
B.液态铜
C.液态氯化氢
D.熔融的氢氧化钾
7.设NA为阿伏加德罗常数的值,下列说法中正确的是(
)
A.12gC60中含有NA个电子
B.46g
NO2和N2O4的混合气体含有的原子数为3NA
C.标准状况下,22.4L
CCl4所含的分子数约为6.02×1023
D.100mL0.1mol/LCaCl2溶液中Cl-的物质的量浓度为0.01mol/L
8.下列离子方程式中,正确的是(
)
A.盐酸滴在大理石上:2H++
CO2-3=CO2↑+H2O
B.硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
C.向NaOH溶液中通入过量CO2:OH﹣+CO2=HCO3﹣
D.澄清石灰水与过量NaHCO3溶液反应:Ca2++OH﹣+
HCO3﹣=CaCO3↓+H2O
9.下列各组离子,在酸性溶液中能大量共存,且溶液为无色透明的是(
)
A.K+、MnO4﹣、S2﹣、SO42﹣
B.K+、OH﹣、Cl﹣、CO32﹣
C.Ca2+、CH3COO﹣、Al3+、SO42﹣
D.Na+、Ba2+、Cl﹣、NO3﹣
10.下列各组物质中,被氧化与被还原的物质的物质的量之比为1:2的是(
)
A.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
B.SO2+2H2S=3S+2H2O
C.3NO2+H2O=2HNO3+NO
D.3S+6KOH=2K2S+K2SO3+3H2O
11.对标准状况下的四种气体的关系从小到大表示不正确的是(
)
①6.72L甲烷
②3.01×1023HCl分子
③13.6g
H2S
④0.2mol
NH3
A.质量:④<①<③<②
B.密度:①<④<③<②
C.体积:④<①<②<③
D.氢原子数:②<④<③<①
12.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是(
)
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1mol
KClO3参加反应有2mol电子转移
D.H2C2O4在反应中被氧化
13.一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+H2O=RO42-+2Cl-+2H+,从而可知在RO3n-中,元素R的化合价是(
)
A.+4价
B.+5价
C.+6价
D.+7价
14.同温同压下,分别用等质量的H2、CO、CO2、NH3四种气体吹起四个气球,其中由H2吹起的是( )
A.
B.
C.
D.
15.将12mol/L的盐酸(ρ=1.15g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为(
)
A.57.5mL
B.55mL
C.52.5mL
D.50mL
第II卷
非选择题(共55分)
二、填空题
(本题共有5个小题)
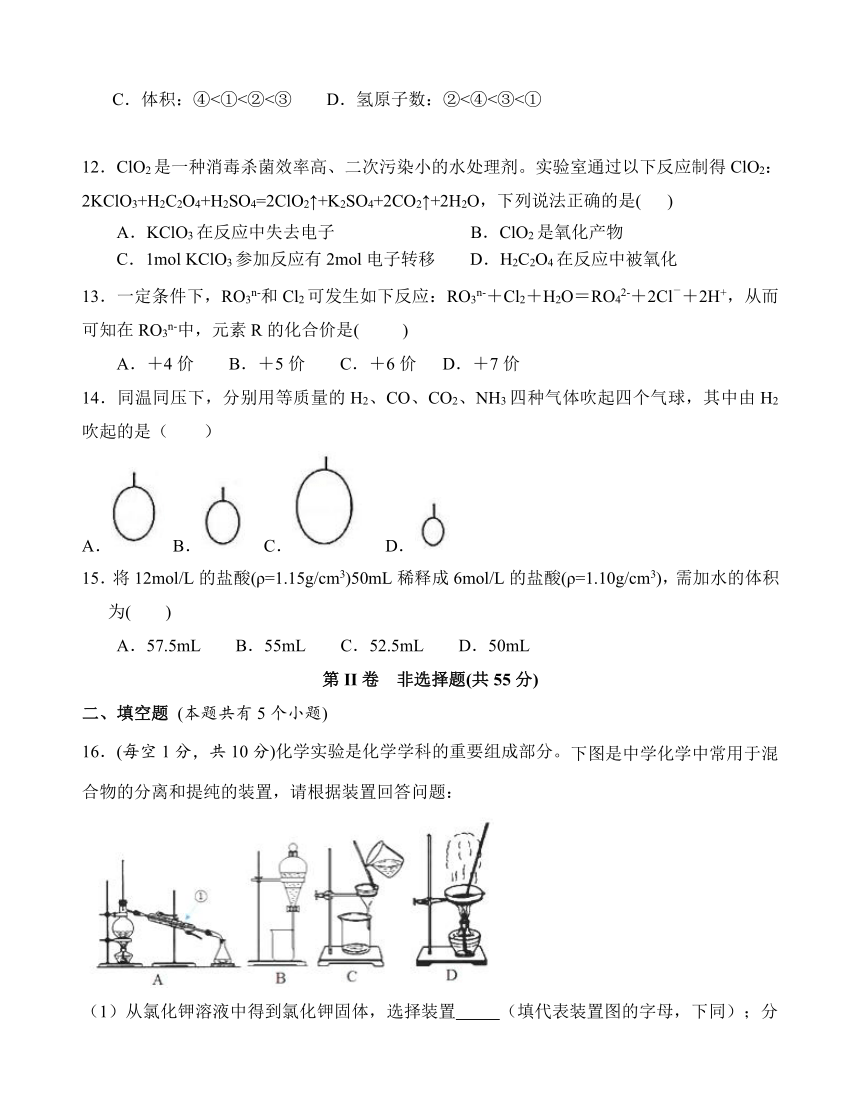
16.(每空1分,共10分)化学实验是化学学科的重要组成部分。下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置
(填代表装置图的字母,下同);分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置______,该分离方法的名称为____________。
(2)从碘水中分离出I2,选择装置___________,该分离方法的名称为___________,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在
(填“上层”或“下层”)液体中,该层溶液颜色为
。
(3)装置A中①的名称是____________,进水的方向是从
(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作
。
17.(除特殊说明,每空1分,共7分)实验室欲用NaOH固体配制1.0
mol·L-1的NaOH溶液240
mL:
(1)配制溶液时,一般可以有以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移
⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________(填序号)。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有_____________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为________
g,要完成本实验该同学应称出________
g
NaOH.
(3)使用容量瓶前必须进行的一步操作是________。(填操作名称)
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________(填序号)(2分)
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥
定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
18.(每空2分,共18分)化学方程式、电离方程式、离子方程式都是非常重要的化学用语。
(1)现有以下九种物质:①铁片
②熔融NaCl
③稀氨水
④CH3COOH
⑤乙醇
⑥稀盐酸
⑦H2SO4
⑧氯化银
⑨CO2,其中属于非电解质的是_______(填写序号,下同);属于强电解质的是________;写出上述物质中的弱电解质在水中的电离方程式_________________________________。
(2)写出不能用H++OH﹣=H2O表示的两个酸碱中和反应的化学方程式(要求:反应物均不能重复且它们对应的离子方程式也不能相同)。
①___________________________________________;
②___________________________________________;
③___________________________________________。
(3)在硝酸铅[Pb(NO3)2]的稀溶液中,滴入几滴稀硫酸钠溶液生成PbSO4白色沉淀,再滴入数滴饱和醋酸钠(CH3COONa)溶液,微热并不断搅拌,沉淀慢慢溶解。以上发生的都是复分解反应,请依次写出反应过程中的离子方程式:___________________________、_____________________________________。
第二步离子反应发生的原因是______________________________。
19.(每空2分,共10分)某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+中的一种或几种离子,请回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是 。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定存在的离子是 ,生成的沉淀的化学式为 。
(3)取(2)的上层清液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有
。
(4)原溶液中可能大量存在的阴离子是 (填序号)。
A.Cl
B.CO32
C.NO3
D.OH
20.(除特殊说明,每空2分,共10分)在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中:
(1)氧化剂是(填化学式)
(1分),还原剂是(填化学式)
(1分)。上述方程式中氧化剂与还原剂的比为
(2)在该反应中,若消耗了15.8g
KMnO4,则转移了
mol
电子.
(3)用双线桥表示高锰酸钾和浓盐酸反应的电子转移方向和数目.
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(4)工业上用软锰矿(主要成分为MnO2)、氢氧化钾以及氧气为原料生产锰酸钾(化学式为K2MnO4),请写出该反应的化学方程式_____________________________。
答案与解析
选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项
B
B
D
D
A
D
B
C
D
D
C
D
A
C
C
1.【答案】B
【考查】化学实验基础。
【解析】钾和水反应的方程式为2K+2H2O=H2↑+2KOH,生成物中含有氢气,氢气易燃烧,所以应贴遇湿易燃品,故选B.
2.【答案】B
【考查】物质的分离、提纯的基本方法选择与应用。为高频考点,侧重考查学生的分析能力和实验能力,注意把握题给信息以及常见分离方法,难度不大。
【解析】“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳”,用到加热的方法,将被提纯物质气化、冷凝为固体的过程,此为升华操作;没有隔绝空气强热,不是干馏;萃取无需加热。故选B.
3.【答案】D
【考查】物质的分类基础知识。
【解析】
A.大理石主要成分是碳酸钙,为混合物;硫酸铜晶体为化合物;氨水是氨气的水溶液属于混合物,故A错误;
B.和碱反应生成盐和水的化合物为酸性氧化物,CO不能反应属于不成盐氧化物,故B错误;
C.油水属于浊液、氯化铁溶液是溶液,不属于胶体,稀豆浆属于胶体,故C错误;
D.酸碱盐都是电解质,HCl、纯碱、硫酸钡在水溶液中全部电离的化合物为强电解质,故D正确.
4.【答案】D
【考查】胶体的基本概念及性质。
【解析】
A.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm;丁达尔效应是胶体的性质,故A错误;
B.通电时,若溶液中的溶质粒子是电解质,则电离出的阴阳离子分别向两极移动;若溶质是非电解质则不移向电极。胶体中的分散质粒子若带电,则向某一极移动,否则不会发生电泳现象,故B错误;
C.胶体是指分散质粒子直径在1nm~100nm之间的分散系,胶体是一种分散系,纳米材料只是一种分散质,没有形成分散系,所以不是胶体,故C错误;
D.河流中的水含有泥沙胶粒,海水中含有氯化钠、氯化钙等电解质,二者相遇是可以发生胶体凝聚,就形成三角洲,与胶体有关,故D正确.
5.【答案】A
【考查】物质的检验,这道题考查的是常见离子的检验。
【解析】B实验中还可能有SO32-,C实验证明该溶液呈酸性,D实验该固体也可能是亚硫酸盐,只有A实验评价正确。
6.【答案】D
【考查】电解质的基本概念。
【解析】
A.固态氯化钠没有自由移动的离子,不导电;但氯化钠晶体为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,A错误;
B.液态铜是单质,故不属于电解质,电解质和非电解质的前提必须是化合物,故B错误;
C.液态HCl中没有自由移动的离子,不导电;但HCl溶于水在水分子的作用下能电离出氯离子和氢离子,属于电解质,故C错误;
D.熔融的氢氧化钾中有自由移动的离子,能导电,是化合物,则属于电解质,故D正确。
7.【答案】B
【考查】阿伏伽德罗常数,高考必考。
【解析】
A.C60由碳原子构成,故12g的C60中含有的碳原子的物质的量为
n=60×
=
1mol,每mol碳原子所含的电子数是6mol,故应含有6NA个电子,A错误;
B.NO2和N2O4均由NO2构成,故46g混合物中含有的NO2的物质的量n==1
mol,含有3NA个原子,故B正确;
C.标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D.1mol氯化钙中含2mol氯离子,故0.1mol/L的氯化钙溶液中氯离子的浓度为0.2mol/L,故D错误.
8.【答案】C
【考查】离子方程式的正确书写。
【解析】
A.盐酸滴在大理石上的离子反应为2H++CaCO3═
Ca2++CO2↑+H2O,A错误;
B.稀硫酸滴在铜片上,不能发生反应,故B错误;
C.向NaOH溶液中通入过量CO2的离子反应为OH-+CO2═
HCO3-,C正确;
D.澄清石灰水与过量NaHCO3溶液反应的离子反应为Ca2++2OH-+2
HCO3-═CaCO3↓+2
H2O
+CO32-,故D错误;故选C.
9.【答案】D
【考查】离子共存问题。
【解析】
A.MnO4﹣在溶液中呈紫色,且酸性条件下可与S2﹣发生氧化还原反应。不能大量共存,A错误;
B.OH﹣和CO32﹣都不能与H+大量共存,故B错误;
C.CH3COO-与H+不能大量共存,会发生离子反应生成弱电解质CH3COOH;故选D。
10.【答案】D
【考查】要求学生掌握氧化剂和还原剂的基本概念。
【解析】
A.Cu+2H2SO4
═
CuSO4+SO2↑+2H2O反应中,Cu→CuSO4,铜的化合价升高,所以铜是还原剂,还原剂被氧化;H2SO4是氧化剂,被还原;且被氧化与被还原的物质的物质的量之比为1:1,A错误;
B.在SO2+2H2S=2H2O+3S↓反应中,H2S中S元素的化合价由-2升高到0,为还原剂,被氧化;SO2中S元素的化合价由+4降低为0,为氧化剂,被还原;且被氧化与被还原的物质的物质的量之比为2:1,则S单质既是氧化产物又是还原产物,B错误;
C.NO2既被氧化又被还原,且被氧化与被还原的物质的量之比为2:1
D.3S+6KOH=2K2S+K2SO3+3H2O中硫元素化合价由0价变为-2价和+4价,氧化产物和还原产物的物质的量之比为1:2,故D正确。
11.【答案】C
【考查】物质的量的相关计算以及物质的量的桥梁作用。
【解析】
①6.72L
CH4的物质的量为0.3mol,②3.01×1023个HCl的物质的量为0.5mol,③13.6g
H2S的物质的量为0.4mol,④
NH3的物质的量为0.2mol。
A.6.72L
CH4的质量是m=nM=0.3mol×16g/mol=4.8g,3.01×1023个HCl的质量为0.5mol×36.5g/mol=18.25g,0.2mol
NH3的质量是0.2mol×17g/mol=3.4g
所以质量关系是④<①<③<②,故A正确;
B.根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比,所以密度关系为:①<④<③<②,故B正确;
C.3.01×1023个HCl的体积V=nVm,标况下,体积与物质的量成正比。所以体积关系为:④<①<③<②,故C错误;
D.6.72L
CH4氢原子的物质的量为1.2mol,3.01×1023个HCl氢原子的物质的量为0.5mol,13.6g
H2S氢原子的物质的量为0.8mol,0.2mol
NH3氢原子的物质的量为0.6mol,氢原子数目和氢原子的物质的量成正比,所以氢原子数关系是
②<④<③<①,故D正确.故选C.
12.【答案】D
【考查】氧化还原反应;电子的转移
【解析】
A.因反应中Cl元素的化合价由+5降低为+4价,则KClO3在反应中得到电子,故A正确;
B.Cl元素的化合价降低,被还原,对应的产物为还原产物,即ClO2是还原产物,故B正确;
C.因C元素的化合价由+3升高到+4价,则H2C2O4在反应中作还原剂,被氧化,故C正确;
D.Cl元素的化合价由+5降低为+4价,1mol
KClO3参加反应转移的电子为1mol×(5-4)=1mol,故D错误.
13.【答案】A
【考查】氧化还原反应中得失电子守恒
【解析】
在离子RO3n-中R的化合价为+(6-n),反应后变为+6价,失去6-(6-n)=n个电子。氯气中氯元素的化合价从0价降低到-1价。得到1个电子,即氯气在反应中得到2个电子,所以根据电子得失守恒可知,n=2,则RO3n-中,元素R的化合价是+(6-n)=+4价,答案选A。
14.【答案】C
【考查】阿伏加德罗定律及推论,并考查学生的计算能力
【解析】
根据n=可知,等质量的H2、CO、CO2、NH3四种气体,物质的量与其摩尔质量成反比,即摩尔质量越大,则物质的量越小;在同温同压下,体积之比等于物质的量之比;故摩尔质量越小,则物质的量越大,体积越大。四种物质中H2的摩尔质量最小,其体积最大,则选项C是由H2吹起的。
15.【答案】C
【考查】物质的量浓度;溶液的稀释
【解析】
稀释过程中溶质即氯化氢的物质的量不变,则稀释后溶液的体积为:
=0.1L=100mL,需要加入水的质量为:1.10g/mL×100mL-1.15g/mL×50mL=52.5g,水的密度约为1g/mL,则需要加水的体积为:mL=52.5mL,故选C.、
二、非选择题
16.
【答案】
(1)
D,A,蒸馏
(2)B,萃取,下层,紫色或紫红色(3)冷凝管,下,打开分液漏斗的上口活塞
【考查】物质的分离、提纯和检验
【解析】(1)第一个提纯需要蒸发,需选D装置;第二个提纯需要蒸馏,应选A装置;
(2)此时的操作叫萃取,应选B装置;CCl4的密度比水大,故碘的CCl4溶液应在液体的下层,其颜色为紫色或紫红色。
(3)装置A中①的名称是冷凝管,为使冷凝效果最好,从下口进水,上口出水;为使液体顺利下滴,对B装置应先打开分液漏斗的上口活塞。
17.【答案】
(1)②①③⑧⑤⑥⑦④
250
mL容量瓶
(2)27.4
10.0
(3)查漏
(4)④⑤
【考查】化学实验基础操作;一定物质的量浓度的溶液的配制
【解析】
(1)由溶液的配制原则,该实验的操作顺序为:②①③⑧⑤⑥⑦④
,所用的仪器除题给的外,还需要容量瓶,因没有240mL的容量瓶,所配溶液要250mL,故需要250
mL容量瓶。
(2)图示看到烧杯质量为(20+10-2.6)=27.4g;需要的氢氧化钠质量为1×0.25×40=10.0
g
(3)使用容量瓶之前实现要检查其是否漏水,即查漏
(4)
①②的溶质减少、⑥的溶剂增多,这些操作都会使浓度偏低;③对实验无影响;④⑤的溶剂偏少,浓度偏高。
18.【答案】
(1)⑤⑨;
②⑦⑧;CH3COOH
CH3COO-+H+;
(2)
Ba(OH)2+H2SO4=BaSO4↓+2H2O;或CH3COOH+NaOH=CH3COONa+H2O;或NH3
H2O+HCl=NH4Cl+H2O;(答案合理即可)
(3)
Pb2+
+
SO42-
=
PbSO4↓;PbSO4+2CH3COO-=(CH3COO)2Pb+
SO42-;生成了弱电解质.
【考查】电解质和非电解质的概念;电离方程式以及离子方程式的书写;离子反应发生的条件
【解析】
(1)①铁片是单质,即不是电解质也不是非电解质;②熔融NaCl是强电解质;③稀氨水是混合物,即不是电解质也不是非电解质;④CH3COOH是电解质,在溶液中部分电离属于弱电解质;⑤酒精是非电解质;⑥稀盐酸是氯化氢的水溶液是电解质的水溶液;
⑦H2SO4是电解质,水溶液中全部电离属于强电解质;⑧氯化银是电解质熔融中完全电离属于强电解质;⑨CO2是非电解质,综上所述分析判断:属于非电解质的是⑤⑨;属于强电解质的是②⑦⑧;弱电解质在水溶液中的电离方程式:CH3COOH
CH3COO-+H+;
(2)不能用H++OH-=H2O表示的三个酸碱中和反应的化学方程式可以为:
①稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,反应的化学方程式为:
Ba(OH)2+H2SO4=BaSO4↓+2H2O;
②乙酸具有酸的通性,可以和烧碱氢氧化钠发生中和反应,即:CH3COOH+NaOH=CH3COONa+H2O;
③氨水和盐酸反应生成氯化铵和水,反应方程式为:NH3
H2O+HCl=NH4Cl+H2O,
故答案为:NH3
H2O+HCl=NH4Cl+H2O;(答案合理即可)
(3)题中已知反应都是复分解反应,而此类离子反应的发生条件为①有难溶物生成,②有挥发性物质生成,③有弱电解质生成。第一步离子反应已给出了PbSO4,铅离子和硫酸根离子之间不共存,二者反应生成白色沉淀,则离子方程式为:Pb2++SO42-=PbSO4↓。硫酸铅是强电解质,向其中加入饱和醋酸钠溶液会生成弱电解质醋酸铅,即PbSO4+2CH3COO-=(CH3COO)2Pb+
SO42-,产物中无难溶物、无挥发性物质,则推测(CH3COO)2Pb一定为弱电解质。
19.【答案】
(1)Fe3+
(2)Ag+
;Ag++
Cl-
=
AgCl
↓ (3)Mg2+
(4)C
【考查】离子共存
【解析】
(1)Fe3+有颜色,一定不能存在
(2)此时发生的反应是Ag++
Cl-
=
AgCl
↓,故原溶液一定有Ag+;
(3)该实验生成的白色沉淀的氢氧化镁,原溶液一定有Mg2+;
(4)题给的四种离子只有NO3-可以和判断出的三种离子共存,故选项为C。
20.【答案】
(1)氧化剂是KMnO4,还原剂HCl;
(2)在该反应中,若消耗了15.8g
KMnO4,则转移了0.5mol
电子;
(3)用双线桥表示高锰酸钾和浓盐酸反应的电子转移方向和数目.
(4)2MnO2+4KOH
+O2
2K2MnO4+2H2O
【考查】氧化还原反应;利用氧化还原反应进行陌生方程式的书写,为高频考点
【解析】
(1)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,HCl为还原剂,该反应转移10e﹣.
(2)根据Mn元素化合价由+7降低到+2,所以若消耗了15.8g
KMnO4,则转移了×(7﹣2)=0.5mol,故答案为:0.5;
(3)双线桥标出电子的转移方向和数目为
(4)2MnO2+4KOH
+O2
2K2MnO4+2H2O
12g
60×12g/mol
化学试题
可能用到的相对原子质量有:H一1
C一12
N一14
O一16
Na一23
S一32
Cl一35.5
K一39
Mn一55
Cu一64
第I卷
选择题
(共45分)
一、选择题(本大题共15小题,每小题只有一个正确选项,每小题3分,共45分)
1.己知金属钾投入水中会发生剧烈反应,并有氢气生成。运输金属钾的包装箱应贴有的图标是(
)
INCLUDEPICTURE
"http:///quiz/images/201508/100/39956cc6.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201508/100/39956cc6.png"
\
MERGEFORMATINET
A.易燃液体
INCLUDEPICTURE
"http:///quiz/images/201302/27/5d189f7a.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201302/27/5d189f7a.png"
\
MERGEFORMATINET
B.遇湿易燃物品
INCLUDEPICTURE
"http:///quiz/images/201312/207/d80728aa.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201312/207/d80728aa.png"
\
MERGEFORMATINET
C.氧化剂
INCLUDEPICTURE
"http:///quiz/images/201508/100/fc0dc338.png"
\
MERGEFORMATINET
INCLUDEPICTURE
"http:///quiz/images/201508/100/fc0dc338.png"
\
MERGEFORMATINET
D.腐蚀品
2.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是(
)
A.蒸馏
B.升华
C.干馏
D.萃取
3.下列物质分类正确的是(
)
A.大理石、CuSO4·5H2O、氨水均为混合物
B.SO2、SiO2、CO均为酸性氧化物
C.稀豆浆、油水、氯化铁溶液均为胶体
D.HCl、纯碱、硫酸钡均为强电解质
4.下列说法正确的是(
)
A.胶体区别于其他分散系的本质依据是具有丁达尔效应
B.通电时溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动
C.纳米材料粒子直径一般在10﹣9m与10﹣7m之间,因此纳米材料属于胶体
D.在江河入海处容易形成沙洲与胶体的聚沉有关
5.下列实验过程的评价,正确的是(
)
A.验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含有Cl-
B.某溶液中先滴加稀硝酸酸化,再滴加几滴Ba(NO3)2溶液,生成白色沉淀,证明一定含有SO42-
C.某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性
D.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
6.下列物质中属于电解质,且能导电的是(
)
A.固态氯化钠
B.液态铜
C.液态氯化氢
D.熔融的氢氧化钾
7.设NA为阿伏加德罗常数的值,下列说法中正确的是(
)
A.12gC60中含有NA个电子
B.46g
NO2和N2O4的混合气体含有的原子数为3NA
C.标准状况下,22.4L
CCl4所含的分子数约为6.02×1023
D.100mL0.1mol/LCaCl2溶液中Cl-的物质的量浓度为0.01mol/L
8.下列离子方程式中,正确的是(
)
A.盐酸滴在大理石上:2H++
CO2-3=CO2↑+H2O
B.硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
C.向NaOH溶液中通入过量CO2:OH﹣+CO2=HCO3﹣
D.澄清石灰水与过量NaHCO3溶液反应:Ca2++OH﹣+
HCO3﹣=CaCO3↓+H2O
9.下列各组离子,在酸性溶液中能大量共存,且溶液为无色透明的是(
)
A.K+、MnO4﹣、S2﹣、SO42﹣
B.K+、OH﹣、Cl﹣、CO32﹣
C.Ca2+、CH3COO﹣、Al3+、SO42﹣
D.Na+、Ba2+、Cl﹣、NO3﹣
10.下列各组物质中,被氧化与被还原的物质的物质的量之比为1:2的是(
)
A.Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
B.SO2+2H2S=3S+2H2O
C.3NO2+H2O=2HNO3+NO
D.3S+6KOH=2K2S+K2SO3+3H2O
11.对标准状况下的四种气体的关系从小到大表示不正确的是(
)
①6.72L甲烷
②3.01×1023HCl分子
③13.6g
H2S
④0.2mol
NH3
A.质量:④<①<③<②
B.密度:①<④<③<②
C.体积:④<①<②<③
D.氢原子数:②<④<③<①
12.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室通过以下反应制得ClO2:
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是(
)
A.KClO3在反应中失去电子
B.ClO2是氧化产物
C.1mol
KClO3参加反应有2mol电子转移
D.H2C2O4在反应中被氧化
13.一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+H2O=RO42-+2Cl-+2H+,从而可知在RO3n-中,元素R的化合价是(
)
A.+4价
B.+5价
C.+6价
D.+7价
14.同温同压下,分别用等质量的H2、CO、CO2、NH3四种气体吹起四个气球,其中由H2吹起的是( )
A.
B.
C.
D.
15.将12mol/L的盐酸(ρ=1.15g/cm3)50mL稀释成6mol/L的盐酸(ρ=1.10g/cm3),需加水的体积为(
)
A.57.5mL
B.55mL
C.52.5mL
D.50mL
第II卷
非选择题(共55分)
二、填空题
(本题共有5个小题)
16.(每空1分,共10分)化学实验是化学学科的重要组成部分。下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置
(填代表装置图的字母,下同);分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置______,该分离方法的名称为____________。
(2)从碘水中分离出I2,选择装置___________,该分离方法的名称为___________,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在
(填“上层”或“下层”)液体中,该层溶液颜色为
。
(3)装置A中①的名称是____________,进水的方向是从
(填“上”或“下”)口进水。装置B在分液时为使液体顺利下滴,应进行的具体操作
。
17.(除特殊说明,每空1分,共7分)实验室欲用NaOH固体配制1.0
mol·L-1的NaOH溶液240
mL:
(1)配制溶液时,一般可以有以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移
⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为________________(填序号)。本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有_____________。
(2)某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.烧杯的实际质量为________
g,要完成本实验该同学应称出________
g
NaOH.
(3)使用容量瓶前必须进行的一步操作是________。(填操作名称)
(4)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________(填序号)(2分)
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥
定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
18.(每空2分,共18分)化学方程式、电离方程式、离子方程式都是非常重要的化学用语。
(1)现有以下九种物质:①铁片
②熔融NaCl
③稀氨水
④CH3COOH
⑤乙醇
⑥稀盐酸
⑦H2SO4
⑧氯化银
⑨CO2,其中属于非电解质的是_______(填写序号,下同);属于强电解质的是________;写出上述物质中的弱电解质在水中的电离方程式_________________________________。
(2)写出不能用H++OH﹣=H2O表示的两个酸碱中和反应的化学方程式(要求:反应物均不能重复且它们对应的离子方程式也不能相同)。
①___________________________________________;
②___________________________________________;
③___________________________________________。
(3)在硝酸铅[Pb(NO3)2]的稀溶液中,滴入几滴稀硫酸钠溶液生成PbSO4白色沉淀,再滴入数滴饱和醋酸钠(CH3COONa)溶液,微热并不断搅拌,沉淀慢慢溶解。以上发生的都是复分解反应,请依次写出反应过程中的离子方程式:___________________________、_____________________________________。
第二步离子反应发生的原因是______________________________。
19.(每空2分,共10分)某无色透明溶液中可能大量存在Ag+、Mg2+、Fe3+中的一种或几种离子,请回答下列问题:
(1)不做任何实验就可以肯定原溶液中不存在的离子是 。
(2)取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,说明原溶液中肯定存在的离子是 ,生成的沉淀的化学式为 。
(3)取(2)的上层清液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子有
。
(4)原溶液中可能大量存在的阴离子是 (填序号)。
A.Cl
B.CO32
C.NO3
D.OH
20.(除特殊说明,每空2分,共10分)在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中:
(1)氧化剂是(填化学式)
(1分),还原剂是(填化学式)
(1分)。上述方程式中氧化剂与还原剂的比为
(2)在该反应中,若消耗了15.8g
KMnO4,则转移了
mol
电子.
(3)用双线桥表示高锰酸钾和浓盐酸反应的电子转移方向和数目.
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(4)工业上用软锰矿(主要成分为MnO2)、氢氧化钾以及氧气为原料生产锰酸钾(化学式为K2MnO4),请写出该反应的化学方程式_____________________________。
答案与解析
选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项
B
B
D
D
A
D
B
C
D
D
C
D
A
C
C
1.【答案】B
【考查】化学实验基础。
【解析】钾和水反应的方程式为2K+2H2O=H2↑+2KOH,生成物中含有氢气,氢气易燃烧,所以应贴遇湿易燃品,故选B.
2.【答案】B
【考查】物质的分离、提纯的基本方法选择与应用。为高频考点,侧重考查学生的分析能力和实验能力,注意把握题给信息以及常见分离方法,难度不大。
【解析】“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳”,用到加热的方法,将被提纯物质气化、冷凝为固体的过程,此为升华操作;没有隔绝空气强热,不是干馏;萃取无需加热。故选B.
3.【答案】D
【考查】物质的分类基础知识。
【解析】
A.大理石主要成分是碳酸钙,为混合物;硫酸铜晶体为化合物;氨水是氨气的水溶液属于混合物,故A错误;
B.和碱反应生成盐和水的化合物为酸性氧化物,CO不能反应属于不成盐氧化物,故B错误;
C.油水属于浊液、氯化铁溶液是溶液,不属于胶体,稀豆浆属于胶体,故C错误;
D.酸碱盐都是电解质,HCl、纯碱、硫酸钡在水溶液中全部电离的化合物为强电解质,故D正确.
4.【答案】D
【考查】胶体的基本概念及性质。
【解析】
A.胶体区别于其它分散系的本质特征是胶体粒子直径在1-100nm之间,溶液的粒子直径小于1nm,浊液的子直径大于100nm;丁达尔效应是胶体的性质,故A错误;
B.通电时,若溶液中的溶质粒子是电解质,则电离出的阴阳离子分别向两极移动;若溶质是非电解质则不移向电极。胶体中的分散质粒子若带电,则向某一极移动,否则不会发生电泳现象,故B错误;
C.胶体是指分散质粒子直径在1nm~100nm之间的分散系,胶体是一种分散系,纳米材料只是一种分散质,没有形成分散系,所以不是胶体,故C错误;
D.河流中的水含有泥沙胶粒,海水中含有氯化钠、氯化钙等电解质,二者相遇是可以发生胶体凝聚,就形成三角洲,与胶体有关,故D正确.
5.【答案】A
【考查】物质的检验,这道题考查的是常见离子的检验。
【解析】B实验中还可能有SO32-,C实验证明该溶液呈酸性,D实验该固体也可能是亚硫酸盐,只有A实验评价正确。
6.【答案】D
【考查】电解质的基本概念。
【解析】
A.固态氯化钠没有自由移动的离子,不导电;但氯化钠晶体为离子化合物,在水溶液中或熔融状态下能导电,属于电解质,A错误;
B.液态铜是单质,故不属于电解质,电解质和非电解质的前提必须是化合物,故B错误;
C.液态HCl中没有自由移动的离子,不导电;但HCl溶于水在水分子的作用下能电离出氯离子和氢离子,属于电解质,故C错误;
D.熔融的氢氧化钾中有自由移动的离子,能导电,是化合物,则属于电解质,故D正确。
7.【答案】B
【考查】阿伏伽德罗常数,高考必考。
【解析】
A.C60由碳原子构成,故12g的C60中含有的碳原子的物质的量为
n=60×
=
1mol,每mol碳原子所含的电子数是6mol,故应含有6NA个电子,A错误;
B.NO2和N2O4均由NO2构成,故46g混合物中含有的NO2的物质的量n==1
mol,含有3NA个原子,故B正确;
C.标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D.1mol氯化钙中含2mol氯离子,故0.1mol/L的氯化钙溶液中氯离子的浓度为0.2mol/L,故D错误.
8.【答案】C
【考查】离子方程式的正确书写。
【解析】
A.盐酸滴在大理石上的离子反应为2H++CaCO3═
Ca2++CO2↑+H2O,A错误;
B.稀硫酸滴在铜片上,不能发生反应,故B错误;
C.向NaOH溶液中通入过量CO2的离子反应为OH-+CO2═
HCO3-,C正确;
D.澄清石灰水与过量NaHCO3溶液反应的离子反应为Ca2++2OH-+2
HCO3-═CaCO3↓+2
H2O
+CO32-,故D错误;故选C.
9.【答案】D
【考查】离子共存问题。
【解析】
A.MnO4﹣在溶液中呈紫色,且酸性条件下可与S2﹣发生氧化还原反应。不能大量共存,A错误;
B.OH﹣和CO32﹣都不能与H+大量共存,故B错误;
C.CH3COO-与H+不能大量共存,会发生离子反应生成弱电解质CH3COOH;故选D。
10.【答案】D
【考查】要求学生掌握氧化剂和还原剂的基本概念。
【解析】
A.Cu+2H2SO4
═
CuSO4+SO2↑+2H2O反应中,Cu→CuSO4,铜的化合价升高,所以铜是还原剂,还原剂被氧化;H2SO4是氧化剂,被还原;且被氧化与被还原的物质的物质的量之比为1:1,A错误;
B.在SO2+2H2S=2H2O+3S↓反应中,H2S中S元素的化合价由-2升高到0,为还原剂,被氧化;SO2中S元素的化合价由+4降低为0,为氧化剂,被还原;且被氧化与被还原的物质的物质的量之比为2:1,则S单质既是氧化产物又是还原产物,B错误;
C.NO2既被氧化又被还原,且被氧化与被还原的物质的量之比为2:1
D.3S+6KOH=2K2S+K2SO3+3H2O中硫元素化合价由0价变为-2价和+4价,氧化产物和还原产物的物质的量之比为1:2,故D正确。
11.【答案】C
【考查】物质的量的相关计算以及物质的量的桥梁作用。
【解析】
①6.72L
CH4的物质的量为0.3mol,②3.01×1023个HCl的物质的量为0.5mol,③13.6g
H2S的物质的量为0.4mol,④
NH3的物质的量为0.2mol。
A.6.72L
CH4的质量是m=nM=0.3mol×16g/mol=4.8g,3.01×1023个HCl的质量为0.5mol×36.5g/mol=18.25g,0.2mol
NH3的质量是0.2mol×17g/mol=3.4g
所以质量关系是④<①<③<②,故A正确;
B.根据阿伏伽德罗定律的推论:同温同压下,密度之比等于相对分子质量之比,所以密度关系为:①<④<③<②,故B正确;
C.3.01×1023个HCl的体积V=nVm,标况下,体积与物质的量成正比。所以体积关系为:④<①<③<②,故C错误;
D.6.72L
CH4氢原子的物质的量为1.2mol,3.01×1023个HCl氢原子的物质的量为0.5mol,13.6g
H2S氢原子的物质的量为0.8mol,0.2mol
NH3氢原子的物质的量为0.6mol,氢原子数目和氢原子的物质的量成正比,所以氢原子数关系是
②<④<③<①,故D正确.故选C.
12.【答案】D
【考查】氧化还原反应;电子的转移
【解析】
A.因反应中Cl元素的化合价由+5降低为+4价,则KClO3在反应中得到电子,故A正确;
B.Cl元素的化合价降低,被还原,对应的产物为还原产物,即ClO2是还原产物,故B正确;
C.因C元素的化合价由+3升高到+4价,则H2C2O4在反应中作还原剂,被氧化,故C正确;
D.Cl元素的化合价由+5降低为+4价,1mol
KClO3参加反应转移的电子为1mol×(5-4)=1mol,故D错误.
13.【答案】A
【考查】氧化还原反应中得失电子守恒
【解析】
在离子RO3n-中R的化合价为+(6-n),反应后变为+6价,失去6-(6-n)=n个电子。氯气中氯元素的化合价从0价降低到-1价。得到1个电子,即氯气在反应中得到2个电子,所以根据电子得失守恒可知,n=2,则RO3n-中,元素R的化合价是+(6-n)=+4价,答案选A。
14.【答案】C
【考查】阿伏加德罗定律及推论,并考查学生的计算能力
【解析】
根据n=可知,等质量的H2、CO、CO2、NH3四种气体,物质的量与其摩尔质量成反比,即摩尔质量越大,则物质的量越小;在同温同压下,体积之比等于物质的量之比;故摩尔质量越小,则物质的量越大,体积越大。四种物质中H2的摩尔质量最小,其体积最大,则选项C是由H2吹起的。
15.【答案】C
【考查】物质的量浓度;溶液的稀释
【解析】
稀释过程中溶质即氯化氢的物质的量不变,则稀释后溶液的体积为:
=0.1L=100mL,需要加入水的质量为:1.10g/mL×100mL-1.15g/mL×50mL=52.5g,水的密度约为1g/mL,则需要加水的体积为:mL=52.5mL,故选C.、
二、非选择题
16.
【答案】
(1)
D,A,蒸馏
(2)B,萃取,下层,紫色或紫红色(3)冷凝管,下,打开分液漏斗的上口活塞
【考查】物质的分离、提纯和检验
【解析】(1)第一个提纯需要蒸发,需选D装置;第二个提纯需要蒸馏,应选A装置;
(2)此时的操作叫萃取,应选B装置;CCl4的密度比水大,故碘的CCl4溶液应在液体的下层,其颜色为紫色或紫红色。
(3)装置A中①的名称是冷凝管,为使冷凝效果最好,从下口进水,上口出水;为使液体顺利下滴,对B装置应先打开分液漏斗的上口活塞。
17.【答案】
(1)②①③⑧⑤⑥⑦④
250
mL容量瓶
(2)27.4
10.0
(3)查漏
(4)④⑤
【考查】化学实验基础操作;一定物质的量浓度的溶液的配制
【解析】
(1)由溶液的配制原则,该实验的操作顺序为:②①③⑧⑤⑥⑦④
,所用的仪器除题给的外,还需要容量瓶,因没有240mL的容量瓶,所配溶液要250mL,故需要250
mL容量瓶。
(2)图示看到烧杯质量为(20+10-2.6)=27.4g;需要的氢氧化钠质量为1×0.25×40=10.0
g
(3)使用容量瓶之前实现要检查其是否漏水,即查漏
(4)
①②的溶质减少、⑥的溶剂增多,这些操作都会使浓度偏低;③对实验无影响;④⑤的溶剂偏少,浓度偏高。
18.【答案】
(1)⑤⑨;
②⑦⑧;CH3COOH
CH3COO-+H+;
(2)
Ba(OH)2+H2SO4=BaSO4↓+2H2O;或CH3COOH+NaOH=CH3COONa+H2O;或NH3
H2O+HCl=NH4Cl+H2O;(答案合理即可)
(3)
Pb2+
+
SO42-
=
PbSO4↓;PbSO4+2CH3COO-=(CH3COO)2Pb+
SO42-;生成了弱电解质.
【考查】电解质和非电解质的概念;电离方程式以及离子方程式的书写;离子反应发生的条件
【解析】
(1)①铁片是单质,即不是电解质也不是非电解质;②熔融NaCl是强电解质;③稀氨水是混合物,即不是电解质也不是非电解质;④CH3COOH是电解质,在溶液中部分电离属于弱电解质;⑤酒精是非电解质;⑥稀盐酸是氯化氢的水溶液是电解质的水溶液;
⑦H2SO4是电解质,水溶液中全部电离属于强电解质;⑧氯化银是电解质熔融中完全电离属于强电解质;⑨CO2是非电解质,综上所述分析判断:属于非电解质的是⑤⑨;属于强电解质的是②⑦⑧;弱电解质在水溶液中的电离方程式:CH3COOH
CH3COO-+H+;
(2)不能用H++OH-=H2O表示的三个酸碱中和反应的化学方程式可以为:
①稀硫酸与氢氧化钡溶液反应生成硫酸钡沉淀和水,反应的化学方程式为:
Ba(OH)2+H2SO4=BaSO4↓+2H2O;
②乙酸具有酸的通性,可以和烧碱氢氧化钠发生中和反应,即:CH3COOH+NaOH=CH3COONa+H2O;
③氨水和盐酸反应生成氯化铵和水,反应方程式为:NH3
H2O+HCl=NH4Cl+H2O,
故答案为:NH3
H2O+HCl=NH4Cl+H2O;(答案合理即可)
(3)题中已知反应都是复分解反应,而此类离子反应的发生条件为①有难溶物生成,②有挥发性物质生成,③有弱电解质生成。第一步离子反应已给出了PbSO4,铅离子和硫酸根离子之间不共存,二者反应生成白色沉淀,则离子方程式为:Pb2++SO42-=PbSO4↓。硫酸铅是强电解质,向其中加入饱和醋酸钠溶液会生成弱电解质醋酸铅,即PbSO4+2CH3COO-=(CH3COO)2Pb+
SO42-,产物中无难溶物、无挥发性物质,则推测(CH3COO)2Pb一定为弱电解质。
19.【答案】
(1)Fe3+
(2)Ag+
;Ag++
Cl-
=
AgCl
↓ (3)Mg2+
(4)C
【考查】离子共存
【解析】
(1)Fe3+有颜色,一定不能存在
(2)此时发生的反应是Ag++
Cl-
=
AgCl
↓,故原溶液一定有Ag+;
(3)该实验生成的白色沉淀的氢氧化镁,原溶液一定有Mg2+;
(4)题给的四种离子只有NO3-可以和判断出的三种离子共存,故选项为C。
20.【答案】
(1)氧化剂是KMnO4,还原剂HCl;
(2)在该反应中,若消耗了15.8g
KMnO4,则转移了0.5mol
电子;
(3)用双线桥表示高锰酸钾和浓盐酸反应的电子转移方向和数目.
(4)2MnO2+4KOH
+O2
2K2MnO4+2H2O
【考查】氧化还原反应;利用氧化还原反应进行陌生方程式的书写,为高频考点
【解析】
(1)2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价降低,KMnO4为氧化剂,Cl元素的化合价升高,HCl为还原剂,该反应转移10e﹣.
(2)根据Mn元素化合价由+7降低到+2,所以若消耗了15.8g
KMnO4,则转移了×(7﹣2)=0.5mol,故答案为:0.5;
(3)双线桥标出电子的转移方向和数目为
(4)2MnO2+4KOH
+O2
2K2MnO4+2H2O
12g
60×12g/mol
同课章节目录
