专题3.1.1弱电解质的电离(课件)-2017-2018学年高二化学同步备课资源整合(选修4)
文档属性
| 名称 | 专题3.1.1弱电解质的电离(课件)-2017-2018学年高二化学同步备课资源整合(选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 498.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-06 16:46:32 | ||
图片预览







文档简介
课件20张PPT。弱电解质的电离(第一课时)
电解质:非电解质:②⑤⑥⑦⑧⑩④⑨在水溶液中或熔融状态下能导电的化合物。溶于水和熔融状态都不能导电的化合物。① 电解质、非电解质的前提必须为化合物
故单质、混合物既不是电解质也不是非电解质
② 是否为电解质与其溶解度无必然联系
③ 电解质必须本身能电离出离子
④ 电解质的导电:
导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
⑤ 常见电解质:酸、碱、盐、水、活泼金属氧化物
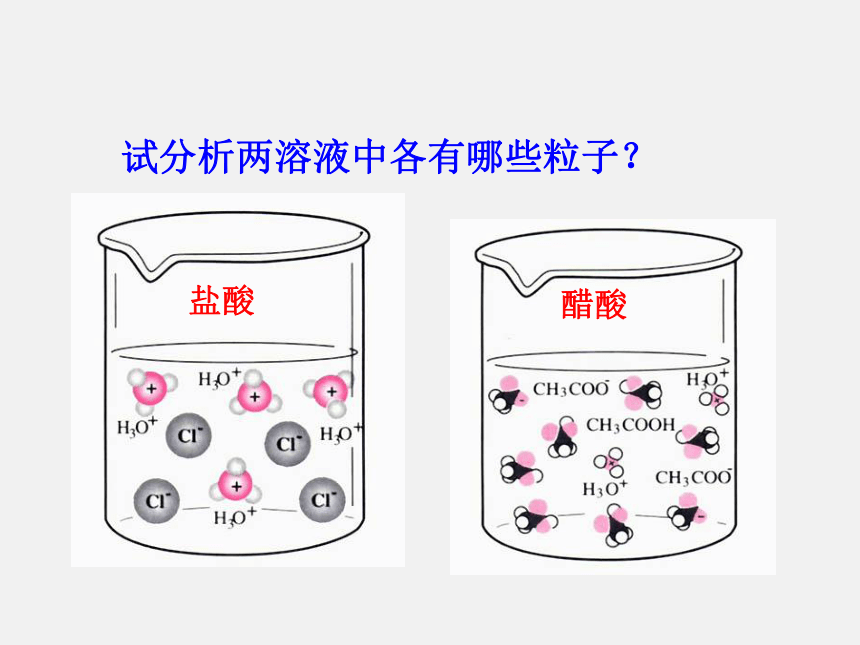
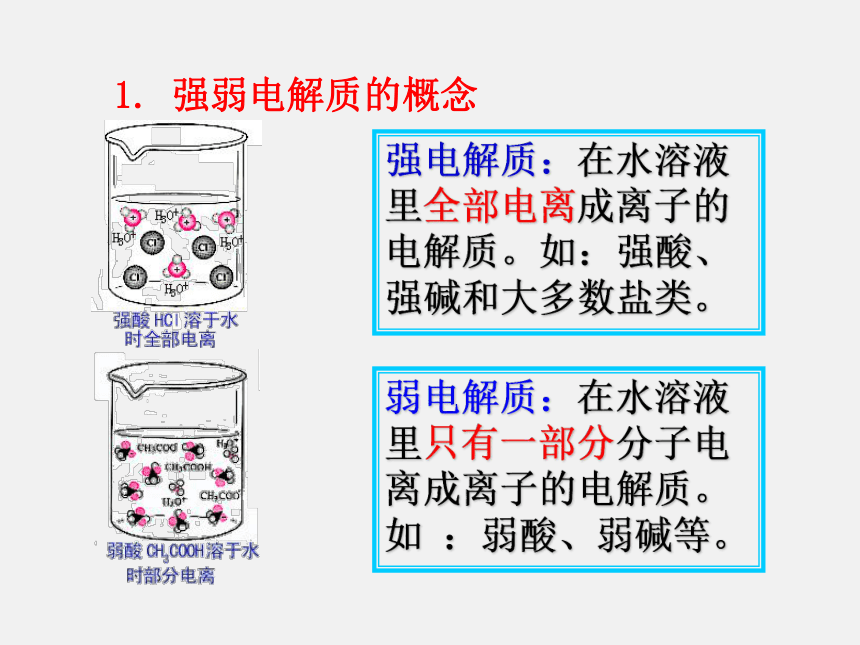
常见非电解质:NH3、CO2、酒精、蔗糖等一、强、弱电解质【学与问】酸、碱、盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否相同呢?课本P40【实验3-1】产生气泡的速度较快产生气泡的速度较慢0>0为什么? H+的浓度不同。盐酸中HCl完全电离而醋酸只是部分发生电离电解质有强弱之分试分析两溶液中各有哪些粒子?盐酸醋酸强电解质:在水溶液里全部电离成离子的电解质。如:强酸、强碱和大多数盐类。 弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如 :弱酸、弱碱等。1. 强弱电解质的概念常见的弱电解质:
①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、 CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。
③水是极弱的电解质。 常见的强电解质:
①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。 强电解质、弱电解质与其溶解性无关。如:某些难溶或微溶于水的盐,由于其溶解度很小,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。 所以,实际上在醋酸的水溶液中存在下面的可逆过程:为什么醋酸溶于水时只有部分分子电离成H+和CH3COO-呢?电离平衡:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。 电离平衡 特点:动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子 变 条件改变时,电离平衡发生移动逆 弱电解质的电离是一个可逆过程(1)与化学平衡一样,电离平衡也是动态平衡。(2)化学平衡原理也适用于电离平衡,当浓度等条件改变时,弱电解质的电离平衡也会发生移动。 弱电解质的电离 思考与讨论: 1)开始时,V电离 和 V分子化怎样变化?画出弱电解质电离的V-t图像 2)当V电离 = V结合时,可逆过程达到一种什么样的
状态?弱电解质电离的V-t图像V电离V结合0t1t2V电离= V结合电离平衡状态tV写出醋酸和H2CO3电离方程式H2CO3 H++HCO3-,HCO3- H++CO32-① 先判断强、弱电解质,决定符号,弱电解质用
“ ”,强电解质用“=”③ 多元弱碱电离复杂,因此书写电离方程式
时一步写出,如Fe(OH)3 Fe3++3OH-② 多元弱酸分步电离CH3COOH+H2O CH3COO-+H3O+或CH3COOH CH3COO-+H+写出H2CO3 H++HCO3-平衡常数的表达式定义:在一定条件下,弱电解质的电离达到平衡时,溶液中电离出来的各种离子浓度的乘积跟溶液中未电离的分子浓度之比值是个常数,这个常数称为电离平衡常数,简称电离常数。表达式:Ⅰ、弱电解质的电离常数表达式中的。c(A 十)、 c(B-) 和c(AB) 均为达到电离平衡后各粒子在溶液中的浓度值。Ⅱ、当温度一定时,其电离常数是定值。Ⅲ、电离常数的大小反映强弱电解质的电离程度。K值越大,弱电解质越易电离,其对应的弱酸(弱碱)越强。Ⅳ、多元弱酸是分步电离的,一级电离常数程度最大,一般有K1 》K2 》K3。V、弱酸的电离常数用Ka表示,弱碱的电离常数用Kb表示。17CD18DBD混合物AD1920
故单质、混合物既不是电解质也不是非电解质
② 是否为电解质与其溶解度无必然联系
③ 电解质必须本身能电离出离子
④ 电解质的导电:
导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
⑤ 常见电解质:酸、碱、盐、水、活泼金属氧化物
常见非电解质:NH3、CO2、酒精、蔗糖等一、强、弱电解质【学与问】酸、碱、盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否相同呢?课本P40【实验3-1】产生气泡的速度较快产生气泡的速度较慢0>0为什么? H+的浓度不同。盐酸中HCl完全电离而醋酸只是部分发生电离电解质有强弱之分试分析两溶液中各有哪些粒子?盐酸醋酸强电解质:在水溶液里全部电离成离子的电解质。如:强酸、强碱和大多数盐类。 弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如 :弱酸、弱碱等。1. 强弱电解质的概念常见的弱电解质:
①弱酸:HF、HClO、H2S、H2SO3、H3PO4、H2CO3 、 CH3COOH等。
②弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等。
③水是极弱的电解质。 常见的强电解质:
①强酸:HCl、HBr、HI、H2SO4、HNO3、HClO4等。
②强碱:NaOH、KOH、Ba(OH)2、Ca(OH)2等。
③绝大多数盐:如NaCl、(NH4)2SO4、BaSO4等。 强电解质、弱电解质与其溶解性无关。如:某些难溶或微溶于水的盐,由于其溶解度很小,但是其溶于水的部分,却是完全电离的,所以它们仍然属于强电解质,例如:CaCO3、BaSO4等。 所以,实际上在醋酸的水溶液中存在下面的可逆过程:为什么醋酸溶于水时只有部分分子电离成H+和CH3COO-呢?电离平衡:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。 电离平衡 特点:动 电离平衡是一种动态平衡 定 条件不变,溶液中各分子、离子 的浓度不变,溶液里既有离子又有分子 变 条件改变时,电离平衡发生移动逆 弱电解质的电离是一个可逆过程(1)与化学平衡一样,电离平衡也是动态平衡。(2)化学平衡原理也适用于电离平衡,当浓度等条件改变时,弱电解质的电离平衡也会发生移动。 弱电解质的电离 思考与讨论: 1)开始时,V电离 和 V分子化怎样变化?画出弱电解质电离的V-t图像 2)当V电离 = V结合时,可逆过程达到一种什么样的
状态?弱电解质电离的V-t图像V电离V结合0t1t2V电离= V结合电离平衡状态tV写出醋酸和H2CO3电离方程式H2CO3 H++HCO3-,HCO3- H++CO32-① 先判断强、弱电解质,决定符号,弱电解质用
“ ”,强电解质用“=”③ 多元弱碱电离复杂,因此书写电离方程式
时一步写出,如Fe(OH)3 Fe3++3OH-② 多元弱酸分步电离CH3COOH+H2O CH3COO-+H3O+或CH3COOH CH3COO-+H+写出H2CO3 H++HCO3-平衡常数的表达式定义:在一定条件下,弱电解质的电离达到平衡时,溶液中电离出来的各种离子浓度的乘积跟溶液中未电离的分子浓度之比值是个常数,这个常数称为电离平衡常数,简称电离常数。表达式:Ⅰ、弱电解质的电离常数表达式中的。c(A 十)、 c(B-) 和c(AB) 均为达到电离平衡后各粒子在溶液中的浓度值。Ⅱ、当温度一定时,其电离常数是定值。Ⅲ、电离常数的大小反映强弱电解质的电离程度。K值越大,弱电解质越易电离,其对应的弱酸(弱碱)越强。Ⅳ、多元弱酸是分步电离的,一级电离常数程度最大,一般有K1 》K2 》K3。V、弱酸的电离常数用Ka表示,弱碱的电离常数用Kb表示。17CD18DBD混合物AD1920
