专题3.1.2影响弱电解质电离的因素(课件)-2017-2018学年高二化学同步备课资源整合(选修4)
文档属性
| 名称 | 专题3.1.2影响弱电解质电离的因素(课件)-2017-2018学年高二化学同步备课资源整合(选修4) |

|
|
| 格式 | zip | ||
| 文件大小 | 252.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-06 00:00:00 | ||
图片预览





文档简介
课件13张PPT。弱电解质的电离影响弱电解质电离的因素 练习:下列物质属于强电解质的是____, 属于弱电解质的是______。
a.HCl b. NaCl c.CH3COOH d. BaSO4
e. NaOH f. Cu(OH)2
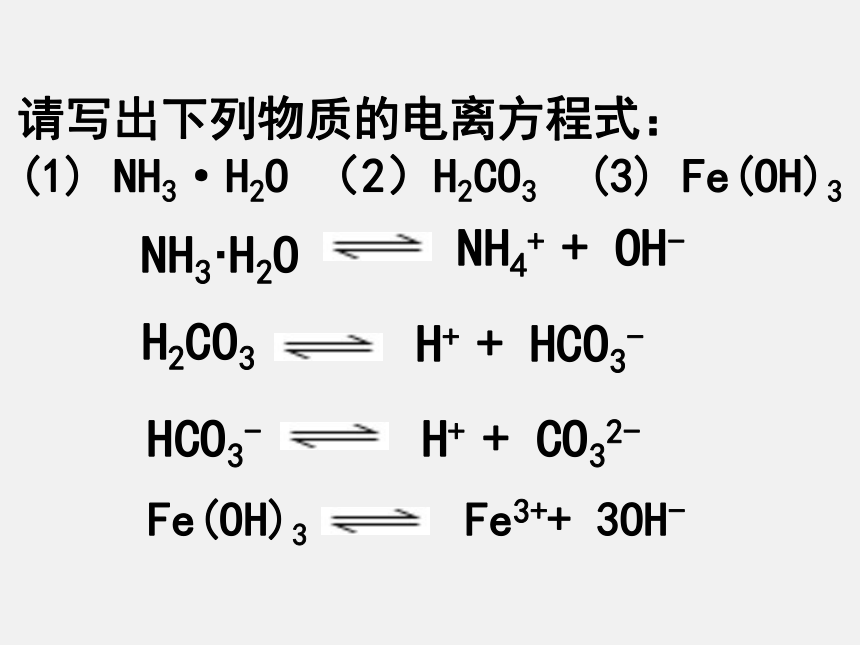
g. NH3.H2O h. H2Oc f g ha b d e Fe(OH)3 Fe3++ 3OH-请写出下列物质的电离方程式:
NH3·H2O (2)H2CO3 (3) Fe(OH)31、勒夏特列原理:___________________________________。
2、影响化学平衡移动的因素:_____________3、弱电解质电离平衡的特点是__________________
可逆反应达到平衡,改变某一因素平衡向削弱这一因素的方向移动温度、压强、浓度逆、动、等、定、变从表格中你能够得出影响弱电解质电离的因素?内因:弱电解质本身的性质 弱电解质的电离过程都是吸热过程,所以:
升高温度,平衡正向移动 ,并且电离程度增大。影响电离平衡的因素①温度外部因素:注意:弱电解质的电离过程是吸热过程,不是吸热反应②浓度: 加水稀释,电离平衡正向移动,电离程度增大,增加弱电解质浓度,电离平衡正向移动,电离程度减小,③同离子效应 加入与弱电解质组成相同的离子时,电离平衡逆向移动。④化学反应 加入能与弱电解质电离产生的离子反应的物质时,电离平衡正向移动 在CH3COOH溶液中分别加入下列物质,对CH3COOH的电离平衡各有什么影响? CH3COOH CH3COO—+H+逆逆正正正完成表格:正向增大增大减小逆向增大减小增大正向减小增大减小逆向减小增大增大正向增大增大增大正向减小减小减小增大减小增大增大减小减小 0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动B1、等体积、等浓度的盐酸和醋酸A>BA>BA=BA=B与C(H+)的
大小有关与n(H+)的
多少有关与n(H+)的
多少有关2、C(H+)相等的、体积相同的盐酸(A)与醋酸(B)分别与锌反应 ABA=BA同时加入足量的锌,
则开始反应时速率 ,
反应过程中的平均速率 ,
反应完全后生成H2的质量 。 (用<、=、> 表示)a=b=ca=b<ca=b<c
a.HCl b. NaCl c.CH3COOH d. BaSO4
e. NaOH f. Cu(OH)2
g. NH3.H2O h. H2Oc f g ha b d e Fe(OH)3 Fe3++ 3OH-请写出下列物质的电离方程式:
NH3·H2O (2)H2CO3 (3) Fe(OH)31、勒夏特列原理:___________________________________。
2、影响化学平衡移动的因素:_____________3、弱电解质电离平衡的特点是__________________
可逆反应达到平衡,改变某一因素平衡向削弱这一因素的方向移动温度、压强、浓度逆、动、等、定、变从表格中你能够得出影响弱电解质电离的因素?内因:弱电解质本身的性质 弱电解质的电离过程都是吸热过程,所以:
升高温度,平衡正向移动 ,并且电离程度增大。影响电离平衡的因素①温度外部因素:注意:弱电解质的电离过程是吸热过程,不是吸热反应②浓度: 加水稀释,电离平衡正向移动,电离程度增大,增加弱电解质浓度,电离平衡正向移动,电离程度减小,③同离子效应 加入与弱电解质组成相同的离子时,电离平衡逆向移动。④化学反应 加入能与弱电解质电离产生的离子反应的物质时,电离平衡正向移动 在CH3COOH溶液中分别加入下列物质,对CH3COOH的电离平衡各有什么影响? CH3COOH CH3COO—+H+逆逆正正正完成表格:正向增大增大减小逆向增大减小增大正向减小增大减小逆向减小增大增大正向增大增大增大正向减小减小减小增大减小增大增大减小减小 0.1mol/L的CH3COOH溶液中
CH3COOH CH3COO- + H+对于该平衡,下列叙述正确的是( )
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动B1、等体积、等浓度的盐酸和醋酸A>BA>BA=BA=B与C(H+)的
大小有关与n(H+)的
多少有关与n(H+)的
多少有关2、C(H+)相等的、体积相同的盐酸(A)与醋酸(B)分别与锌反应 A
则开始反应时速率 ,
反应过程中的平均速率 ,
反应完全后生成H2的质量 。 (用<、=、> 表示)a=b=ca=b<ca=b<c
