3-2-1钠的重要化合物(课件)-2017-2018学年高一化学同步备课资源整合(必修1)
文档属性
| 名称 | 3-2-1钠的重要化合物(课件)-2017-2018学年高一化学同步备课资源整合(必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-06 16:53:03 | ||
图片预览










文档简介
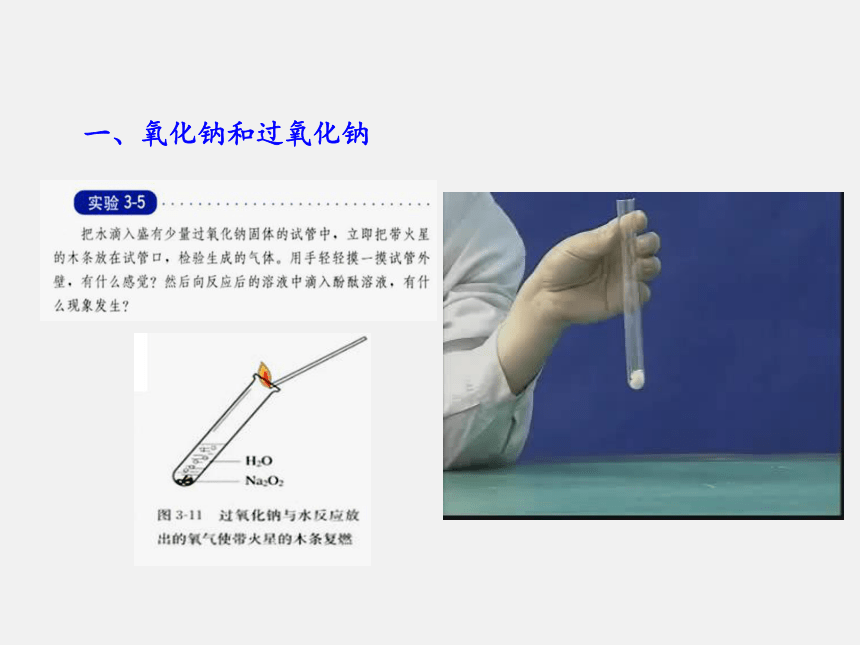
课件57张PPT。金属及其化合物§3-2-1 钠的重要化合物我们在化学课和日常生活中接触过很多含钠的化合物,如NaCl、NaOH、Na2O以及家里的厨房中使用的纯碱和小苏打等。你知道它们有哪些性质和用途吗?情景导入1.了解氧化钠、过氧化钠的主要性质和用途。
2.了解碳酸钠、碳酸氢钠的主要性质和用途。
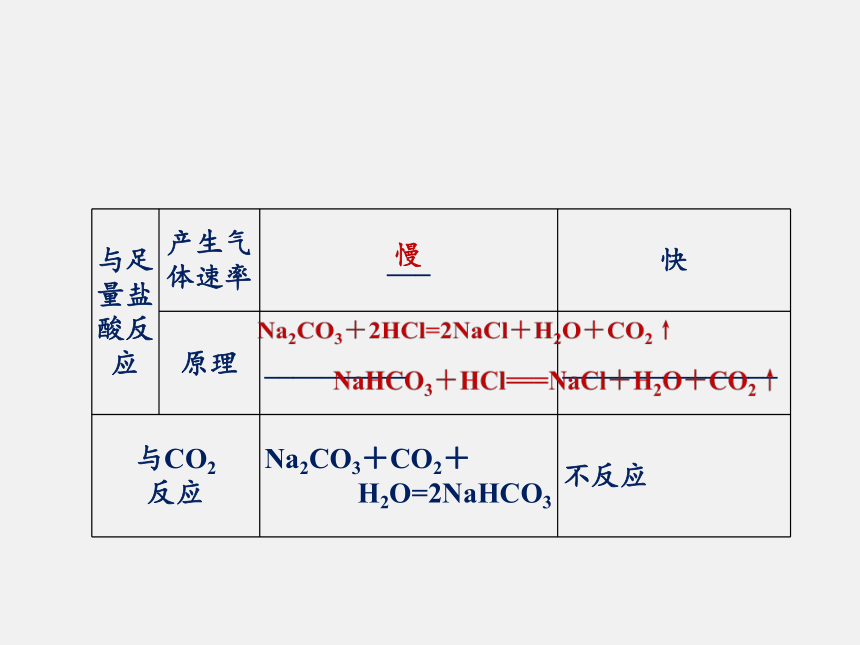
3.了解焰色反应的概念及操作。教学目标一、氧化钠和过氧化钠基础梳理Na2O-2Na2O2-1一、氧化钠和过氧化钠一、氧化钠和过氧化钠2Na2O2+2CO2=2Na2CO3+O2 较不稳定较稳定氧化剂、供氧剂、漂白剂一、氧化钠和过氧化钠二、碳酸钠和碳酸氢钠二、碳酸钠和碳酸氢钠二、碳酸钠和碳酸氢钠二、碳酸钠和碳酸氢钠Na2CO3NaHCO3白白纯碱、苏打小苏打易溶易溶慢碱碱1.定义
很多____________________在灼烧时都会使火焰呈现特殊的颜色。金属或它们的化合物三、焰色反应2.操作盐酸原焰颜色相同火焰盐酸无色3.几种金属的焰色
钠:___色,钾:___色(观察时要透过__________)黄紫蓝色钴玻璃一、Na2O2与CO2、H2O反应的有关量的关系拓展延伸(1)物质的量的关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O(g)与放出O2的物质的量之比均为2∶1,即气体减小的体积等于生成O2的体积。(2)固体质量关系
相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO=Na2CO3、Na2O2+H2=2NaOH(实际上两反应不能发生)。(3)先后顺序关系
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,解决问题时可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应(实际情况复杂得多)。(4)电子转移关系
不论是与CO2还是与H2O反应,CO2与H2O均既不是氧化剂也不是还原剂,反应的实质都是Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。例1.下列关于Na2O、Na2O2的比较,正确的是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2在和CO2的反应中,既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子典型例题分析【解析】A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不是碱性氧化物;B项,Na2O2是淡黄色固体;C项,Na2O2与CO2反应时电子转移关系:2Na2O2+2CO2=2Na2CO3得到2×e-+O2失去2×e-,Na2O2中-1价的O变成了-2价的O和零价的O;D项,Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和零价的O,故1 mol Na2O2转移1 mol电子。
【答案】C过氧化钠性质的特殊性:
(1)在氧化钠中含有Na+和O2-,在过氧化钠中含有Na+和O22-,所以二者中阳离子和阴离子的个数比都是2∶1。
(2)过氧化钠和其他物质反应时不一定有氧气产生,如具有强还原性的SO2,能被Na2O2氧化成Na2SO4:
SO2+Na2O2=Na2SO4。
(3)过氧化钠虽然能够和盐酸反应生成盐和水,但同时还有氧气产生,所以它不属于碱性氧化物。名师点睛拓展延伸二、 Na2CO3与NaHCO3的鉴别、除杂与转化1.鉴别1.鉴别2.除杂(括号内为杂质)3.转化典型例题分析例2.下列说法不正确的是( )
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3比NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,得到的CO2物质的量比为2∶1【解析】 根据碳原子守恒,等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成CO2的物质的量比为1∶1。
【答案】D1.焰色反应的含义
多种金属及其化合物在灼烧时使火焰呈现特殊的颜色,这种现象在化学上叫焰色反应。拓展延伸三、焰色反应及实验操作常见金属或金属化合物焰色反应的颜色如下:2.焰色反应的操作方法
若以铂丝作为灼烧物质的载体,操作方法如下。
①洗——用稀盐酸刷洗铂丝。目的是使铂丝上的高沸点杂质转化为沸点相对较低的氯化物。②烧——将用盐酸洗涤过的铂丝在火焰上灼烧。目的是除去铂丝上的杂质。注意:a.所用的火焰是无色或浅色的;b.要一直烧至火焰恢复到原来的无色或浅色为止。
③蘸——用灼烧合格的铂丝蘸取被灼烧的物质。
④烧——将沾在铂丝上的物质在火焰上灼烧。【温馨提示】
(1)在观察钾的焰色反应的焰色时,要透过蓝色的钴玻璃片观察,其主要原因是钾及钾的化合物中可能混有钠元素,钠的黄色火焰能掩盖钾的紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾或钾的化合物中混有钠元素所造成的干扰。(2)①焰色反应的元素对象是金属元素,物质对象是单质或化合物;
②焰色反应并不是化学反应,但钠、钾等金属单质在燃烧过程中既有化学反应又有焰色反应;
③不是所有金属元素都能发生焰色反应;
④焰色反应常用于对金属元素(主要是钠和钾)进行鉴别或鉴定。典型例题分析例3.鉴别下列物质只能采用焰色反应的是( )
A.KClO3、NaCl B.KCl、Na2CO3
C.NaCl、MgCl2 D.NaCl、KCl【解析】A选项可加MnO2加热来鉴别;B选项可根据Ca2++CO=CaCO3↓来鉴别,C选项可选用NaOH来鉴别;而D项只能采用焰色反应来鉴别。
【答案】 D热点实验 物质稳定性实验探究
【探究举例】“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。请观察下列实验装置,分析实验原理,并回答下列问题:科学探究(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有____________________________。
(2)整个实验结束时,在操作上需要特别注意的问题是_______________________。
(3)通过该实验可以得出的结论是(结合化学方程式来说明)____________________。【解析】(1)气体受热膨胀,所以一开始加热,A、B烧杯中均有气泡逸出,加热一段时间后可看到小试管内有水珠,说明NaHCO3分解,同时烧杯B溶液变浑浊,而烧杯A中无明显变化。
(2)当实验结束时应先将导管从澄清石灰水中取出,防止倒吸。
(3)从图示可以看出NaHCO3受热分解了,而Na2CO3受热没有分解,说明Na2CO3比NaHCO3稳定。【答案】 (1)开始两烧杯中均有气泡冒出,加热一段时间后,大试管中无明显变化,小试管内壁上有水珠出现;烧杯A中无明显变化,烧杯B中出现白色浑浊
(2)先把导气管从烧杯中取出,再移去酒精灯
(3)NaHCO3的热稳定性不如Na2CO3,2NaHCO3Na2CO3+CO2↑+H2O课堂总结1.氧化钠和过氧化钠的性质差异
2.碳酸钠和碳酸氢钠的性质差异
3.焰色反应的原理与操作用点课堂训练1.下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物【解析】 Na2O2和Na2O都能与H2O和CO2反应,共同的产物分别是NaOH、Na2CO3,不同之处是Na2O2与H2O和CO2的产物中还有O2。A项,二者长期置于空气中,都最终生成Na2CO3,A项正确;B项,Na2O2与H2O或CO2的反应不是化合反应;C项,Na2O2和Na2O与水反应都有NaOH生成,正确;D项,Na2O2是强氧化剂,Na2O没有强氧化性,属于碱性氧化物,正确。
【答案】B2.经测定某固体混合物中,只含钠和氧两种元素,将其放入足量水中,可产生两种气体,则该混合物( )
A.一定没有钠单质
B.一定有氧化钠
C.含有两种或两种以上物质
D.只含有两种物质【解析】固体物质只含钠和氧两种元素,与水反应产生两种气体,两种气体分别为H2和O2。固体物质中一定有钠和过氧化钠,可能有Na2O,也可能没有Na2O。
【答案】 C3.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸
C.分别将它们配制成溶液,再加入CaCl2溶液
D.分别加热,再用石灰水检验是否有CO2产生【解析】A项中发生的反应分别为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项Na2CO3溶液中滴加盐酸,开始无现象,后来产生气体,而NaHCO3溶液中一滴入盐酸立即产生气体,现象不同;C项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应,可以鉴别;D项将固体物质分别加热后,只发生反应:2NaHCO3 Na2CO3+H2O+CO2↑,产生的CO2能使澄清石灰水变浑浊,故选A。
【答案】A4.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体
B.加入氢氧化钡溶液
C.加入澄清石灰水
D.加入稀盐酸【解析】除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成分。溶液中可用这样的方法:Na2CO3+CO2+H2O=2NaHCO3。
【答案】 A5.北京奥运会开幕式向全世界兑现了“科技奥运”的承诺,其中焰火打出的五环标志如图所示。下列有关说法正确的是( )A.焰火是碱金属等发生燃烧的现象
B.焰火是碱金属等发生焰色反应
C.焰火的火树银花的效果是金属单质在空气中燃烧产生的
D.某样品的焰色反应呈黄色,说明它只含钠元素,不含其他金属元素【解析】北京奥运会开幕式上的焰火是碱金属等发生焰色反应形成的,它不属于化学变化。钠的焰色会掩盖钾的焰色,所以,某样品的焰色呈黄色,说明它一定含有钠元素,可能还含有钾元素等。
【答案】B6.钠在空气中燃烧的有关叙述正确的是( )
A.钠在空气中燃烧时火焰呈淡蓝色
B.钠在空气中燃烧时生成的是白色的氧化钠
C.钠在空气中燃烧时生成的是淡黄色的过氧化钠
D.钠在燃烧时生成的过氧化钠中氧元素的化合价为-2价【解析】 钠在空气中燃烧生成的是淡黄色的过氧化钠,由于钠的焰色反应呈黄色,所以燃烧时火焰呈黄色。
【答案】 C7.关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3B.在水中的溶解性:NaHCO3C.与盐酸反应的速率:NaHCO3D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同8.下列物质必须隔绝空气保存的是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3
⑥NaCl
A.①② B.②③④⑤
C.①②③④ D.①②③④⑤【解析】 Na与空气中的水、O2反应,Na2O和Na2O2均与空气中的CO2、H2O反应,NaOH与空气中的CO2反应,都必须隔绝空气保存。
【答案】 C
2.了解碳酸钠、碳酸氢钠的主要性质和用途。
3.了解焰色反应的概念及操作。教学目标一、氧化钠和过氧化钠基础梳理Na2O-2Na2O2-1一、氧化钠和过氧化钠一、氧化钠和过氧化钠2Na2O2+2CO2=2Na2CO3+O2 较不稳定较稳定氧化剂、供氧剂、漂白剂一、氧化钠和过氧化钠二、碳酸钠和碳酸氢钠二、碳酸钠和碳酸氢钠二、碳酸钠和碳酸氢钠二、碳酸钠和碳酸氢钠Na2CO3NaHCO3白白纯碱、苏打小苏打易溶易溶慢碱碱1.定义
很多____________________在灼烧时都会使火焰呈现特殊的颜色。金属或它们的化合物三、焰色反应2.操作盐酸原焰颜色相同火焰盐酸无色3.几种金属的焰色
钠:___色,钾:___色(观察时要透过__________)黄紫蓝色钴玻璃一、Na2O2与CO2、H2O反应的有关量的关系拓展延伸(1)物质的量的关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O(g)与放出O2的物质的量之比均为2∶1,即气体减小的体积等于生成O2的体积。(2)固体质量关系
相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO=Na2CO3、Na2O2+H2=2NaOH(实际上两反应不能发生)。(3)先后顺序关系
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,解决问题时可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应(实际情况复杂得多)。(4)电子转移关系
不论是与CO2还是与H2O反应,CO2与H2O均既不是氧化剂也不是还原剂,反应的实质都是Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。例1.下列关于Na2O、Na2O2的比较,正确的是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2在和CO2的反应中,既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子典型例题分析【解析】A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不是碱性氧化物;B项,Na2O2是淡黄色固体;C项,Na2O2与CO2反应时电子转移关系:2Na2O2+2CO2=2Na2CO3得到2×e-+O2失去2×e-,Na2O2中-1价的O变成了-2价的O和零价的O;D项,Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和零价的O,故1 mol Na2O2转移1 mol电子。
【答案】C过氧化钠性质的特殊性:
(1)在氧化钠中含有Na+和O2-,在过氧化钠中含有Na+和O22-,所以二者中阳离子和阴离子的个数比都是2∶1。
(2)过氧化钠和其他物质反应时不一定有氧气产生,如具有强还原性的SO2,能被Na2O2氧化成Na2SO4:
SO2+Na2O2=Na2SO4。
(3)过氧化钠虽然能够和盐酸反应生成盐和水,但同时还有氧气产生,所以它不属于碱性氧化物。名师点睛拓展延伸二、 Na2CO3与NaHCO3的鉴别、除杂与转化1.鉴别1.鉴别2.除杂(括号内为杂质)3.转化典型例题分析例2.下列说法不正确的是( )
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3比NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,得到的CO2物质的量比为2∶1【解析】 根据碳原子守恒,等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成CO2的物质的量比为1∶1。
【答案】D1.焰色反应的含义
多种金属及其化合物在灼烧时使火焰呈现特殊的颜色,这种现象在化学上叫焰色反应。拓展延伸三、焰色反应及实验操作常见金属或金属化合物焰色反应的颜色如下:2.焰色反应的操作方法
若以铂丝作为灼烧物质的载体,操作方法如下。
①洗——用稀盐酸刷洗铂丝。目的是使铂丝上的高沸点杂质转化为沸点相对较低的氯化物。②烧——将用盐酸洗涤过的铂丝在火焰上灼烧。目的是除去铂丝上的杂质。注意:a.所用的火焰是无色或浅色的;b.要一直烧至火焰恢复到原来的无色或浅色为止。
③蘸——用灼烧合格的铂丝蘸取被灼烧的物质。
④烧——将沾在铂丝上的物质在火焰上灼烧。【温馨提示】
(1)在观察钾的焰色反应的焰色时,要透过蓝色的钴玻璃片观察,其主要原因是钾及钾的化合物中可能混有钠元素,钠的黄色火焰能掩盖钾的紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾或钾的化合物中混有钠元素所造成的干扰。(2)①焰色反应的元素对象是金属元素,物质对象是单质或化合物;
②焰色反应并不是化学反应,但钠、钾等金属单质在燃烧过程中既有化学反应又有焰色反应;
③不是所有金属元素都能发生焰色反应;
④焰色反应常用于对金属元素(主要是钠和钾)进行鉴别或鉴定。典型例题分析例3.鉴别下列物质只能采用焰色反应的是( )
A.KClO3、NaCl B.KCl、Na2CO3
C.NaCl、MgCl2 D.NaCl、KCl【解析】A选项可加MnO2加热来鉴别;B选项可根据Ca2++CO=CaCO3↓来鉴别,C选项可选用NaOH来鉴别;而D项只能采用焰色反应来鉴别。
【答案】 D热点实验 物质稳定性实验探究
【探究举例】“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。请观察下列实验装置,分析实验原理,并回答下列问题:科学探究(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有____________________________。
(2)整个实验结束时,在操作上需要特别注意的问题是_______________________。
(3)通过该实验可以得出的结论是(结合化学方程式来说明)____________________。【解析】(1)气体受热膨胀,所以一开始加热,A、B烧杯中均有气泡逸出,加热一段时间后可看到小试管内有水珠,说明NaHCO3分解,同时烧杯B溶液变浑浊,而烧杯A中无明显变化。
(2)当实验结束时应先将导管从澄清石灰水中取出,防止倒吸。
(3)从图示可以看出NaHCO3受热分解了,而Na2CO3受热没有分解,说明Na2CO3比NaHCO3稳定。【答案】 (1)开始两烧杯中均有气泡冒出,加热一段时间后,大试管中无明显变化,小试管内壁上有水珠出现;烧杯A中无明显变化,烧杯B中出现白色浑浊
(2)先把导气管从烧杯中取出,再移去酒精灯
(3)NaHCO3的热稳定性不如Na2CO3,2NaHCO3Na2CO3+CO2↑+H2O课堂总结1.氧化钠和过氧化钠的性质差异
2.碳酸钠和碳酸氢钠的性质差异
3.焰色反应的原理与操作用点课堂训练1.下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物【解析】 Na2O2和Na2O都能与H2O和CO2反应,共同的产物分别是NaOH、Na2CO3,不同之处是Na2O2与H2O和CO2的产物中还有O2。A项,二者长期置于空气中,都最终生成Na2CO3,A项正确;B项,Na2O2与H2O或CO2的反应不是化合反应;C项,Na2O2和Na2O与水反应都有NaOH生成,正确;D项,Na2O2是强氧化剂,Na2O没有强氧化性,属于碱性氧化物,正确。
【答案】B2.经测定某固体混合物中,只含钠和氧两种元素,将其放入足量水中,可产生两种气体,则该混合物( )
A.一定没有钠单质
B.一定有氧化钠
C.含有两种或两种以上物质
D.只含有两种物质【解析】固体物质只含钠和氧两种元素,与水反应产生两种气体,两种气体分别为H2和O2。固体物质中一定有钠和过氧化钠,可能有Na2O,也可能没有Na2O。
【答案】 C3.有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸
C.分别将它们配制成溶液,再加入CaCl2溶液
D.分别加热,再用石灰水检验是否有CO2产生【解析】A项中发生的反应分别为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项Na2CO3溶液中滴加盐酸,开始无现象,后来产生气体,而NaHCO3溶液中一滴入盐酸立即产生气体,现象不同;C项Na2CO3与CaCl2发生反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,产生白色沉淀,NaHCO3与CaCl2不反应,可以鉴别;D项将固体物质分别加热后,只发生反应:2NaHCO3 Na2CO3+H2O+CO2↑,产生的CO2能使澄清石灰水变浑浊,故选A。
【答案】A4.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体
B.加入氢氧化钡溶液
C.加入澄清石灰水
D.加入稀盐酸【解析】除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成分。溶液中可用这样的方法:Na2CO3+CO2+H2O=2NaHCO3。
【答案】 A5.北京奥运会开幕式向全世界兑现了“科技奥运”的承诺,其中焰火打出的五环标志如图所示。下列有关说法正确的是( )A.焰火是碱金属等发生燃烧的现象
B.焰火是碱金属等发生焰色反应
C.焰火的火树银花的效果是金属单质在空气中燃烧产生的
D.某样品的焰色反应呈黄色,说明它只含钠元素,不含其他金属元素【解析】北京奥运会开幕式上的焰火是碱金属等发生焰色反应形成的,它不属于化学变化。钠的焰色会掩盖钾的焰色,所以,某样品的焰色呈黄色,说明它一定含有钠元素,可能还含有钾元素等。
【答案】B6.钠在空气中燃烧的有关叙述正确的是( )
A.钠在空气中燃烧时火焰呈淡蓝色
B.钠在空气中燃烧时生成的是白色的氧化钠
C.钠在空气中燃烧时生成的是淡黄色的过氧化钠
D.钠在燃烧时生成的过氧化钠中氧元素的化合价为-2价【解析】 钠在空气中燃烧生成的是淡黄色的过氧化钠,由于钠的焰色反应呈黄色,所以燃烧时火焰呈黄色。
【答案】 C7.关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3
⑥NaCl
A.①② B.②③④⑤
C.①②③④ D.①②③④⑤【解析】 Na与空气中的水、O2反应,Na2O和Na2O2均与空气中的CO2、H2O反应,NaOH与空气中的CO2反应,都必须隔绝空气保存。
【答案】 C
