鲁教版九年级化学第五单元 定量研究化学反应复习学案
文档属性
| 名称 | 鲁教版九年级化学第五单元 定量研究化学反应复习学案 |  | |
| 格式 | zip | ||
| 文件大小 | 407.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-08 09:55:53 | ||
图片预览




文档简介
第五单元
化学方程式
考点一、质量守恒定律
1.质量守恒定律:参加化学反应的各物质的__________等于反应后生成的各物质_____________,这个规律叫质量守恒定律。
2.微观解释:物质在发生化学反应前后,各物质的质量总和相等,是因为在一切化学反应中,反应前后原子的_________没有改变,原子的_______没有增减,原子的_______也没有变化,所以,化学反应前后各物质的质量总和必然相等。
3、质量守恒定律,只解释
变化的
问题。用实验的方法验证质量守恒定律时,如涉及气体,
实验应在
容器内进行。
化学反应的“不变”与“变”
化学反应前后六个不变。
(1)宏观:①物质的__________不变;②元素的________不变。③元素的________不变。
(2)微观:①原子________不变;②原子________不变;③原子_________不变。
化学反应前后两个改变。
(1)宏观:____________一定改变。(2)微观:___________一定改变。
可能改变:_____________及其他。
考点二、化学方程式
1.定义:用____________来表示化学反应的式子。
2.意义
(1)质的方面:_________________及反应条件。
(2)量的方面:
①宏观:反应物、生成物各物质间的__________。
②微观:反应物、生成物各物质间的___________(或粒子个数)之比。
3、化学方程式的读法( 3.以C+O2CO2为例。其读法为:
(1)宏观:在点燃的条件下,________________________________。
(2)微观:在点燃的条件下,________________________________________________________。
(3)质量:在点燃的条件下,__________________________________________________________________________________。
)
(1)宏观:
(2)微观:
(3)质量:
4、化学方程式的写法
(1).书写原则:一要__________________为基础,二要遵守___________定律。
(2).书写步骤
①写出化学式:根据实验事实,在式子的左右两边写出__________和____________的化学式,并在式子的左、右两边之间加上一条短横线。
②配平并检查:在化学式的前面加上适当的______(是“1”时,若不是填空题,一般省略),使短线两边每种元素的_________相等,并将短横线改为等号。
③注明反应条件,标明产物状态。
当反应物中
气体时,在生成的气体后,标上
;当反应在溶液中进行,且反应物中
沉淀时,在生成的沉淀后,标上
。
考点三、根据化学方程式的简单计算
计算依据
化学反应中物质的质量比:
不变
。
化学反应中物质的质量比==
和
的
的之比
2.计算步骤
设→写→找→列→求→答,即:
(1)设未知数x(此步骤的“x”不带单位);
(2)正确写出化学方程式(一定要配平);
(3)找出关系量、已知量、未知量(注意相对分子质量一定要计算正确);
(4)列出比例式;
(5)求出未知量;
(6)回答问题。
典例分析 解析突破
【例1】(2016 盐城)一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( )
A.X的值为22
B.该反应属于置换反应
C.W由碳、氢两种元素组成
D.W中碳、氢元素原子个数比为1:4
【解析】:由于四种物质中
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )W和氧气质量减小,所以是反应物,且反应物的总质量是8g+(20g﹣8g)=20g,而水的质量增加,且增加值是10g﹣1g=9g,依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是20g﹣9g=11g;此反应的表达式可表示为W+O2→CO2+H2O.
A、X的值为11,错误;
B、由于该反应的表达式是W+O2→CO2+H2O,生成物是两种化合物,不属于置换反应,错误;
C、根据质量守恒定律,由反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素的质量为:9g×=8g,二氧化碳中氧元素的质量:11g×=8g,两者的质量和为16g,而参加反应的氧气的质量20g﹣8g=12g,所以可判断W中含有氧元素,错误;
D、W中碳、氢元素原子个数比为::
=1:4,正确.
故选D.
【例2】(2016 衡阳)如图是某化学反应的微观模型,“”、“”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
A.该反应属于分解反应
B.反应中共有两种元素参加
C.反应物和生成物中只有一种单质
D.参加反应的两种物质分子个数之比为2:3
【解答】解:A、由图示可知,该反应的反应物是两种、生成物是一种,该反应是化合反应,不属于分解反应,故A错误;
B、由反应中原子的种类可知,该反应中共有两种元素,故B正确;
C、单质的分子由一种原子构成,化合物的分子由多种原子构成,由图示可知看出反应物是两种单质,而生成物是一种化合物,故C错误;
D、由反应的图示结合质量守恒定律可知,参加反应的两种物质分子个数之比为1:3,故D错误.
故选:B.
【例3】(2016 安徽)
早在西汉时期的《淮南万毕术》中就记
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )载“曾青得铁则化为铜”,成为现代湿法冶金的先驱.现有含1.6kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数.
(2)理论上与硫酸铜反应消耗铁粉的质量.
【解答】解:
(1)硫酸铜中铜元素的质量分数=100%=40%;
(2)设理论上与硫酸铜反应消耗铁粉的质量为x
Fe+CuSO4═Cu+FeSO4
56
160
x
1.6Kg
x=0.56Kg
答案:
(1)硫酸铜中铜元素的质量分数为40%;
(2)理论上与硫酸铜反应消耗铁粉的质量为0.56Kg.
【例4】(2016 郑州模拟)已知4.4g某纯净完全燃烧生成13.2g二氧化碳和7.2g水,有关该物质判断正确的是( )
A.一定含有碳、氢元素,可能含有氧元素
B.一定含有碳、氢、氧三种元素
C.含碳元素的质量分数为42%
D.分子中碳、氢原子个数比为3:8
【解答】解:先根据反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.
13.2g二氧化碳中碳元素的质量=13.2g××100%=3.6g,7.2g水中氢元素的质量=7.2g××100%=0.8g.3.6g+0.8g=4.4g与该物质的质量相等,故一定不含氧元素,所以含碳元素的质量分数为×100%=82%,碳、氢元素的原子个数比=:
=3:8.
故选:D.
走进实验室
(2016 孝感)以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格).
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等;
猜想2:相等.
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量.
甲
组
乙
组
实验方案(反应后略)
实验现象
有气泡产生,天平指针向右偏转
铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论
猜想1正确反应的化学方程式:
猜想2正确
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转.得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在
中进行.
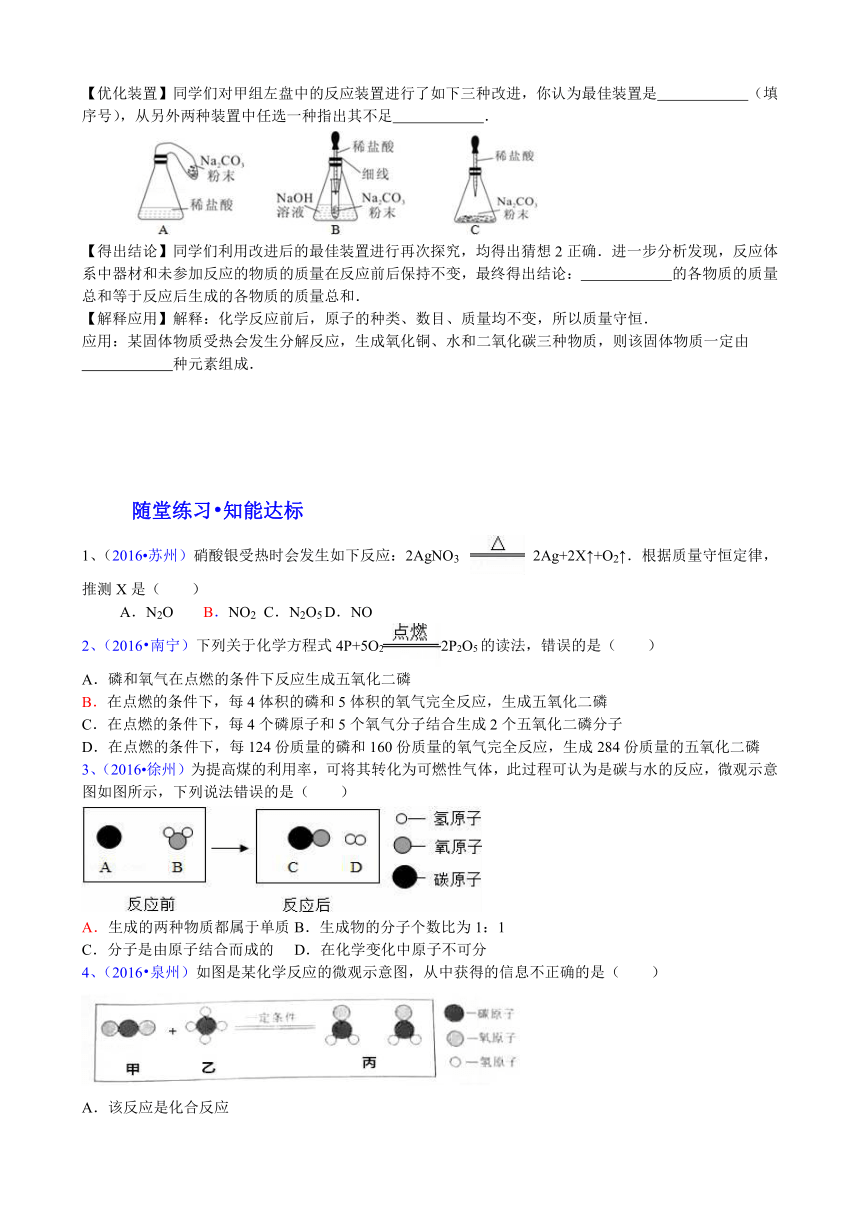
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 .
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确.进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论: 的各物质的质量总和等于反应后生成的各物质的质量总和.
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒.
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由
种元素组成.
随堂练习 知能达标
1、(2016 苏州)硝酸银受热时会发生如下反应:2AgNO3
2Ag+2X↑+O2↑.根据质量守恒定律,推测X是( )
A.N2O
B.NO2
C.N2O5
D.NO
2、(2016 南宁)下列关于化学方程式4P+5O22P2O5的读法,错误的是( )
A.磷和氧气在点燃的条件下反应生成五氧化二磷
B.在点燃的条件下,每4体积的磷和5体积的氧气完全反应,生成五氧化二磷
C.在点燃的条件下,每4个磷原子和5个氧气分子结合生成2个五氧化二磷分子
D.在点燃的条件下,每124份质量的磷和160份质量的氧气完全反应,生成284份质量的五氧化二磷
3、(2016 徐州)为提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,微观示意图如图所示,下列说法错误的是( )
A.生成的两种物质都属于单质
B.生成物的分子个数比为1:1
C.分子是由原子结合而成的
D.在化学变化中原子不可分
4、(2016 泉州)如图是某化学反应的微观示意图,从中获得的信息不正确的是( )
A.该反应是化合反应
B.反应前后原子的种类、个数都不变
C.甲和丙两种物质的质量比为11:4
D.甲乙丙三种物质的分子数比为1:1:1
5、(2016 濮阳模拟)对于已配平的化学反应:X+Ca(OH)2═Y+Cu(OH)2↓,下列分析中不正确的是( )
A.X中一定含有铜元素
B.X和Y的相对分子质量之差为24
C.Y一定是氯化钙
D.该反应一定是复分解反应
6、(2016 滨州模拟)已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:(说明:一种小球代表一种原子)则下列说法不正确的是( )
A.该反应属于化合反应
B.图示中共有4种分子
C.该图示说明在化学变化中分子可分,原子不可分
D.以上反应符合质量守恒定律
7、(2016 洛阳模拟)把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示,下列说法正确的是
物质
A
B
C
D
反应前质量/g
19.7
8.7
21.6
0.4
反应后质量/g
待测
17.4
0
3.6
A.物质C一定是化合物,D可能是单质
B.反应后密闭容器中A的质量为19.
7g
C.物质C中元素的种类等于A、B两种物质中元素的种类之和
D.若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化
学计量数之比为2:1
8、(2016 资阳)下列化学方程式书写正确,且属于置换反应的是( )
A.2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
B.C+CuO═Cu+CO2↑
C.Cu+2AgNO3═2Ag+Cu(NO3)2
D.Cu+FeSO4═Fe+CuSO4
9、(2016 济宁)根据下面实验内容书写的化学方程式,正确的是( )
A.在空气中点燃镁条
Mg+O2MgO
B.铝片放入稀硫酸中
Al+H2SO4═AlSO4+H2↑
C.氢氧化钠溶液中滴加氯化钡
2NaOH+BaCl2═Ba(OH)2↓+2NaCl
D.碳酸钠溶液中滴加硝酸银
Na2CO3+2AgNO3═Ag2CO3↓+2NaNO3
10、(2016 雅安)下列四个化学反应,对其反应类型的判断,正确的是
A.2CuO
+
C
2Cu
+
CO2↑
是复分解反应
B.Fe2O3
+
6HCl
=2FeCl3
+
3H2O是置换反应
C.2H2O22H2O
+
O2↑是分解反应
D.CH4
+
2O2CO2
+
2H2O是化合反应
11、(2016 邵阳)在2A+B═2C反应中,已知A的相对分子质量是28,C的相对分子质量是44,则B的相对分子质量是( )
A.16g
B.16
C.32g
D.32
12、(2016 邵阳)某化学反应可表示为:二氧化碳+水→M+氧气,根据以上信息,下列关于M组成的说法中正确的是( )
A.一定含有C、H元素,可能含有O元素
B.只含有C、H元素
C.含有C、H、O三种元素
D.无法确定
13、(2016德州模
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )拟)为减少汽车尾气产生的有害气体排
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )放到空气中污染空气,常在汽车排气管上安装“催化转化器”,如图是某种汽车尾气处理装置中发生化学反应的微观示意图,下列说法中,不正确的是( )
A.丁的化学式为CO2
B.反应前后氮元素的化合价不变
C.反应物中有两种化合物
D.反应中甲、丙两物质的质量比为15:7
14、(2016 常德)某有机物6.0g在空气中完全燃烧,共得到17.6g二氧化碳和10.8g水,则该化合物的组成元素是( )
A.一定只含有碳元素
B.一定只含有碳、氢两种元素
C.一定含有碳、氢、氧三种元素
D.一定含有碳、氢元素,可能含有氧元素
15、(2016 邵阳)用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的是( )
A.
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )
B.
C.
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )
D.
16、(2016 邵阳)如图是汽车尾气有害物质转化的微观示意图.
据图回答:
(1)该反应共涉及
种分子.
(2)在中“”与“”的质量比是
(填最简整数比).
(3)写出该反应的化学方程式
.
17、(2016 苏州)写出下列反应的化学方程式.
(1)镁条在空气中燃烧生成所化镁:
;
(2)锌和稀硫酸反应:
;
(3)氢氧化钠溶液和稀盐酸反应:
;
(4)实验室加热高锰酸钾制取氧气:
;
(5)硫化氢(H2S)气体和二氧化硫气体混合生成硫和水:
.
18、(2016 重庆)某同学用自制电解器电解水,为了加快电解速率,可在水中加少许硫酸钠增强其导电性,当他在93.6g质量分数为5%的硫酸钠溶液中通电一段时间后,正极上产生3.2g氧气,计算:
(1)负极上产生氢气的质量;
(2)通电后溶液中硫酸钠的质量分数;
(3)该同学认为电解速率较慢,又继续向通电后的溶液中加入硫酸钠,若要使溶液中溶质的质量分数变为10%,则需要加入硫酸钠固体的质量是多少?
19、(2016 云南)为测定某硫酸溶液中溶质的质量分数,化学
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )小组同学取10g该硫酸溶液,向其中加入21.2gBaCl2溶液,二者恰好完全反应,过滤后称得滤液的质量为28.87g.请计算:
(1)反应后生成沉淀的质量是 2.33 g.
(2)该该硫酸溶液中溶质的质量分数.(计算结果精确到0.1%)
20、(2016 西宁)某同学在实验室作酸碱中和反应
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )实验.将稀硫酸滴入到8克10%的氢氧化钠溶液中至恰好完全反应,共消耗稀硫酸10克,请计算该硫酸中溶质的质量分数.
参考答案
走进实验室
答案:
【实验探究】Na2CO3+2HCl=2NaCl+H2O+CO2↑;
【反思评价】密闭;
【优化装置】B;A同学实验中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大.因此反应后天平不能平衡.
【得出结论】参加化学反应;
【解释应用】铜、碳、氧、氢四
随堂练习 知能达标
1、B.2、B.3、A.4、D.
5、C
6、A.
7、A.
【解答】解:由表中数据分析可知,反应前后
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 ),B的质量增加了17.4g﹣8.7g=8.7g,故B是生成物,生成的B的质量为8.7g;同理可以确定C是反应物,参加反应的C的质量为31.6g﹣0g=31.6g;D为生成物,生成D的质量为3.6g﹣0.4g=3.2g;由质量守恒定律,A应是生成物,且生成的A的质量为31.6g﹣8.7g﹣3.2g=19.7g.
A、该反应的反应物为C,生成物是A、B、D,符合“一变多”的特征,属于分解反应,则物质C一定是化合物,物质D可能是单质,故选项说法正确.
B、由质量守恒定律,A应是生成物,且
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )生成的A的质量为31.6g﹣8.7g﹣3.2g=19.7g,故待测的数值为19.7g+19.7g=39.4g,故选项说法错误.
C、反应过程中,物质B与物质D变化的质量比为8.7g:3.2g=87:32,故选项说法错误.
D、若物质A与物质C的相对分子质量之比
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )为197:158,设反应中A与C的化学计量数之比为x:y,则197x:158y=19.7g:31.6g,x:y=1:2,故选项说法错误.
故选A.
8、C.9、D
10、C.
11、D.
12、A.13、B.
14、B.
【解答】解:17.6gCO2中含有碳元素的质量为:17.6g××100%=4.8g,10.8g水中含有氢元素的质量为:10.8g××100%=1.2g,生成物17.6g二氧化碳和10.8g水中所含碳、氢元素的质量和=4.8g+1.2g=6.0g,6.0g=有机物的质量6.0g,则该物质中一定含有碳、氢两种元素,一定不含氧元素.
15、D.
16、(1) 4 .(2) 3:8 .(3) 2CO+2NO2CO2+N2 .
17、(1) 2Mg+O22MgO ;
(2) Zn+H2SO4═ZnSO4+H2↑ ;
(3) HCl+NaOH=NaCl+H2O ;
(4) 2KMnO4
加热
K2MnO4+MnO2+O2↑ ;
(5) 2H2S+SO2=3S+2H2O .
18、【解答】解:(1)设生成氢气的质量为x,反应的水的质量为y,
2H2O2H2↑+O2↑
36
4
32
y
x
3.2g
==
x=0.4g
y=3.6g
所以生成氢气的质量是0.4g;
(2)电解后溶质硫酸钠的质量为:93.6g×5%=4.68g,
溶液的质量为:93.6g﹣3.6g=90g,
电解后溶液的溶质质量分数为:×100%=5.2%;
(3)设需要加入硫酸钠的质量为y
y+4.68g=(y+90g)×10%
y=4.8g
故答案为:(1)生成氢气的质量是0.4g;
(2)电解后溶液的溶质质量分数为5.2%;
(3)需要加入硫酸钠的质量为4.8g.
19、【解答】解:解:(1)生成沉淀的质量为:10g+21.2g﹣﹣28.87g=2.33g;
(2)设硫酸的溶质质量分数为x
H2SO4+BaCl2=BaSO4↓+2HCl
98
233
10g×x
2.33g
=
x=9.8%
故答案为:(1)反应后生成沉淀的质量是2.33g;
(2)该该硫酸溶液中溶质的质量分数9.8%.
20、【解答】解:设硫酸溶液中溶质的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98
80
x
8g×10%
=
x=0.98g
硫酸溶液的溶质质量分数为×100%=9.8%
答:硫酸溶液的溶质质量分数为9.8%.
氧
氮
化学方程式
考点一、质量守恒定律
1.质量守恒定律:参加化学反应的各物质的__________等于反应后生成的各物质_____________,这个规律叫质量守恒定律。
2.微观解释:物质在发生化学反应前后,各物质的质量总和相等,是因为在一切化学反应中,反应前后原子的_________没有改变,原子的_______没有增减,原子的_______也没有变化,所以,化学反应前后各物质的质量总和必然相等。
3、质量守恒定律,只解释
变化的
问题。用实验的方法验证质量守恒定律时,如涉及气体,
实验应在
容器内进行。
化学反应的“不变”与“变”
化学反应前后六个不变。
(1)宏观:①物质的__________不变;②元素的________不变。③元素的________不变。
(2)微观:①原子________不变;②原子________不变;③原子_________不变。
化学反应前后两个改变。
(1)宏观:____________一定改变。(2)微观:___________一定改变。
可能改变:_____________及其他。
考点二、化学方程式
1.定义:用____________来表示化学反应的式子。
2.意义
(1)质的方面:_________________及反应条件。
(2)量的方面:
①宏观:反应物、生成物各物质间的__________。
②微观:反应物、生成物各物质间的___________(或粒子个数)之比。
3、化学方程式的读法( 3.以C+O2CO2为例。其读法为:
(1)宏观:在点燃的条件下,________________________________。
(2)微观:在点燃的条件下,________________________________________________________。
(3)质量:在点燃的条件下,__________________________________________________________________________________。
)
(1)宏观:
(2)微观:
(3)质量:
4、化学方程式的写法
(1).书写原则:一要__________________为基础,二要遵守___________定律。
(2).书写步骤
①写出化学式:根据实验事实,在式子的左右两边写出__________和____________的化学式,并在式子的左、右两边之间加上一条短横线。
②配平并检查:在化学式的前面加上适当的______(是“1”时,若不是填空题,一般省略),使短线两边每种元素的_________相等,并将短横线改为等号。
③注明反应条件,标明产物状态。
当反应物中
气体时,在生成的气体后,标上
;当反应在溶液中进行,且反应物中
沉淀时,在生成的沉淀后,标上
。
考点三、根据化学方程式的简单计算
计算依据
化学反应中物质的质量比:
不变
。
化学反应中物质的质量比==
和
的
的之比
2.计算步骤
设→写→找→列→求→答,即:
(1)设未知数x(此步骤的“x”不带单位);
(2)正确写出化学方程式(一定要配平);
(3)找出关系量、已知量、未知量(注意相对分子质量一定要计算正确);
(4)列出比例式;
(5)求出未知量;
(6)回答问题。
典例分析 解析突破
【例1】(2016 盐城)一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( )
A.X的值为22
B.该反应属于置换反应
C.W由碳、氢两种元素组成
D.W中碳、氢元素原子个数比为1:4
【解析】:由于四种物质中
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )W和氧气质量减小,所以是反应物,且反应物的总质量是8g+(20g﹣8g)=20g,而水的质量增加,且增加值是10g﹣1g=9g,依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是20g﹣9g=11g;此反应的表达式可表示为W+O2→CO2+H2O.
A、X的值为11,错误;
B、由于该反应的表达式是W+O2→CO2+H2O,生成物是两种化合物,不属于置换反应,错误;
C、根据质量守恒定律,由反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素的质量为:9g×=8g,二氧化碳中氧元素的质量:11g×=8g,两者的质量和为16g,而参加反应的氧气的质量20g﹣8g=12g,所以可判断W中含有氧元素,错误;
D、W中碳、氢元素原子个数比为::
=1:4,正确.
故选D.
【例2】(2016 衡阳)如图是某化学反应的微观模型,“”、“”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )
A.该反应属于分解反应
B.反应中共有两种元素参加
C.反应物和生成物中只有一种单质
D.参加反应的两种物质分子个数之比为2:3
【解答】解:A、由图示可知,该反应的反应物是两种、生成物是一种,该反应是化合反应,不属于分解反应,故A错误;
B、由反应中原子的种类可知,该反应中共有两种元素,故B正确;
C、单质的分子由一种原子构成,化合物的分子由多种原子构成,由图示可知看出反应物是两种单质,而生成物是一种化合物,故C错误;
D、由反应的图示结合质量守恒定律可知,参加反应的两种物质分子个数之比为1:3,故D错误.
故选:B.
【例3】(2016 安徽)
早在西汉时期的《淮南万毕术》中就记
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )载“曾青得铁则化为铜”,成为现代湿法冶金的先驱.现有含1.6kg硫酸铜的工业废液,加入铁粉回收铜,请计算:
(1)硫酸铜中铜元素的质量分数.
(2)理论上与硫酸铜反应消耗铁粉的质量.
【解答】解:
(1)硫酸铜中铜元素的质量分数=100%=40%;
(2)设理论上与硫酸铜反应消耗铁粉的质量为x
Fe+CuSO4═Cu+FeSO4
56
160
x
1.6Kg
x=0.56Kg
答案:
(1)硫酸铜中铜元素的质量分数为40%;
(2)理论上与硫酸铜反应消耗铁粉的质量为0.56Kg.
【例4】(2016 郑州模拟)已知4.4g某纯净完全燃烧生成13.2g二氧化碳和7.2g水,有关该物质判断正确的是( )
A.一定含有碳、氢元素,可能含有氧元素
B.一定含有碳、氢、氧三种元素
C.含碳元素的质量分数为42%
D.分子中碳、氢原子个数比为3:8
【解答】解:先根据反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.
13.2g二氧化碳中碳元素的质量=13.2g××100%=3.6g,7.2g水中氢元素的质量=7.2g××100%=0.8g.3.6g+0.8g=4.4g与该物质的质量相等,故一定不含氧元素,所以含碳元素的质量分数为×100%=82%,碳、氢元素的原子个数比=:
=3:8.
故选:D.
走进实验室
(2016 孝感)以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格).
【提出问题】化学反应前后各物质的质量总和是否相等?
【猜想与假设】猜想1:不相等;
猜想2:相等.
【实验探究】甲、乙两组同学用托盘天平分别称量反应前后物质的质量.
甲
组
乙
组
实验方案(反应后略)
实验现象
有气泡产生,天平指针向右偏转
铁钉表面有红色物质析出,溶液颜色发生改变,天平指针没有偏转
结论
猜想1正确反应的化学方程式:
猜想2正确
【反思评价】究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转.得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在
中进行.
【优化装置】同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是 (填序号),从另外两种装置中任选一种指出其不足 .
【得出结论】同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确.进一步分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论: 的各物质的质量总和等于反应后生成的各物质的质量总和.
【解释应用】解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒.
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由
种元素组成.
随堂练习 知能达标
1、(2016 苏州)硝酸银受热时会发生如下反应:2AgNO3
2Ag+2X↑+O2↑.根据质量守恒定律,推测X是( )
A.N2O
B.NO2
C.N2O5
D.NO
2、(2016 南宁)下列关于化学方程式4P+5O22P2O5的读法,错误的是( )
A.磷和氧气在点燃的条件下反应生成五氧化二磷
B.在点燃的条件下,每4体积的磷和5体积的氧气完全反应,生成五氧化二磷
C.在点燃的条件下,每4个磷原子和5个氧气分子结合生成2个五氧化二磷分子
D.在点燃的条件下,每124份质量的磷和160份质量的氧气完全反应,生成284份质量的五氧化二磷
3、(2016 徐州)为提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳与水的反应,微观示意图如图所示,下列说法错误的是( )
A.生成的两种物质都属于单质
B.生成物的分子个数比为1:1
C.分子是由原子结合而成的
D.在化学变化中原子不可分
4、(2016 泉州)如图是某化学反应的微观示意图,从中获得的信息不正确的是( )
A.该反应是化合反应
B.反应前后原子的种类、个数都不变
C.甲和丙两种物质的质量比为11:4
D.甲乙丙三种物质的分子数比为1:1:1
5、(2016 濮阳模拟)对于已配平的化学反应:X+Ca(OH)2═Y+Cu(OH)2↓,下列分析中不正确的是( )
A.X中一定含有铜元素
B.X和Y的相对分子质量之差为24
C.Y一定是氯化钙
D.该反应一定是复分解反应
6、(2016 滨州模拟)已知某两种物质在光照条件下能发生化学反应,其微观示意图如下:(说明:一种小球代表一种原子)则下列说法不正确的是( )
A.该反应属于化合反应
B.图示中共有4种分子
C.该图示说明在化学变化中分子可分,原子不可分
D.以上反应符合质量守恒定律
7、(2016 洛阳模拟)把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如下表所示,下列说法正确的是
物质
A
B
C
D
反应前质量/g
19.7
8.7
21.6
0.4
反应后质量/g
待测
17.4
0
3.6
A.物质C一定是化合物,D可能是单质
B.反应后密闭容器中A的质量为19.
7g
C.物质C中元素的种类等于A、B两种物质中元素的种类之和
D.若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化
学计量数之比为2:1
8、(2016 资阳)下列化学方程式书写正确,且属于置换反应的是( )
A.2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
B.C+CuO═Cu+CO2↑
C.Cu+2AgNO3═2Ag+Cu(NO3)2
D.Cu+FeSO4═Fe+CuSO4
9、(2016 济宁)根据下面实验内容书写的化学方程式,正确的是( )
A.在空气中点燃镁条
Mg+O2MgO
B.铝片放入稀硫酸中
Al+H2SO4═AlSO4+H2↑
C.氢氧化钠溶液中滴加氯化钡
2NaOH+BaCl2═Ba(OH)2↓+2NaCl
D.碳酸钠溶液中滴加硝酸银
Na2CO3+2AgNO3═Ag2CO3↓+2NaNO3
10、(2016 雅安)下列四个化学反应,对其反应类型的判断,正确的是
A.2CuO
+
C
2Cu
+
CO2↑
是复分解反应
B.Fe2O3
+
6HCl
=2FeCl3
+
3H2O是置换反应
C.2H2O22H2O
+
O2↑是分解反应
D.CH4
+
2O2CO2
+
2H2O是化合反应
11、(2016 邵阳)在2A+B═2C反应中,已知A的相对分子质量是28,C的相对分子质量是44,则B的相对分子质量是( )
A.16g
B.16
C.32g
D.32
12、(2016 邵阳)某化学反应可表示为:二氧化碳+水→M+氧气,根据以上信息,下列关于M组成的说法中正确的是( )
A.一定含有C、H元素,可能含有O元素
B.只含有C、H元素
C.含有C、H、O三种元素
D.无法确定
13、(2016德州模
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )拟)为减少汽车尾气产生的有害气体排
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )放到空气中污染空气,常在汽车排气管上安装“催化转化器”,如图是某种汽车尾气处理装置中发生化学反应的微观示意图,下列说法中,不正确的是( )
A.丁的化学式为CO2
B.反应前后氮元素的化合价不变
C.反应物中有两种化合物
D.反应中甲、丙两物质的质量比为15:7
14、(2016 常德)某有机物6.0g在空气中完全燃烧,共得到17.6g二氧化碳和10.8g水,则该化合物的组成元素是( )
A.一定只含有碳元素
B.一定只含有碳、氢两种元素
C.一定含有碳、氢、氧三种元素
D.一定含有碳、氢元素,可能含有氧元素
15、(2016 邵阳)用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的是( )
A.
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )
B.
C.
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )
D.
16、(2016 邵阳)如图是汽车尾气有害物质转化的微观示意图.
据图回答:
(1)该反应共涉及
种分子.
(2)在中“”与“”的质量比是
(填最简整数比).
(3)写出该反应的化学方程式
.
17、(2016 苏州)写出下列反应的化学方程式.
(1)镁条在空气中燃烧生成所化镁:
;
(2)锌和稀硫酸反应:
;
(3)氢氧化钠溶液和稀盐酸反应:
;
(4)实验室加热高锰酸钾制取氧气:
;
(5)硫化氢(H2S)气体和二氧化硫气体混合生成硫和水:
.
18、(2016 重庆)某同学用自制电解器电解水,为了加快电解速率,可在水中加少许硫酸钠增强其导电性,当他在93.6g质量分数为5%的硫酸钠溶液中通电一段时间后,正极上产生3.2g氧气,计算:
(1)负极上产生氢气的质量;
(2)通电后溶液中硫酸钠的质量分数;
(3)该同学认为电解速率较慢,又继续向通电后的溶液中加入硫酸钠,若要使溶液中溶质的质量分数变为10%,则需要加入硫酸钠固体的质量是多少?
19、(2016 云南)为测定某硫酸溶液中溶质的质量分数,化学
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )小组同学取10g该硫酸溶液,向其中加入21.2gBaCl2溶液,二者恰好完全反应,过滤后称得滤液的质量为28.87g.请计算:
(1)反应后生成沉淀的质量是 2.33 g.
(2)该该硫酸溶液中溶质的质量分数.(计算结果精确到0.1%)
20、(2016 西宁)某同学在实验室作酸碱中和反应
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )实验.将稀硫酸滴入到8克10%的氢氧化钠溶液中至恰好完全反应,共消耗稀硫酸10克,请计算该硫酸中溶质的质量分数.
参考答案
走进实验室
答案:
【实验探究】Na2CO3+2HCl=2NaCl+H2O+CO2↑;
【反思评价】密闭;
【优化装置】B;A同学实验中碳酸钠与盐酸反应生成二氧化碳,二氧化碳充满气球,使整个装置所受空气浮力增大.因此反应后天平不能平衡.
【得出结论】参加化学反应;
【解释应用】铜、碳、氧、氢四
随堂练习 知能达标
1、B.2、B.3、A.4、D.
5、C
6、A.
7、A.
【解答】解:由表中数据分析可知,反应前后
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 ),B的质量增加了17.4g﹣8.7g=8.7g,故B是生成物,生成的B的质量为8.7g;同理可以确定C是反应物,参加反应的C的质量为31.6g﹣0g=31.6g;D为生成物,生成D的质量为3.6g﹣0.4g=3.2g;由质量守恒定律,A应是生成物,且生成的A的质量为31.6g﹣8.7g﹣3.2g=19.7g.
A、该反应的反应物为C,生成物是A、B、D,符合“一变多”的特征,属于分解反应,则物质C一定是化合物,物质D可能是单质,故选项说法正确.
B、由质量守恒定律,A应是生成物,且
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )生成的A的质量为31.6g﹣8.7g﹣3.2g=19.7g,故待测的数值为19.7g+19.7g=39.4g,故选项说法错误.
C、反应过程中,物质B与物质D变化的质量比为8.7g:3.2g=87:32,故选项说法错误.
D、若物质A与物质C的相对分子质量之比
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )为197:158,设反应中A与C的化学计量数之比为x:y,则197x:158y=19.7g:31.6g,x:y=1:2,故选项说法错误.
故选A.
8、C.9、D
10、C.
11、D.
12、A.13、B.
14、B.
【解答】解:17.6gCO2中含有碳元素的质量为:17.6g××100%=4.8g,10.8g水中含有氢元素的质量为:10.8g××100%=1.2g,生成物17.6g二氧化碳和10.8g水中所含碳、氢元素的质量和=4.8g+1.2g=6.0g,6.0g=有机物的质量6.0g,则该物质中一定含有碳、氢两种元素,一定不含氧元素.
15、D.
16、(1) 4 .(2) 3:8 .(3) 2CO+2NO2CO2+N2 .
17、(1) 2Mg+O22MgO ;
(2) Zn+H2SO4═ZnSO4+H2↑ ;
(3) HCl+NaOH=NaCl+H2O ;
(4) 2KMnO4
加热
K2MnO4+MnO2+O2↑ ;
(5) 2H2S+SO2=3S+2H2O .
18、【解答】解:(1)设生成氢气的质量为x,反应的水的质量为y,
2H2O2H2↑+O2↑
36
4
32
y
x
3.2g
==
x=0.4g
y=3.6g
所以生成氢气的质量是0.4g;
(2)电解后溶质硫酸钠的质量为:93.6g×5%=4.68g,
溶液的质量为:93.6g﹣3.6g=90g,
电解后溶液的溶质质量分数为:×100%=5.2%;
(3)设需要加入硫酸钠的质量为y
y+4.68g=(y+90g)×10%
y=4.8g
故答案为:(1)生成氢气的质量是0.4g;
(2)电解后溶液的溶质质量分数为5.2%;
(3)需要加入硫酸钠的质量为4.8g.
19、【解答】解:解:(1)生成沉淀的质量为:10g+21.2g﹣﹣28.87g=2.33g;
(2)设硫酸的溶质质量分数为x
H2SO4+BaCl2=BaSO4↓+2HCl
98
233
10g×x
2.33g
=
x=9.8%
故答案为:(1)反应后生成沉淀的质量是2.33g;
(2)该该硫酸溶液中溶质的质量分数9.8%.
20、【解答】解:设硫酸溶液中溶质的质量为x
H2SO4+2NaOH═Na2SO4+2H2O
98
80
x
8g×10%
=
x=0.98g
硫酸溶液的溶质质量分数为×100%=9.8%
答:硫酸溶液的溶质质量分数为9.8%.
氧
氮
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
