鲁教版九年级化学第七单元常见的酸和碱检测题
文档属性
| 名称 | 鲁教版九年级化学第七单元常见的酸和碱检测题 |
|
|
| 格式 | zip | ||
| 文件大小 | 1007.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-08 00:00:00 | ||
图片预览

文档简介
第七单元酸和碱检测试题
测试时间:50分钟
满分为100分
有关相对原子质量:H-1 O-16 Na-23 S-32
Cl-35.5 Cu-64
一、识别与选择(本题包括15小题,每小题2分,共30分,每小题只用一个选项最符合题意)
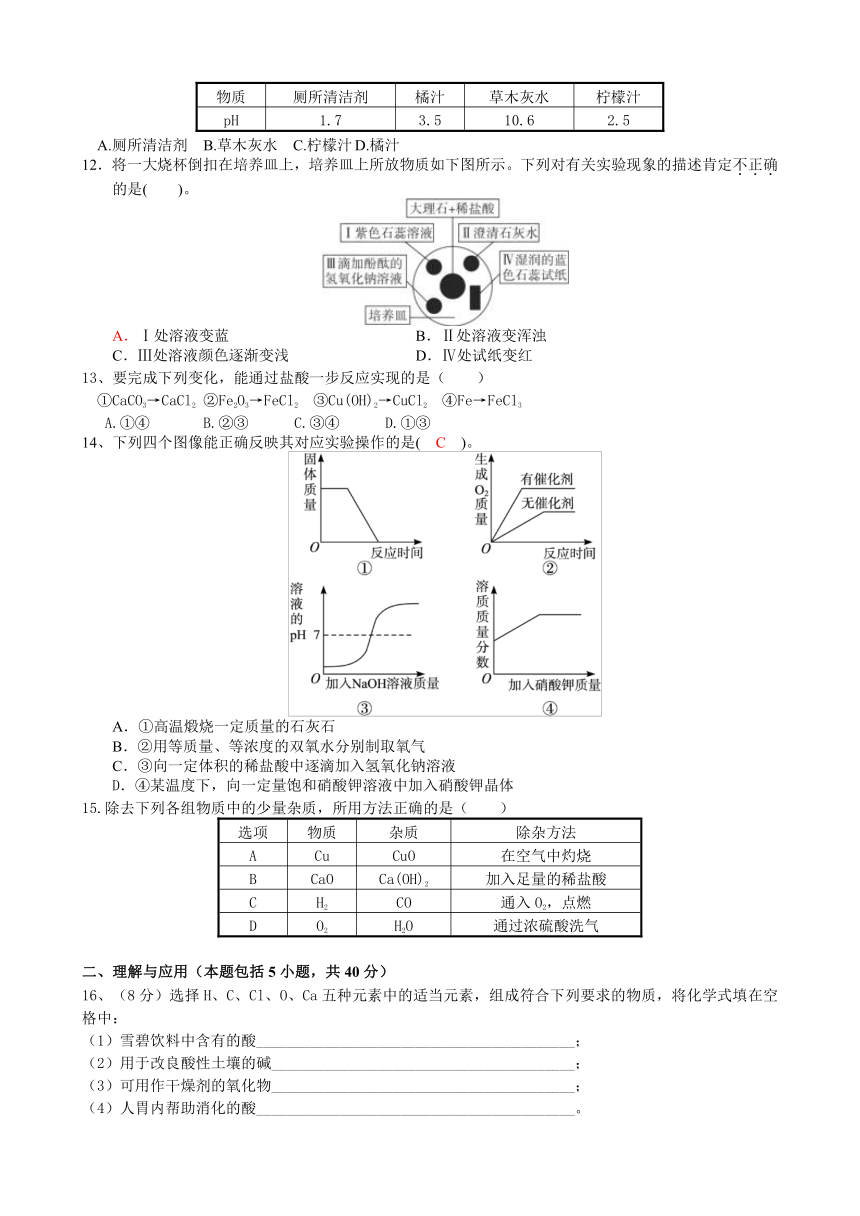
1.化学实验室中的药品按物质类别分类放置
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )。下面是做“酸和碱的识别”实验时,实验桌上部分药品的摆放情况。小林取用了硫酸以后,应该把它放回的位置是( )。
2.下列家庭小实验不能成功的是( )。
A.用紫卷心菜制酸碱指示剂
B.用闻气味的方法鉴别白酒和白醋
C.用食盐水浸泡菜刀除去表面的锈斑
D.用果汁、小苏打、柠檬酸、凉开水等自制汽水
3.常温下,一些物质的pH如下,其中显酸性的物质是( )。
A.柠檬汁 pH=2
B.鸡蛋清 pH=8
C.蒸馏水 pH=7
D.肥皂水 pH=10
4.2.混有水蒸气的下列气体,既能用浓硫酸干燥,又能用固体氢氧化钠干燥的是( )
A.SO2 B.H2
C.CO2
D.HCl
5.实验室中下列药品敞口放置一段时间后,药品质量发生变化的原因与空气中CO2有关的一组是( )
①氢氧化钠固体 ②澄清石灰水
③浓盐酸
④浓硫酸
A.①②
B.①③
C.②④
D.①④
6、下列对实验意外事故的处理错误的是( )。
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%~5%的碳酸氢钠溶液
7.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( )。
A.除去氯化钠溶液中的碳酸钠
B.除去铜粉中混有的铁粉
C.除去熟石灰中的石灰石
D.除去铁丝上的铁锈
8.推理是一种重要的研究和学习方法。下列推理正确的是( )。
A.碱中都含有氢氧根,所以碱中一定含有氢元素
B.分子是构成物质的微粒,因此物质都是由分子构成的
C.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中燃烧
9.
碱溶液中都含
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )。
A.能使紫色石蕊溶液变蓝色
B.能与盐酸反应生成水
C.能与Na2SO4溶液反应生成BaSO4沉淀
D.能与CO2反应生成水
10.玻璃中含有二氧化硅(SiO2),该物质
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )在一定条件下能与NaOH溶液发生反应,生成具有黏合性能的Na2SiO3溶液(俗称水玻璃)。下列有关说法正确的是( )。
A.水玻璃属于纯净物
B.水玻璃和玻璃属于同种物质
C.二氧化硅与氢氧化钠发生中和反应
D.NaOH溶液不能用带磨口玻璃塞的试剂瓶盛装
11.下表是部分常见物质的pH,在这些物质中,能使紫色石蕊溶液变蓝的是( )
物质
厕所清洁剂
橘汁
草木灰水
柠檬汁
pH
1.7
3.5
10.6
2.5
A.厕所清洁剂
B.草木灰水
C.柠檬汁
D.橘汁
12.将一大烧杯倒扣在培养皿上,培养皿上所放物质如下图所示。下列对有关实验现象的描述肯定不正确的是( )。
A.Ⅰ处溶液变蓝
B.Ⅱ处溶液变浑浊
C.Ⅲ处溶液颜色逐渐变浅
D.Ⅳ处试纸变红
13、要完成下列变化,能通过盐酸一步反应实现的是( )
①CaCO3→CaCl2
②Fe2O3→FeCl2
③Cu(OH)2→CuCl2
④Fe→FeCl3
A.①④
B.②③
C.③④
D.①③
14、下列四个图像能正确反映其对应实验操作的是( C )。
HYPERLINK
"http://www.21cnjy.com"
\o
"欢迎登陆21世纪教育网"
INCLUDEPICTURE
"../../../"
\
MERGEFORMAT
A.①高温煅烧一定质量的石灰石
B.②用等质量、等浓度的双氧水分别制取氧气
C.③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
D.④某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
15.除去下列各组物质中的少量杂质,所用方法正确的是( )
选项
物质
杂质
除杂方法
A
Cu
CuO
在空气中灼烧
B
CaO
Ca(OH)2
加入足量的稀盐酸
C
H2
CO
通入O2,点燃
D
O2
H2O
通过浓硫酸洗气
二、理解与应用(本题包括5小题,共40分)
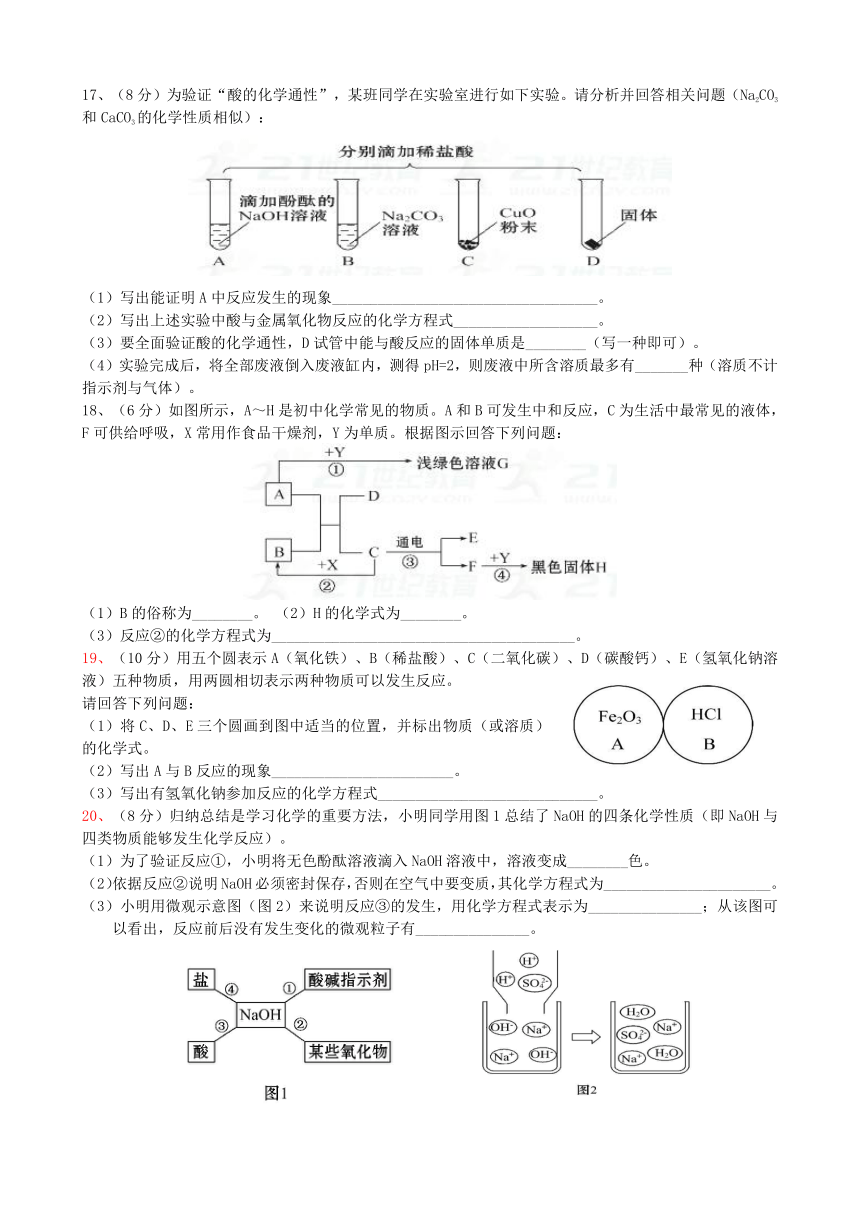
16、(8分)选择H、C、Cl、O、Ca五种元素中的适当元素,组成符合下列要求的物质,将化学式填在空格中:
(1)雪碧饮料中含有的酸__________________________________________;
(2)用于改良酸性土壤的碱________________________________________;
(3)可用作干燥剂的氧化物________________________________________;
(4)人胃内帮助消化的酸__________________________________________。
17、(8分)为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题(Na2CO3和CaCO3的化学性质相似):
(1)写出能证明A中反应发生的现象___________________________________。
(2)写出上述实验中酸与金属氧化物反应的化学方程式___________________。
(3)要全面验证酸的化学通性,D试管中能与酸反应的固体单质是________(写一种即可)。
(4)实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有_______种(溶质不计指示剂与气体)。
18、(6分)如图所示,A~H是初中化学常见的物质。A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂,Y为单质。根据图示回答下列问题:
(1)B的俗称为________。
(2)H的化学式为________。
(3)反应②的化学方程式为________________________________________。
19、(10分)用五个圆表示A(氧化铁)、B(稀盐酸)、C(二氧化碳)、D(碳酸钙)、E(氢氧化钠溶液)五种物质,用两圆相切表示两种物质可以发生反应。
请回答下列问题:
(1)将C、D、E三个圆画到图中适当的位置,并标出物质(或溶质)的化学式。
(2)写出A与B反应的现象________________________。
(3)写出有氢氧化钠参加反应的化学方程式_____________________________。
20、(8分)归纳总结是学习化学的重要方法,小明同学用图1总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
(1)为了验证反应①,小明将无色酚酞溶液滴入NaOH溶液中,溶液变成________色。
(2)依据反应②说明NaOH必须密封保存,否则在空气中要变质,其化学方程式为______________________。
(3)小明用微观示意图(图2)来说明反应③的发生,用化学方程式表示为_______________;从该图可以看出,反应前后没有发生变化的微观粒子有_______________。
三、试验与探究(本题包括2小题,共18分)
21、(8分)【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。实验装置和现象如图所示,请你一起参与。
【现象结论】甲装置中产生的实验现象______________(用化学方程式表示),
解释通常用石灰水而不用浓NaOH溶液检验CO2的原因______________________;
乙装置中的实验现象是_______________________________________________,
吸收CO2较多的装置是_____________。
【计算验证】另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为通常吸收CO2应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:______________________。
22.(10分)某些食品的包装袋内,放有装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。某同学对一袋久置空气中的干燥剂进行了探究。
他先取部分久置的干燥剂倒入适量水中,充分搅拌、过滤,得到白色固体和滤液。然后对滤液的酸碱性和白色固体的组成作了探究。
【实验探究一】探究滤液的酸碱性
该同学测定了滤液的酸碱性,你认为该滤液显________(填“酸性”“碱性”或“中性”)。
【实验探究二】探究白色固体的组成
该同学认为白色固体中可能含有的物质是CaO、Ca(OH)2、CaCO3。
他查阅有关资料得知:
CaO是一种白色固体,俗称生石灰,能与水反应生成氢氧化钙,并放出热量。氢氧化钙微溶于水。
【分析判断】你认为该白色固体中一定不含有的物质是______________。
【实验操作】下面是该同学设计的进一步探究白色固体组成的实验方案,请你和他一起完成实验报告。
实验操作
实验现象
实验结论
①取少量白色固体,倒入适量水,充分搅拌、静置;②向上层清液中滴加无色酚酞溶液
上层清液呈现_____色
白色固体中一定含有氢氧化钙
另取少量白色固体放入试管中,滴加稀盐酸
______________
白色固体中一定含有碳酸钙
【总结反思】
(1)只通过以上实验,还不能证明这袋久置于空气中的干燥剂中是否含有CaO。请用化学方程式表示原因______________________________________。
(2)请你简述一个证明这袋干燥剂中含有较多量CaO的简易实验:_______________________。
四、分析与计算(本题包括1小题,共12分)
23.实验室中有一包含有少量氧化铜的铜粉。同学们欲测定这包铜粉中单质铜的质量分数。现称取20
g样品放入烧杯中,逐滴滴入质量分数为10%的稀硫酸至固体不再减少,共用稀硫酸49
g。试计算:这包含有少量氧化铜的铜粉中单质铜的质量分数。
参考答案
一、识别与选择(本题包括15小题,每小题2分,共30分,每小题只用一个选项最符合题意)
1.B 2.C.
3.A.4.B.5.
A.6、A.
7.C
8.A
9.
C.
10.
D
11.B
12
A.
13、D。14、C
15.
D
二、理解与应用(本题包括4小题,共18分)
16、(8分):(1)H2CO3 (2)Ca(OH)2 (3)CaO (4)HCl
17、(8分)(1)红色褪去
(2)CuO+2HClCuCl2+H2O
(3)Mg、Al、Zn、Fe(或镁、铝、锌、铁,写一种即可)
(4)四
18、(1)熟石灰(或消石灰)
(2)Fe3O4
(3)CaO+H2OCa(OH)2
19、(10分)(1)
(2)红色固体逐渐减少,溶液变成黄色
(3)CO2+2NaOHNa2CO3+H2O、
NaOH+HClNaCl+H2O
20、(8分)(1)红 (2)2NaOH+CO2Na2CO3+H2O
(3)2NaOH+H2SO4Na2SO4+2H2O
Na+、S
三、试验与探究(本题包括2小题,共10分)
21、(8分)
【解析】【现象结论】根据甲、乙装置中的物质,可知甲装置中石灰水变浑浊,乙装置中无现象,因此可以用石灰水来检验二氧化碳的存在;比较甲、乙两装置的实验现象可以看出,乙中气球变化大,说明瓶内压强小,二氧化碳被吸收的多,则吸收CO2的量甲<乙;
【思考评价】另一位同学小李通过计算结果发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH,因此,他认为通常吸收CO2应该用饱和石灰水,小李的结论不正确,由于Ca(OH)2微溶于水,而NaOH易溶于水,Ca(OH)2的饱和溶液远没有等质量的NaOH的饱和溶液含溶质的质量多,因此也没有NaOH的饱和溶液吸收CO2的质量多,所以应用NaOH溶液吸收。
答案:【现象结论】CO2+Ca(OH)2CaCO3↓+H2O
CO2与石灰水作用有明显实验现象,与NaOH作用无明显现象
气球体积增大,溶液不变浑浊 乙
【思考评价】不正确,因为Ca(OH)2的溶解度很小,所形成的饱和石灰水中溶质的质量分数很小
22.(10分)
答案:碱性(或中性)CaO(或氧化钙或生石灰)
红 有无色、无味的气体放出
(1)CaO+H2OCa(OH)2
(2)取少量干燥剂于试管中,加入少量水、振荡,触摸试管壁,若有热感,证明有较多量CaO(答案合理即可)
四、分析与计算(本题包括1小题,共12分)
23.【解析】稀硫酸中溶质的质量为49
g×10%=4.9
g。
设氧化铜的质量为x。
H2SO4 + CuOCuSO4+H2O
98
80
4.9
g
x
=,x=4
g
所以混合物中铜单质的质量分数为×100%=80%。
答案:这包含有少量氧化铜的铜粉中单质铜的质量分数是80%。
测试时间:50分钟
满分为100分
有关相对原子质量:H-1 O-16 Na-23 S-32
Cl-35.5 Cu-64
一、识别与选择(本题包括15小题,每小题2分,共30分,每小题只用一个选项最符合题意)
1.化学实验室中的药品按物质类别分类放置
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )。下面是做“酸和碱的识别”实验时,实验桌上部分药品的摆放情况。小林取用了硫酸以后,应该把它放回的位置是( )。
2.下列家庭小实验不能成功的是( )。
A.用紫卷心菜制酸碱指示剂
B.用闻气味的方法鉴别白酒和白醋
C.用食盐水浸泡菜刀除去表面的锈斑
D.用果汁、小苏打、柠檬酸、凉开水等自制汽水
3.常温下,一些物质的pH如下,其中显酸性的物质是( )。
A.柠檬汁 pH=2
B.鸡蛋清 pH=8
C.蒸馏水 pH=7
D.肥皂水 pH=10
4.2.混有水蒸气的下列气体,既能用浓硫酸干燥,又能用固体氢氧化钠干燥的是( )
A.SO2 B.H2
C.CO2
D.HCl
5.实验室中下列药品敞口放置一段时间后,药品质量发生变化的原因与空气中CO2有关的一组是( )
①氢氧化钠固体 ②澄清石灰水
③浓盐酸
④浓硫酸
A.①②
B.①③
C.②④
D.①④
6、下列对实验意外事故的处理错误的是( )。
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%~5%的碳酸氢钠溶液
7.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是( )。
A.除去氯化钠溶液中的碳酸钠
B.除去铜粉中混有的铁粉
C.除去熟石灰中的石灰石
D.除去铁丝上的铁锈
8.推理是一种重要的研究和学习方法。下列推理正确的是( )。
A.碱中都含有氢氧根,所以碱中一定含有氢元素
B.分子是构成物质的微粒,因此物质都是由分子构成的
C.中和反应有盐和水生成,因此有盐和水生成的反应一定是中和反应
D.铁丝能在氧气中燃烧,空气中有氧气,所以铁丝也能在空气中燃烧
9.
碱溶液中都含
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )有OH-,因此不同的碱表现出一些共同的性质。下列关于Ba(OH)2性质的描述中不属于碱的共同性质的是( )。
A.能使紫色石蕊溶液变蓝色
B.能与盐酸反应生成水
C.能与Na2SO4溶液反应生成BaSO4沉淀
D.能与CO2反应生成水
10.玻璃中含有二氧化硅(SiO2),该物质
( http: / / www.21cnjy.com"
\o
"欢迎登陆21世纪教育网 )在一定条件下能与NaOH溶液发生反应,生成具有黏合性能的Na2SiO3溶液(俗称水玻璃)。下列有关说法正确的是( )。
A.水玻璃属于纯净物
B.水玻璃和玻璃属于同种物质
C.二氧化硅与氢氧化钠发生中和反应
D.NaOH溶液不能用带磨口玻璃塞的试剂瓶盛装
11.下表是部分常见物质的pH,在这些物质中,能使紫色石蕊溶液变蓝的是( )
物质
厕所清洁剂
橘汁
草木灰水
柠檬汁
pH
1.7
3.5
10.6
2.5
A.厕所清洁剂
B.草木灰水
C.柠檬汁
D.橘汁
12.将一大烧杯倒扣在培养皿上,培养皿上所放物质如下图所示。下列对有关实验现象的描述肯定不正确的是( )。
A.Ⅰ处溶液变蓝
B.Ⅱ处溶液变浑浊
C.Ⅲ处溶液颜色逐渐变浅
D.Ⅳ处试纸变红
13、要完成下列变化,能通过盐酸一步反应实现的是( )
①CaCO3→CaCl2
②Fe2O3→FeCl2
③Cu(OH)2→CuCl2
④Fe→FeCl3
A.①④
B.②③
C.③④
D.①③
14、下列四个图像能正确反映其对应实验操作的是( C )。
HYPERLINK
"http://www.21cnjy.com"
\o
"欢迎登陆21世纪教育网"
INCLUDEPICTURE
"../../../"
\
MERGEFORMAT
A.①高温煅烧一定质量的石灰石
B.②用等质量、等浓度的双氧水分别制取氧气
C.③向一定体积的稀盐酸中逐滴加入氢氧化钠溶液
D.④某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
15.除去下列各组物质中的少量杂质,所用方法正确的是( )
选项
物质
杂质
除杂方法
A
Cu
CuO
在空气中灼烧
B
CaO
Ca(OH)2
加入足量的稀盐酸
C
H2
CO
通入O2,点燃
D
O2
H2O
通过浓硫酸洗气
二、理解与应用(本题包括5小题,共40分)
16、(8分)选择H、C、Cl、O、Ca五种元素中的适当元素,组成符合下列要求的物质,将化学式填在空格中:
(1)雪碧饮料中含有的酸__________________________________________;
(2)用于改良酸性土壤的碱________________________________________;
(3)可用作干燥剂的氧化物________________________________________;
(4)人胃内帮助消化的酸__________________________________________。
17、(8分)为验证“酸的化学通性”,某班同学在实验室进行如下实验。请分析并回答相关问题(Na2CO3和CaCO3的化学性质相似):
(1)写出能证明A中反应发生的现象___________________________________。
(2)写出上述实验中酸与金属氧化物反应的化学方程式___________________。
(3)要全面验证酸的化学通性,D试管中能与酸反应的固体单质是________(写一种即可)。
(4)实验完成后,将全部废液倒入废液缸内,测得pH=2,则废液中所含溶质最多有_______种(溶质不计指示剂与气体)。
18、(6分)如图所示,A~H是初中化学常见的物质。A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂,Y为单质。根据图示回答下列问题:
(1)B的俗称为________。
(2)H的化学式为________。
(3)反应②的化学方程式为________________________________________。
19、(10分)用五个圆表示A(氧化铁)、B(稀盐酸)、C(二氧化碳)、D(碳酸钙)、E(氢氧化钠溶液)五种物质,用两圆相切表示两种物质可以发生反应。
请回答下列问题:
(1)将C、D、E三个圆画到图中适当的位置,并标出物质(或溶质)的化学式。
(2)写出A与B反应的现象________________________。
(3)写出有氢氧化钠参加反应的化学方程式_____________________________。
20、(8分)归纳总结是学习化学的重要方法,小明同学用图1总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
(1)为了验证反应①,小明将无色酚酞溶液滴入NaOH溶液中,溶液变成________色。
(2)依据反应②说明NaOH必须密封保存,否则在空气中要变质,其化学方程式为______________________。
(3)小明用微观示意图(图2)来说明反应③的发生,用化学方程式表示为_______________;从该图可以看出,反应前后没有发生变化的微观粒子有_______________。
三、试验与探究(本题包括2小题,共18分)
21、(8分)【发现问题】研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液。
【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液。实验装置和现象如图所示,请你一起参与。
【现象结论】甲装置中产生的实验现象______________(用化学方程式表示),
解释通常用石灰水而不用浓NaOH溶液检验CO2的原因______________________;
乙装置中的实验现象是_______________________________________________,
吸收CO2较多的装置是_____________。
【计算验证】另一位同学小李通过计算发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH。因此,他认为通常吸收CO2应该用饱和石灰水。
【思考评价】请你对小李同学的结论进行评价:______________________。
22.(10分)某些食品的包装袋内,放有装有白色颗粒状固体的小纸袋,上面写着“干燥剂,主要成分为生石灰”。某同学对一袋久置空气中的干燥剂进行了探究。
他先取部分久置的干燥剂倒入适量水中,充分搅拌、过滤,得到白色固体和滤液。然后对滤液的酸碱性和白色固体的组成作了探究。
【实验探究一】探究滤液的酸碱性
该同学测定了滤液的酸碱性,你认为该滤液显________(填“酸性”“碱性”或“中性”)。
【实验探究二】探究白色固体的组成
该同学认为白色固体中可能含有的物质是CaO、Ca(OH)2、CaCO3。
他查阅有关资料得知:
CaO是一种白色固体,俗称生石灰,能与水反应生成氢氧化钙,并放出热量。氢氧化钙微溶于水。
【分析判断】你认为该白色固体中一定不含有的物质是______________。
【实验操作】下面是该同学设计的进一步探究白色固体组成的实验方案,请你和他一起完成实验报告。
实验操作
实验现象
实验结论
①取少量白色固体,倒入适量水,充分搅拌、静置;②向上层清液中滴加无色酚酞溶液
上层清液呈现_____色
白色固体中一定含有氢氧化钙
另取少量白色固体放入试管中,滴加稀盐酸
______________
白色固体中一定含有碳酸钙
【总结反思】
(1)只通过以上实验,还不能证明这袋久置于空气中的干燥剂中是否含有CaO。请用化学方程式表示原因______________________________________。
(2)请你简述一个证明这袋干燥剂中含有较多量CaO的简易实验:_______________________。
四、分析与计算(本题包括1小题,共12分)
23.实验室中有一包含有少量氧化铜的铜粉。同学们欲测定这包铜粉中单质铜的质量分数。现称取20
g样品放入烧杯中,逐滴滴入质量分数为10%的稀硫酸至固体不再减少,共用稀硫酸49
g。试计算:这包含有少量氧化铜的铜粉中单质铜的质量分数。
参考答案
一、识别与选择(本题包括15小题,每小题2分,共30分,每小题只用一个选项最符合题意)
1.B 2.C.
3.A.4.B.5.
A.6、A.
7.C
8.A
9.
C.
10.
D
11.B
12
A.
13、D。14、C
15.
D
二、理解与应用(本题包括4小题,共18分)
16、(8分):(1)H2CO3 (2)Ca(OH)2 (3)CaO (4)HCl
17、(8分)(1)红色褪去
(2)CuO+2HClCuCl2+H2O
(3)Mg、Al、Zn、Fe(或镁、铝、锌、铁,写一种即可)
(4)四
18、(1)熟石灰(或消石灰)
(2)Fe3O4
(3)CaO+H2OCa(OH)2
19、(10分)(1)
(2)红色固体逐渐减少,溶液变成黄色
(3)CO2+2NaOHNa2CO3+H2O、
NaOH+HClNaCl+H2O
20、(8分)(1)红 (2)2NaOH+CO2Na2CO3+H2O
(3)2NaOH+H2SO4Na2SO4+2H2O
Na+、S
三、试验与探究(本题包括2小题,共10分)
21、(8分)
【解析】【现象结论】根据甲、乙装置中的物质,可知甲装置中石灰水变浑浊,乙装置中无现象,因此可以用石灰水来检验二氧化碳的存在;比较甲、乙两装置的实验现象可以看出,乙中气球变化大,说明瓶内压强小,二氧化碳被吸收的多,则吸收CO2的量甲<乙;
【思考评价】另一位同学小李通过计算结果发现,等质量的Ca(OH)2和NaOH吸收CO2的质量,Ca(OH)2大于NaOH,因此,他认为通常吸收CO2应该用饱和石灰水,小李的结论不正确,由于Ca(OH)2微溶于水,而NaOH易溶于水,Ca(OH)2的饱和溶液远没有等质量的NaOH的饱和溶液含溶质的质量多,因此也没有NaOH的饱和溶液吸收CO2的质量多,所以应用NaOH溶液吸收。
答案:【现象结论】CO2+Ca(OH)2CaCO3↓+H2O
CO2与石灰水作用有明显实验现象,与NaOH作用无明显现象
气球体积增大,溶液不变浑浊 乙
【思考评价】不正确,因为Ca(OH)2的溶解度很小,所形成的饱和石灰水中溶质的质量分数很小
22.(10分)
答案:碱性(或中性)CaO(或氧化钙或生石灰)
红 有无色、无味的气体放出
(1)CaO+H2OCa(OH)2
(2)取少量干燥剂于试管中,加入少量水、振荡,触摸试管壁,若有热感,证明有较多量CaO(答案合理即可)
四、分析与计算(本题包括1小题,共12分)
23.【解析】稀硫酸中溶质的质量为49
g×10%=4.9
g。
设氧化铜的质量为x。
H2SO4 + CuOCuSO4+H2O
98
80
4.9
g
x
=,x=4
g
所以混合物中铜单质的质量分数为×100%=80%。
答案:这包含有少量氧化铜的铜粉中单质铜的质量分数是80%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
