2017-2018年四川省古蔺县蔺阳中学人教版高三化学选修四第四章第一节原电池 课件 (共55张PPT)
文档属性
| 名称 | 2017-2018年四川省古蔺县蔺阳中学人教版高三化学选修四第四章第一节原电池 课件 (共55张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-12 00:00:00 | ||
图片预览








文档简介
课件55张PPT。[2018备考·最新考纲]
1.理解原电池的构成、工作原理及应用。2.能写出电极反应式和电池反应方程式。3.了解常见化学电源的种类及其工作原理。课时2 原电池 化学电源1.原电池的概念:将___________________的装置。
2.原电池的构成条件
(1)能自发地发生氧化还原反应。
(2)两个____________的电极(材料可以是金属或导电的非金属)。
①负极:活泼性较强的金属。
②正极:活泼性较弱的金属或能导电的非金属。
(3)电极均插入电解质溶液中。
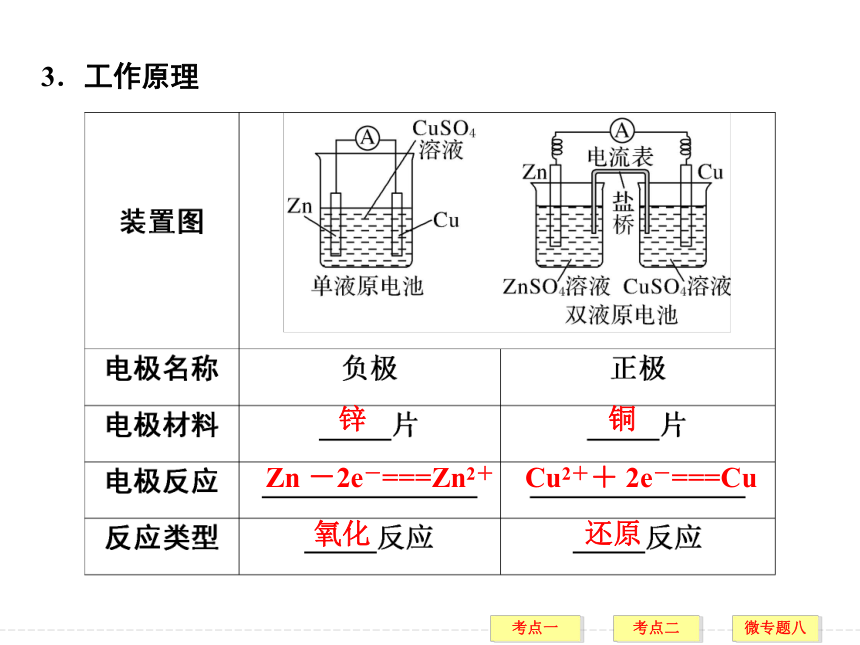
(4)构成_________(两电极接触或用导线连接)。考点一 原电池的工作原理及其应用(考点层次A→自学、识记、辨析)化学能转化为电能 活泼性不同 闭合回路 3.工作原理锌铜Zn -2e-===Zn2+Cu2++ 2e-===Cu氧化 还原 锌铜负极 正极 Zn + Cu2+===Zn2++ Cu4.原电池原理的三大应用
(1)加快氧化还原反应的速率
一个______进行的氧化还原反应,设计成原电池时反应速率______。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
(2)比较金属活动性强弱
两种金属分别作原电池的两极时,一般作______的金属比作______的金属活泼。
(3)设计制作化学电源
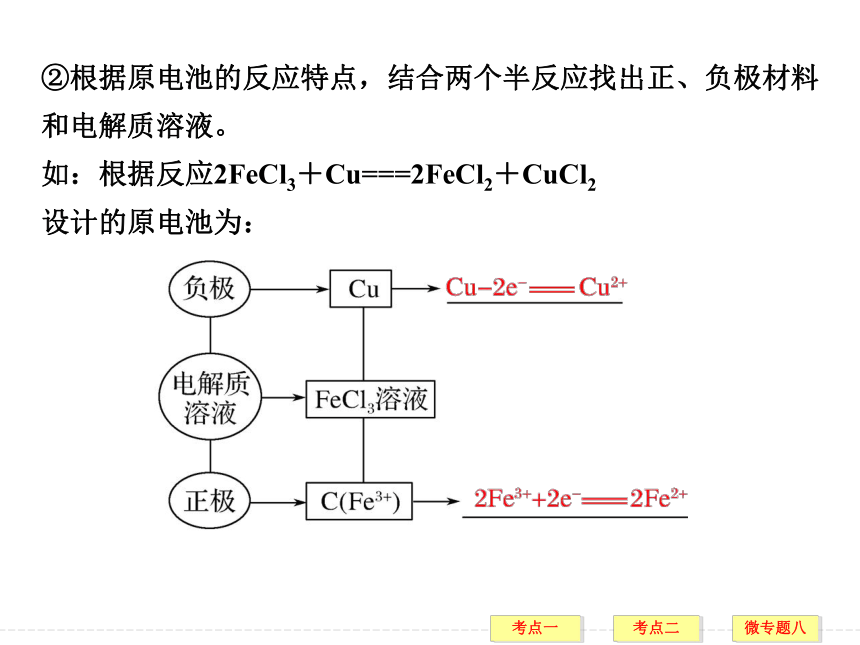
①首先将氧化还原反应分成两个半反应。自发 增大 负极 正极 ②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
如:根据反应2FeCl3+Cu===2FeCl2+CuCl2
设计的原电池为:1.(RJ选修4·P734改编)当铜锌原电池产生电流时,下列说法正确的是( )
A.阳离子移向Zn极,阴离子移向Cu极
B.电子由Cu电极流向Zn电极
C.电流由Zn电极流向Cu电极
D.阴离子移向Zn电极,阳离子移向Cu电极
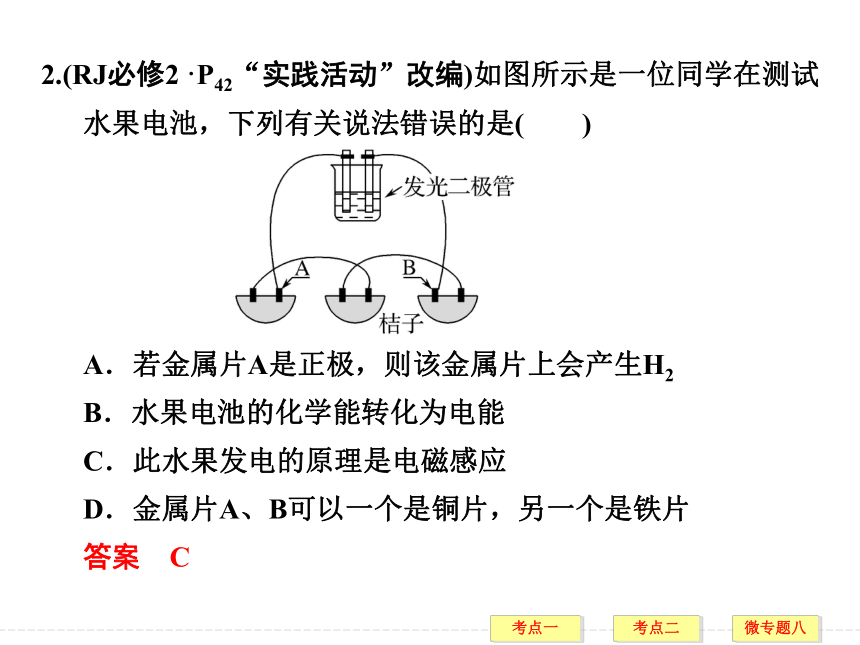
答案 D2.(RJ必修2·P42“实践活动”改编)如图所示是一位同学在测试水果电池,下列有关说法错误的是( )
A.若金属片A是正极,则该金属片上会产生H2
B.水果电池的化学能转化为电能
C.此水果发电的原理是电磁感应
D.金属片A、B可以一个是铜片,另一个是铁片
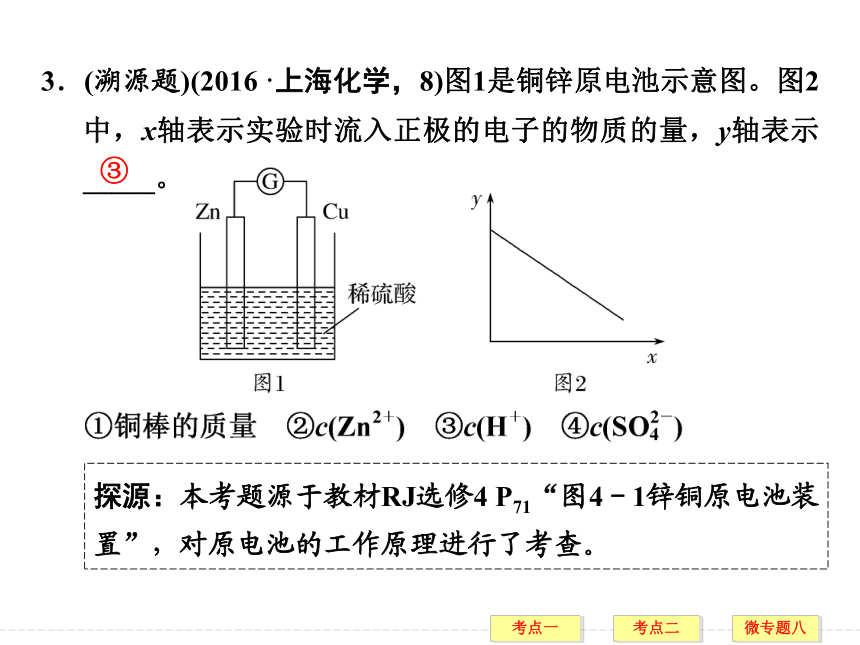
答案 C3.(溯源题)(2016·上海化学,8)图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示_____。③ 探源:本考题源于教材RJ选修4 P71“图4-1锌铜原电池装置”,对原电池的工作原理进行了考查。1.基础知识判断,正确的打“√”,错误的打“×”
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)在原电池中,负极材料的活泼性一定比正极材料强( )
(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )
(4)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )[诊断性题组] √××√(5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )
(6)CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能( )
(7)在内电路中,电子由正极流向负极( )
(8)某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液( )××××2.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-===H2↑
解析 (1)中Mg作负极;(2)中Al作负极;(3)中铜作负极;(4)是铁的吸氧腐蚀,Cu作正极,电极反应式为O2+2H2O+4e-===4OH-。
答案 B3.(2017·广东粤西四校联考)铜锌原电池(如图)工作时,下列叙述正确的是( )
A.一段时间后,铜棒上有红色物质析出
B.正极反应为:Zn-2e-===Zn2+
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液解析 Cu为正极,电极反应为Cu2++2e-===Cu,铜棒上有红色物质析出,A项正确,B项错误;在外电路中,电流从正极流向负极,C项错误;CuSO4溶液中c(Cu2+)降低,故盐桥中的K+移向CuSO4溶液,D项错误。
答案 A4.某学校研究性学习小组欲以镁条、铝片为电极,以稀NaOH溶液为电解质溶液设计原电池。
(1)给你一只电流表,请你画出该原电池的示意图,并标出正负极。(2)一段时间后,铝片发生的电极反应式是__________________________________________________;
镁条表面只有极少量的气泡产生,则镁电极产生的主要反应的电极反应式为______________________________________。
解析 铝能够与NaOH溶液反应,所以作原电池的负极,而镁与NaOH溶液不反应,故作原电池的正极。规避原电池基础中的6个失分点
1.原电池的闭合回路有多种形式,如两电极相接触也是一种闭合。
2.盐桥使两池电解液相连接,构成闭合,但不能用导线替换。
3.只有放热的氧化还原反应才能设计成原电池,把多余的能量转化成电能。【易错警示】4.在原电池中,电子不能通过电解质溶液。
5.电解液中的阴阳离子与导线中的电子各自的定向移动,构成一个完整的闭合回路,电子由负极移向正极,电解液中阳离子移向正极,阴离子移向负极。
6.两个电极即使都是石墨,也可构成原电池,如一些燃料电池。1.一次电池考点二 形形色色的化学电源(考点层次B→共研、理解、整合)Zn+2OH--2e-===Zn(OH)2 2.二次电池
铅蓄电池是最常见的二次电池,总反应为3.燃料电池
氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种:2H2-4e-===4H+2H2+4OH--4e-===4H2OO2+4H++4e-===2H2OO2+2H2O+4e-===4OH- 1.(RJ选修4·P781改编)碱性锌锰电池总反应为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,则其正极反应为__________________________________。MnO2+H2O+e-===MnOOH+OH- 3.(溯源题)(2016·课标全国Ⅱ,11)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。判断下列说法是否正确
(1)负极反应式为Mg-2e-===Mg2+( )
(2)正极反应式为Ag++e-===Ag( )
(3)电池放电时Cl-由正极向负极迁移( )
(4)负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑( )√×√√探源:本考题源于RJ选修4 P75“一次电池”及其知识拓展,对常见及新型电源的工作原理及电极反应进行了考查。题组一 “常考不衰”的燃料电池
1.科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )[拓展性题组] 2.(2017·惠州模拟)金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )A.放电时,空气极为负极
B.放电时,电池反应为4Li+O2===2Li2O
C.有机电解液可以是乙醇等无水有机物
D.在更换锂电极的同时,要更换水性电解液
解析 A.放电时,Li极为负极,错误;B.放电时,电池反应为4Li+O2+2H2O===4LiOH,错误;C.因为有锂存在,就不能用乙醇,锂和乙醇反应,错误;D.水性电解液中有沉淀生成,所以在更换锂电极的同时,要更换水性电解液,正确,所以选D。
答案 D3.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )A.电流由O2所在的铂电极流出
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应式为:CH3CH2OH+3H2O-12e-=== 2CO2↑+12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量解析 燃料电池,燃料在负极反应,氧气在正极反应。氧气在正极发生还原反应,电流由正极流向负极,A、B正确;由图可知负极反应物为CH3CH2OH(碳元素的化合价平均显-2价),生成物为CH3COOH(碳元素的化合价平均显0价),由质子交换膜可知溶液呈酸性,负极的电极反应式为:CH3CH2OH-4e-+H2O===CH3COOH+4H+,C项错误。
答案 C燃料电池电极方程式书写步骤
【思维建模】解析 A项,该电池的电解质溶液不能是LiCl的水溶液,因为Li能和水发生反应,错误;B项,电池放电时,负极发生氧化反应,错误;D项,放电时,电子从负极经外电路流向正极,电解质溶液中移动的是阴、阳离子而不是电子,错误。
答案 C以上述第5题为例:
【审题建模】1.(2017·河北石家庄高三模拟)综合如图判断,下列说法正确的是( )微专题 八 “盐桥”原电池明原理判装置A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大解析 装置Ⅰ中,由于Zn比Fe活泼,所以Zn作原电池的负极,电极反应式为Zn-2e-===Zn2+;Fe作正极,电极反应式为O2+2H2O+4e-===4OH-。由于正极有OH-生成,因此溶液的pH增大。装置Ⅱ中,Fe作负极,电极反应式为Fe-2e-===Fe2+;Cu作正极,电极反应式为2H++2e-===H2↑。正极由于不断消耗H+,所以溶液的pH逐渐增大。据此可知A、B错,D正确。在原电池的电解质溶液中,阳离子移向正极,所以C错误。
答案 D2.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是( )盐桥电池的两大特点
1.盐桥的作用:连接内电路,形成闭合回路,平衡电荷,使原电池不断产生电流,避免断路时发生化学腐蚀(隔离作用)。
2.盐桥中有关电极的判断:同原电池电极的判断一致,还原剂在负极区,而氧化剂在正极区。对于活泼金属和不活泼金属,则活泼金属作负极,不活泼金属作正极;对于金属与非金属,则是金属作负极,非金属作正极;对于还原性不同的物质,则是还原性强的作负极,还原性弱的作正极。【知识归纳】可逆反应中的“盐桥”A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C.电流表读数为零时,反应达到化学平衡状态
D.两次电流表指针偏转方向相反Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流表指针均发生偏转。
试回答下列问题:
(1)两次操作过程中指针为什么发生偏转?
__________________________________________________。
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。__________________________________。
(3)操作Ⅱ过程中,盐桥中的K+移向________烧杯溶液(填“A”或“B”)。
(4)Ⅰ操作过程中,C1棒上发生的反应为_______________。【对比归纳】
单池原电池和盐桥原电池的对比图1和图2两装置的比较:
1.理解原电池的构成、工作原理及应用。2.能写出电极反应式和电池反应方程式。3.了解常见化学电源的种类及其工作原理。课时2 原电池 化学电源1.原电池的概念:将___________________的装置。
2.原电池的构成条件
(1)能自发地发生氧化还原反应。
(2)两个____________的电极(材料可以是金属或导电的非金属)。
①负极:活泼性较强的金属。
②正极:活泼性较弱的金属或能导电的非金属。
(3)电极均插入电解质溶液中。
(4)构成_________(两电极接触或用导线连接)。考点一 原电池的工作原理及其应用(考点层次A→自学、识记、辨析)化学能转化为电能 活泼性不同 闭合回路 3.工作原理锌铜Zn -2e-===Zn2+Cu2++ 2e-===Cu氧化 还原 锌铜负极 正极 Zn + Cu2+===Zn2++ Cu4.原电池原理的三大应用
(1)加快氧化还原反应的速率
一个______进行的氧化还原反应,设计成原电池时反应速率______。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
(2)比较金属活动性强弱
两种金属分别作原电池的两极时,一般作______的金属比作______的金属活泼。
(3)设计制作化学电源
①首先将氧化还原反应分成两个半反应。自发 增大 负极 正极 ②根据原电池的反应特点,结合两个半反应找出正、负极材料和电解质溶液。
如:根据反应2FeCl3+Cu===2FeCl2+CuCl2
设计的原电池为:1.(RJ选修4·P734改编)当铜锌原电池产生电流时,下列说法正确的是( )
A.阳离子移向Zn极,阴离子移向Cu极
B.电子由Cu电极流向Zn电极
C.电流由Zn电极流向Cu电极
D.阴离子移向Zn电极,阳离子移向Cu电极
答案 D2.(RJ必修2·P42“实践活动”改编)如图所示是一位同学在测试水果电池,下列有关说法错误的是( )
A.若金属片A是正极,则该金属片上会产生H2
B.水果电池的化学能转化为电能
C.此水果发电的原理是电磁感应
D.金属片A、B可以一个是铜片,另一个是铁片
答案 C3.(溯源题)(2016·上海化学,8)图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示_____。③ 探源:本考题源于教材RJ选修4 P71“图4-1锌铜原电池装置”,对原电池的工作原理进行了考查。1.基础知识判断,正确的打“√”,错误的打“×”
(1)在原电池中,发生氧化反应的一极一定是负极( )
(2)在原电池中,负极材料的活泼性一定比正极材料强( )
(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应( )
(4)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长( )[诊断性题组] √××√(5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生( )
(6)CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能( )
(7)在内电路中,电子由正极流向负极( )
(8)某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液( )××××2.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是( )A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-===Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-===H2↑
解析 (1)中Mg作负极;(2)中Al作负极;(3)中铜作负极;(4)是铁的吸氧腐蚀,Cu作正极,电极反应式为O2+2H2O+4e-===4OH-。
答案 B3.(2017·广东粤西四校联考)铜锌原电池(如图)工作时,下列叙述正确的是( )
A.一段时间后,铜棒上有红色物质析出
B.正极反应为:Zn-2e-===Zn2+
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液解析 Cu为正极,电极反应为Cu2++2e-===Cu,铜棒上有红色物质析出,A项正确,B项错误;在外电路中,电流从正极流向负极,C项错误;CuSO4溶液中c(Cu2+)降低,故盐桥中的K+移向CuSO4溶液,D项错误。
答案 A4.某学校研究性学习小组欲以镁条、铝片为电极,以稀NaOH溶液为电解质溶液设计原电池。
(1)给你一只电流表,请你画出该原电池的示意图,并标出正负极。(2)一段时间后,铝片发生的电极反应式是__________________________________________________;
镁条表面只有极少量的气泡产生,则镁电极产生的主要反应的电极反应式为______________________________________。
解析 铝能够与NaOH溶液反应,所以作原电池的负极,而镁与NaOH溶液不反应,故作原电池的正极。规避原电池基础中的6个失分点
1.原电池的闭合回路有多种形式,如两电极相接触也是一种闭合。
2.盐桥使两池电解液相连接,构成闭合,但不能用导线替换。
3.只有放热的氧化还原反应才能设计成原电池,把多余的能量转化成电能。【易错警示】4.在原电池中,电子不能通过电解质溶液。
5.电解液中的阴阳离子与导线中的电子各自的定向移动,构成一个完整的闭合回路,电子由负极移向正极,电解液中阳离子移向正极,阴离子移向负极。
6.两个电极即使都是石墨,也可构成原电池,如一些燃料电池。1.一次电池考点二 形形色色的化学电源(考点层次B→共研、理解、整合)Zn+2OH--2e-===Zn(OH)2 2.二次电池
铅蓄电池是最常见的二次电池,总反应为3.燃料电池
氢氧燃料电池是目前最成熟的燃料电池,可分为酸性和碱性两种:2H2-4e-===4H+2H2+4OH--4e-===4H2OO2+4H++4e-===2H2OO2+2H2O+4e-===4OH- 1.(RJ选修4·P781改编)碱性锌锰电池总反应为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2,则其正极反应为__________________________________。MnO2+H2O+e-===MnOOH+OH- 3.(溯源题)(2016·课标全国Ⅱ,11)Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。判断下列说法是否正确
(1)负极反应式为Mg-2e-===Mg2+( )
(2)正极反应式为Ag++e-===Ag( )
(3)电池放电时Cl-由正极向负极迁移( )
(4)负极会发生副反应Mg+2H2O===Mg(OH)2+H2↑( )√×√√探源:本考题源于RJ选修4 P75“一次电池”及其知识拓展,对常见及新型电源的工作原理及电极反应进行了考查。题组一 “常考不衰”的燃料电池
1.科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,下列说法不正确的是( )[拓展性题组] 2.(2017·惠州模拟)金属锂燃料电池是一种新型电池,比锂离子电池具有更高的能量密度。它无电时也无需充电,只需更换其中的某些材料即可,其工作示意图如下,下列说法正确的是( )A.放电时,空气极为负极
B.放电时,电池反应为4Li+O2===2Li2O
C.有机电解液可以是乙醇等无水有机物
D.在更换锂电极的同时,要更换水性电解液
解析 A.放电时,Li极为负极,错误;B.放电时,电池反应为4Li+O2+2H2O===4LiOH,错误;C.因为有锂存在,就不能用乙醇,锂和乙醇反应,错误;D.水性电解液中有沉淀生成,所以在更换锂电极的同时,要更换水性电解液,正确,所以选D。
答案 D3.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )A.电流由O2所在的铂电极流出
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应式为:CH3CH2OH+3H2O-12e-=== 2CO2↑+12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量解析 燃料电池,燃料在负极反应,氧气在正极反应。氧气在正极发生还原反应,电流由正极流向负极,A、B正确;由图可知负极反应物为CH3CH2OH(碳元素的化合价平均显-2价),生成物为CH3COOH(碳元素的化合价平均显0价),由质子交换膜可知溶液呈酸性,负极的电极反应式为:CH3CH2OH-4e-+H2O===CH3COOH+4H+,C项错误。
答案 C燃料电池电极方程式书写步骤
【思维建模】解析 A项,该电池的电解质溶液不能是LiCl的水溶液,因为Li能和水发生反应,错误;B项,电池放电时,负极发生氧化反应,错误;D项,放电时,电子从负极经外电路流向正极,电解质溶液中移动的是阴、阳离子而不是电子,错误。
答案 C以上述第5题为例:
【审题建模】1.(2017·河北石家庄高三模拟)综合如图判断,下列说法正确的是( )微专题 八 “盐桥”原电池明原理判装置A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大解析 装置Ⅰ中,由于Zn比Fe活泼,所以Zn作原电池的负极,电极反应式为Zn-2e-===Zn2+;Fe作正极,电极反应式为O2+2H2O+4e-===4OH-。由于正极有OH-生成,因此溶液的pH增大。装置Ⅱ中,Fe作负极,电极反应式为Fe-2e-===Fe2+;Cu作正极,电极反应式为2H++2e-===H2↑。正极由于不断消耗H+,所以溶液的pH逐渐增大。据此可知A、B错,D正确。在原电池的电解质溶液中,阳离子移向正极,所以C错误。
答案 D2.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,盐桥中装有饱和K2SO4溶液。下列叙述中正确的是( )盐桥电池的两大特点
1.盐桥的作用:连接内电路,形成闭合回路,平衡电荷,使原电池不断产生电流,避免断路时发生化学腐蚀(隔离作用)。
2.盐桥中有关电极的判断:同原电池电极的判断一致,还原剂在负极区,而氧化剂在正极区。对于活泼金属和不活泼金属,则活泼金属作负极,不活泼金属作正极;对于金属与非金属,则是金属作负极,非金属作正极;对于还原性不同的物质,则是还原性强的作负极,还原性弱的作正极。【知识归纳】可逆反应中的“盐桥”A.开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B.开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C.电流表读数为零时,反应达到化学平衡状态
D.两次电流表指针偏转方向相反Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流表指针均发生偏转。
试回答下列问题:
(1)两次操作过程中指针为什么发生偏转?
__________________________________________________。
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。__________________________________。
(3)操作Ⅱ过程中,盐桥中的K+移向________烧杯溶液(填“A”或“B”)。
(4)Ⅰ操作过程中,C1棒上发生的反应为_______________。【对比归纳】
单池原电池和盐桥原电池的对比图1和图2两装置的比较:
