2017-2018年浙江省苍南中学高中化学苏教版必修二课件1.3.1 离子键 (共13张PPT)
文档属性
| 名称 | 2017-2018年浙江省苍南中学高中化学苏教版必修二课件1.3.1 离子键 (共13张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 547.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-14 00:00:00 | ||
图片预览





文档简介
课件13张PPT。离子键问题1:人们已经发现和合成了二千多万种物质,为什么仅仅一百多种元素的原子能够形成这么多种形形色色的物质呢?问题2:原子是怎样互相结合的呢?问题3:为什么两个氢原子可以结合成氢分子,而两个氦原子却不能结合?问题4:原子结合成分子后,性质为什么
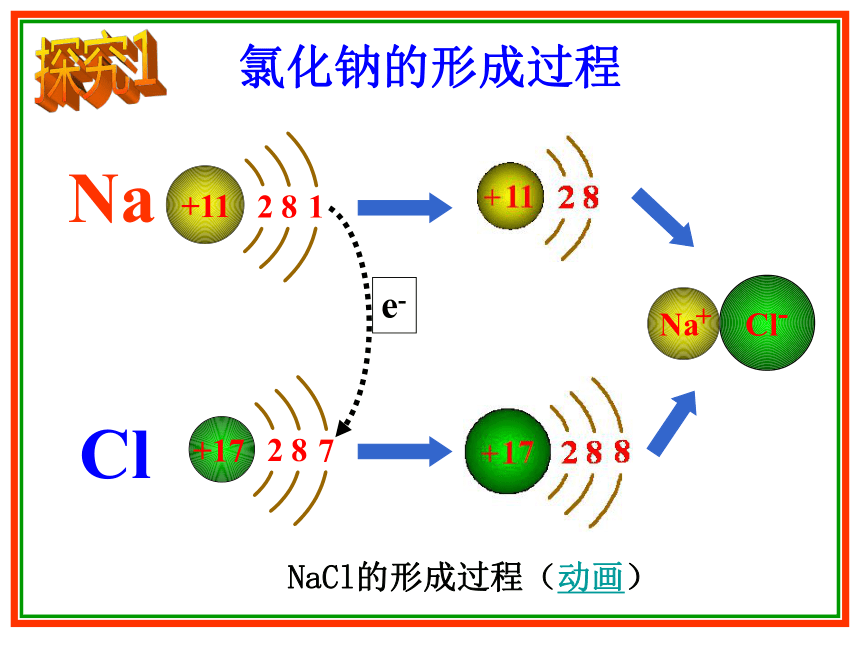
相差很大?氯化钠的形成过程NaCl的形成过程(动画)探究1一、离子键 使阴、阳离子结合成化合物的静电作用叫做离子键4.哪些元素的原子之间可能形成离子键?1.离子键形成的原因是什么?3.在离子化合物中,离子间有哪些作用?2.形成离子键的微粒是什么?原子结构不稳定,易得、失电子形成阴、阳离子阴、阳离子静电引力和静电斥力(统称静电作用)活泼金属与活泼非金属第ⅠA族、第ⅡA族的金属卤素及O、S等讨论 观察以下示例,归纳 电子式的书写规则探究2二.电子式的书写1.在元素符号周围用小点(或× )来表示原子最外层电子的式子就是该原子的电子式。试写以下微粒和物质的电子式: Ca 、 Cl
Ca2+、Cl –
CaCl2 K 、 F
K+、F –
KF Na 、S
Na+、S2 –
Na2S Mg、O
Mg2+、O2 –
MgO[思考与讨论]1.通常情况下,哪些元素之间最易形成离子化合物? 2.离子键是一种什么性质的 相互作用?3.离子化合物溶于水或熔化时离子键是否发生变化?活泼金属与活泼非金属阴阳离子间的静电作用 (静电吸引=静电排斥)转化成自由移动的离子,离子键即被破坏。4.由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系? (1)NaF NaCl NaBr NaI ---988℃ 801℃ 740℃ 660℃ (2)NaF CaF2 CaO ----988℃ 1360℃ 2614℃ (提示:Ca2+半径略大于Na+半径)离子半径越小、离子所带电荷越多,离子键就越强。离子半径大小比较规律
1、阳离子半径<相应的原子半径;
如:Na+ 2、阴离子半径>相应的原子半径;
如:Cl->Cl
3、同一主族元素,从上到下,
离子半径逐渐增大;如:
Li+ 4、具有相同电子层结构的离子,
核电荷数越多离子半径越小
如:O2-> F-> Na+> Mg2+1.下列说法正确的是( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
2.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16 C. 11与17 D.14与8
3. xy型的离子化合物,x、Y所在的族分别为 ;
xy2型的离子化合物,x、Y所在的族为 ;
4. 离子化合物溶于水或熔化时离子键是否发生变化?
CC试一试第ⅠA族和第ⅦA族;第ⅡA族和第ⅥA族第ⅡA族和第ⅦA族电离成自由移动的离子,离子键被破坏。阴离子阳离子用电子式表示离子化合物小结在通常情况下,氯化钠是晶体。在氯化钠晶体中,每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子。钠离子和氯离子就是按照这种排列方式向空间各个方向伸展,形成氯化钠晶体。资料
(1)搜集材料,自制一个氯化钠晶体结构模型。
(2)在氯化钠晶体中Na+与Cl- 的个数比是几比几? 晶体中是否存在单个的“NaCl”分子?
(3)在氯化钠晶体中与Na+ 最近且等距离的Na+有几个?
思考与探索
相差很大?氯化钠的形成过程NaCl的形成过程(动画)探究1一、离子键 使阴、阳离子结合成化合物的静电作用叫做离子键4.哪些元素的原子之间可能形成离子键?1.离子键形成的原因是什么?3.在离子化合物中,离子间有哪些作用?2.形成离子键的微粒是什么?原子结构不稳定,易得、失电子形成阴、阳离子阴、阳离子静电引力和静电斥力(统称静电作用)活泼金属与活泼非金属第ⅠA族、第ⅡA族的金属卤素及O、S等讨论 观察以下示例,归纳 电子式的书写规则探究2二.电子式的书写1.在元素符号周围用小点(或× )来表示原子最外层电子的式子就是该原子的电子式。试写以下微粒和物质的电子式: Ca 、 Cl
Ca2+、Cl –
CaCl2 K 、 F
K+、F –
KF Na 、S
Na+、S2 –
Na2S Mg、O
Mg2+、O2 –
MgO[思考与讨论]1.通常情况下,哪些元素之间最易形成离子化合物? 2.离子键是一种什么性质的 相互作用?3.离子化合物溶于水或熔化时离子键是否发生变化?活泼金属与活泼非金属阴阳离子间的静电作用 (静电吸引=静电排斥)转化成自由移动的离子,离子键即被破坏。4.由下列离子化合物熔点变化规律 ,分析离子键的强弱与离子半径、离子电荷有什么关系? (1)NaF NaCl NaBr NaI ---988℃ 801℃ 740℃ 660℃ (2)NaF CaF2 CaO ----988℃ 1360℃ 2614℃ (提示:Ca2+半径略大于Na+半径)离子半径越小、离子所带电荷越多,离子键就越强。离子半径大小比较规律
1、阳离子半径<相应的原子半径;
如:Na+
如:Cl->Cl
3、同一主族元素,从上到下,
离子半径逐渐增大;如:
Li+
核电荷数越多离子半径越小
如:O2-> F-> Na+> Mg2+1.下列说法正确的是( )
A.离子键就是阴阳离子间的静电引力
B.所有金属元素与所有非金属元素间都能形成离子键
C.钠原子与氯原子结合成氯化钠后体系能量降低
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
2.下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A.10与19 B.6与16 C. 11与17 D.14与8
3. xy型的离子化合物,x、Y所在的族分别为 ;
xy2型的离子化合物,x、Y所在的族为 ;
4. 离子化合物溶于水或熔化时离子键是否发生变化?
CC试一试第ⅠA族和第ⅦA族;第ⅡA族和第ⅥA族第ⅡA族和第ⅦA族电离成自由移动的离子,离子键被破坏。阴离子阳离子用电子式表示离子化合物小结在通常情况下,氯化钠是晶体。在氯化钠晶体中,每个氯离子的周围都有6个钠离子,每个钠离子的周围也有6个氯离子。钠离子和氯离子就是按照这种排列方式向空间各个方向伸展,形成氯化钠晶体。资料
(1)搜集材料,自制一个氯化钠晶体结构模型。
(2)在氯化钠晶体中Na+与Cl- 的个数比是几比几? 晶体中是否存在单个的“NaCl”分子?
(3)在氯化钠晶体中与Na+ 最近且等距离的Na+有几个?
思考与探索
