2017-2018年浙江省苍南中学苏教版高中化学选修三3.4 分子间作用力 分子晶体 课件 (共27张PPT)
文档属性
| 名称 | 2017-2018年浙江省苍南中学苏教版高中化学选修三3.4 分子间作用力 分子晶体 课件 (共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 852.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-14 00:00:00 | ||
图片预览








文档简介
课件27张PPT。HH1.下列既含有离子键又含有共价键的化合物是( )
A.HI B.NaOH C.Br2 D.NaCl
2.下列电子式书写正确的是( )
A.∶N∶∶∶N∶ B.H∶N∶H
C.H+[∶O∶]2-H+ D.Na+[∶Cl∶]- BD 阴、阳离子通过离子键相互结合形成化合物,原子间通过共价键形成分子的过程中要放出能量。反之,要使离子键断裂或使气态分子中彼此结合的原子分开,使共价键断裂,则要吸收能量。想一想:
用化学键的观点来分析化学反应的本质
是什么? 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。议一议:
氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢不具有导电性。这是为什么?
【问题探究一】干冰气化现象是物理变化还是化学变化?干冰气化过程中有没有破坏其中的化学键?那为什么干冰气化过程仍要吸收能量呢? 分子间作用力
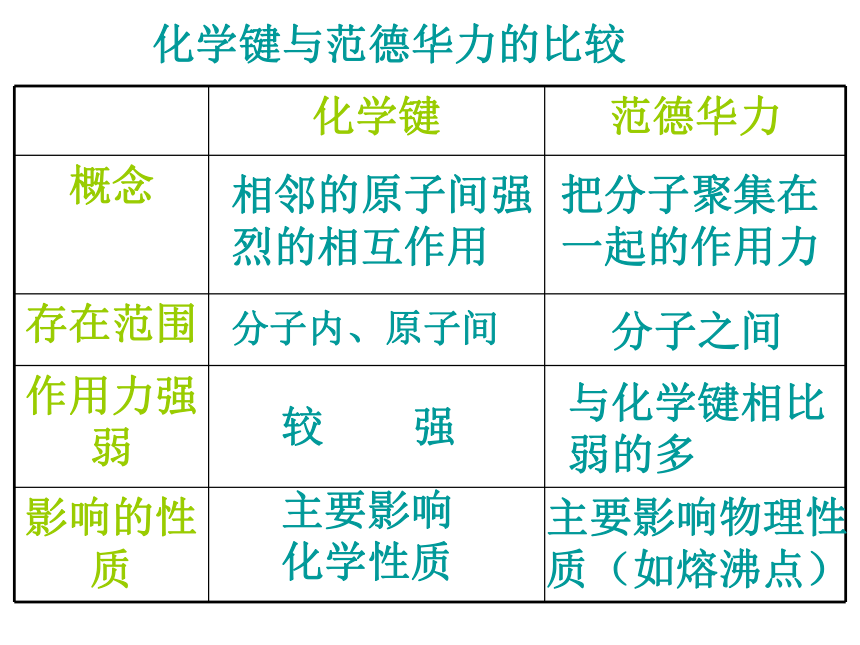
分子间作用力 分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力.常见的为范德华力和氢键【问题探究二】范德华力对物质哪些性质有影响?范德华力有什么特点?范德华力的特点1.广泛存在(由分子构成的物质)2.作用力弱3.主要影响物质的物理性质(熔沸点)相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内、原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与范德华力的比较离子键、共价键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4B【问题探究三】范德华力如何影响物质的物理性质?卤族元素单质物理性质差异【总结】比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te 氢 键1.氢键:静电作用力和一定程度的轨道重叠作用2.氢键的表示方法:X—H…Y3.氢键的形成条件:⑴有X-H共价键,X原子非金属性特强,原子半径很小,如F、O、N等。⑵ X—H…Y中的Y必须非金属性很强、原子半径很小、具有孤对电子。X、Y可以相同,也可以不同。4.氢键的特点:4.氢键的特点:4.氢键的特点:(1)作用力比范德华力大,但比化学键小得多
(2)一种特殊的分子间作用力,不是化学键
(3)具有方向性和饱和性
(4)存在范围:分子间或分子内5.氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高⑵氢键的存在使物质的溶解度增大(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。【问题探究四】下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱B固体冰中不存在的作用力是 ( )
A.离子键 B.极性键
C. 氢键 D. 范德华力 A D下列关于范德华力影响物质性质的叙述中,正确的是( )
A.范德华力是决定由分子构成物质熔、沸点高低的唯一因素
B.范德华力与物质的性质没有必然的联系
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力仅是影响物质部分物理性质的一种因素1、比较下列物质的熔、沸点高低,并且说明比较的依据。 (1)金刚石晶体,氯化钠晶体,干冰 (2)CCl4,CF4 ,CBr4 (3)HF , HCl , HI 2、解释氮气分子中含有氮氮叁键,键能很大,为什么熔沸点较低?思考题:
A.HI B.NaOH C.Br2 D.NaCl
2.下列电子式书写正确的是( )
A.∶N∶∶∶N∶ B.H∶N∶H
C.H+[∶O∶]2-H+ D.Na+[∶Cl∶]- BD 阴、阳离子通过离子键相互结合形成化合物,原子间通过共价键形成分子的过程中要放出能量。反之,要使离子键断裂或使气态分子中彼此结合的原子分开,使共价键断裂,则要吸收能量。想一想:
用化学键的观点来分析化学反应的本质
是什么? 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。议一议:
氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢不具有导电性。这是为什么?
【问题探究一】干冰气化现象是物理变化还是化学变化?干冰气化过程中有没有破坏其中的化学键?那为什么干冰气化过程仍要吸收能量呢? 分子间作用力
分子间作用力 分子间存在着将分子聚集在一起的作用力,这种作用力称为分子间作用力.常见的为范德华力和氢键【问题探究二】范德华力对物质哪些性质有影响?范德华力有什么特点?范德华力的特点1.广泛存在(由分子构成的物质)2.作用力弱3.主要影响物质的物理性质(熔沸点)相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内、原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与范德华力的比较离子键、共价键、分子间作用力都是微粒间的作用力。下列物质中,只存在一种作用力的是 ( )
A.干冰 B.NaCl C.NaOH
D.I2 E.H2SO4B【问题探究三】范德华力如何影响物质的物理性质?卤族元素单质物理性质差异【总结】比较下列物质的熔沸点的高低
CH4_ CF4 _ CCl4 _ CBr4 _ CI4
H2O_ H2S _ H2Se _ H2Te 氢 键1.氢键:静电作用力和一定程度的轨道重叠作用2.氢键的表示方法:X—H…Y3.氢键的形成条件:⑴有X-H共价键,X原子非金属性特强,原子半径很小,如F、O、N等。⑵ X—H…Y中的Y必须非金属性很强、原子半径很小、具有孤对电子。X、Y可以相同,也可以不同。4.氢键的特点:4.氢键的特点:4.氢键的特点:(1)作用力比范德华力大,但比化学键小得多
(2)一种特殊的分子间作用力,不是化学键
(3)具有方向性和饱和性
(4)存在范围:分子间或分子内5.氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高⑵氢键的存在使物质的溶解度增大(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。【问题探究四】下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4 、 SnH4的熔点随相对分子质量的增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱B固体冰中不存在的作用力是 ( )
A.离子键 B.极性键
C. 氢键 D. 范德华力 A D下列关于范德华力影响物质性质的叙述中,正确的是( )
A.范德华力是决定由分子构成物质熔、沸点高低的唯一因素
B.范德华力与物质的性质没有必然的联系
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力仅是影响物质部分物理性质的一种因素1、比较下列物质的熔、沸点高低,并且说明比较的依据。 (1)金刚石晶体,氯化钠晶体,干冰 (2)CCl4,CF4 ,CBr4 (3)HF , HCl , HI 2、解释氮气分子中含有氮氮叁键,键能很大,为什么熔沸点较低?思考题:
