选修4反应原理(热、电、速)综合练习1(4页)
文档属性
| 名称 | 选修4反应原理(热、电、速)综合练习1(4页) |  | |
| 格式 | zip | ||
| 文件大小 | 421.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-14 15:16:02 | ||
图片预览




文档简介
高二化学
反应原理——热、电、速综合练习1
一、单选题
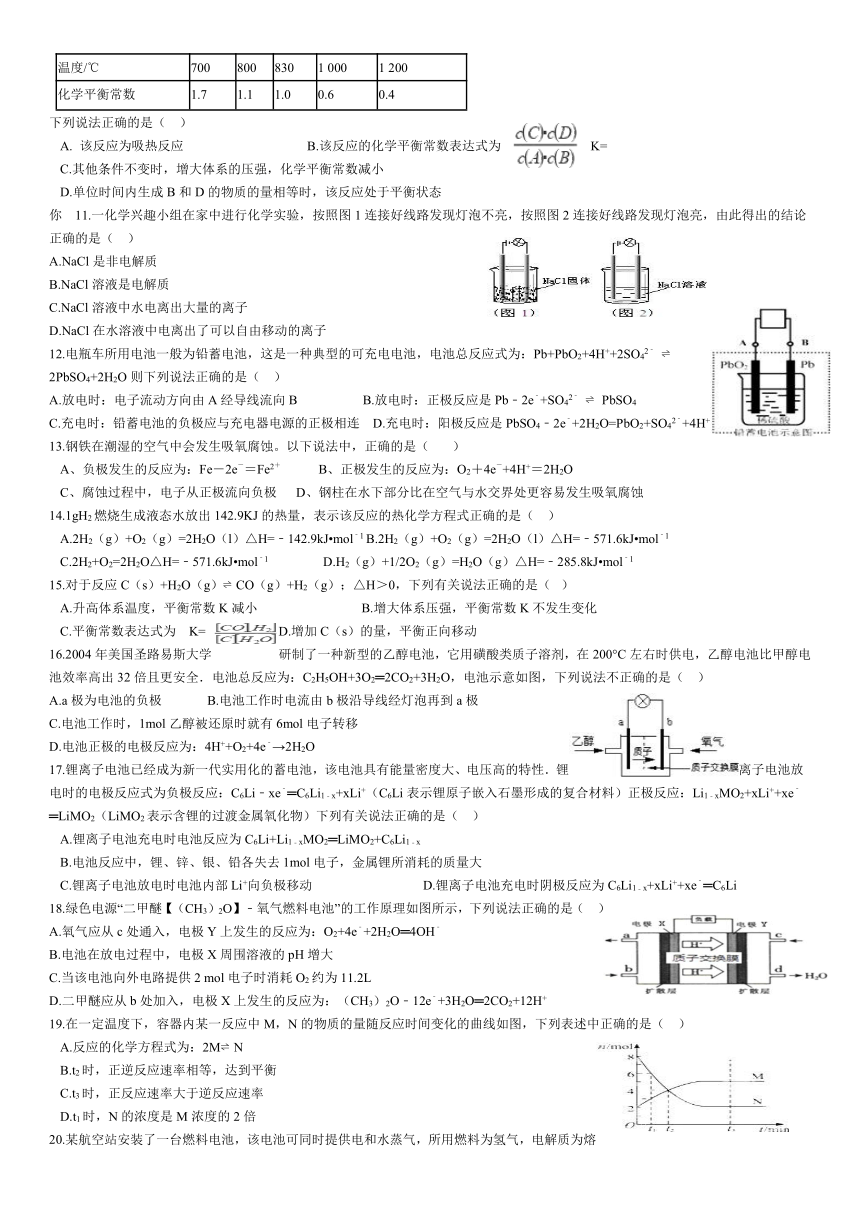
1.关于如图装置中的变化叙述错误的是(
)
A.电子从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.锌片上发生氧化反应
C.左侧碳棒上发生:2H2O+O2+4e→4OH﹣
D.铜电极析出铜
2.强酸与强碱的稀溶液发生中和反应的热效应为:
H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L
0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3
,
下列关系正确的是( )
A.△H1>△H2>△H3
B、△H1<△H2<△H3
C、△H1<△H2=△H3
D、△H1=△H2<△H3
3.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O===2Fe(OH)2;②4Fe(OH)2+O2+2H2O===4Fe(OH)3;③2Fe(OH)3===Fe2O3+3H2O。下列说法正确的是( )
A.钢铁在碱性条件下腐蚀生成铁锈,而在酸性条件下不生成铁锈
B.反应①中的氧化剂是氧气和水
C、上述反应表示钢铁发生的是吸氧腐蚀
D、钢铁在潮湿的空气中不能发生电化学腐蚀
4.下列说法正确的是( )
A.CH4(g)+
O2(g)═CO(g)+2H2O(l)△H═﹣a
kJ mol﹣1
,
这里△H代表燃烧热
B.在25℃、101kPa,1mol硫和2mol硫的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2
,
所以CO的燃烧反应一定是吸热反应
D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
5.在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)△H=﹣57kJ mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
6.下列原电池对应的电极反应式正确的是( )
A.硫酸铅蓄电池的负极:Pb﹣2e﹣═Pb2+
B.锌银纽扣电池的正极:Ag2O+2e﹣+H2O═2AgOH
C.碱性锌锰电池的负极:Zn﹣2e﹣+2OH﹣═Zn(OH2
D.氢氧碱性燃料电池的正极:2H2O+4e﹣═O2+4H+
7.工业上可利用图所示电解装置吸收和转化SO2(A,B均为惰性电极).下列说法正确的是(
)
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e﹣+2H2O═SO42
+4H+
8.在一定条件下,反应X(g)+3Y(g) 2Z(g)△H=﹣92.4
kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是(
)
图中A,B两点,达到相同的平衡体系
B、上述反应在达到平衡后,增大压强,X的转化率提高
C、升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D、将1.0
mol
X、3.0
mol
Y,置于1
L密闭容器中发生反应,放出的热量为92.4
kJ
9.在容积不变的密闭容器中进行反应:2SO2(
g
)+O2(
g) 2SO3(g
);△H<O.如图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是(
)
A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C、图Ⅱ表示t0时刻通入氦气对反应速率的影响
D、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
10.已知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如表:
温度/℃
700
800
830
1
000
1
200
化学平衡常数
1.7
1.1
1.0
0.6
0.4
下列说法正确的是(
)
该反应为吸热反应
B.该反应的化学平衡常数表达式为K=
C.其他条件不变时,增大体系的压强,化学平衡常数减小
D.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
你
11.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是(
)
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl溶液中水电离出大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子
12.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣
2PbSO4+2H2O则下列说法正确的是(
)
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
13.钢铁在潮湿的空气中会发生吸氧腐蚀。以下说法中,正确的是(
)
A、负极发生的反应为:Fe-2e-=Fe2+
B、正极发生的反应为:O2+4e-+4H+=2H2O
C、腐蚀过程中,电子从正极流向负极
D、钢柱在水下部分比在空气与水交界处更容易发生吸氧腐蚀
14.1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是(
)
A.2H2(g)+O2(g)=2H2O(l)△H=﹣142.9kJ mol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ mol﹣1
C.2H2+O2=2H2O△H=﹣571.6kJ mol﹣1
D.H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJ mol﹣1
15.对于反应C(s)+H2O(g) CO(g)+H2(g);△H>0,下列有关说法正确的是(
)
A.升高体系温度,平衡常数K减小
B.增大体系压强,平衡常数K不发生变化
C.平衡常数表达式为
K=
D.增加C(s)的量,平衡正向移动
16.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是(
)
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池工作时,1mol乙醇被还原时就有6mol电子转移
D.电池正极的电极反应为:4H++O2+4e﹣→2H2O
17.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为负极反应:C6Li﹣xe﹣═C6Li1﹣x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)正极反应:Li1﹣xMO2+xLi++xe﹣═LiMO2(LiMO2表示含锂的过渡金属氧化物)下列有关说法正确的是(
)
A.锂离子电池充电时电池反应为C6Li+Li1﹣xMO2═LiMO2+C6Li1﹣x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量大
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1﹣x+xLi++xe﹣═C6Li
18.绿色电源“二甲醚【(CH3)2O】﹣氧气燃料电池”的工作原理如图所示,下列说法正确的是(
)
A.氧气应从c处通入,电极Y上发生的反应为:O2+4e﹣+2H2O═4OH﹣
B.电池在放电过程中,电极X周围溶液的pH增大
C.当该电池向外电路提供2
mol电子时消耗O2约为11.2L
D.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O﹣12e﹣+3H2O═2CO2+12H+
19.在一定温度下,容器内某一反应中M,N的物质的量随反应时间变化的曲线如图,下列表述中正确的是(
)
A.反应的化学方程式为:2M N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
20.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e﹣=2CO32﹣
.
下列说法正确的是(
)
A.该电池可在常温或高温时工作,对环境有较强的适应性
B.负极反应为H2+2OH﹣﹣2e﹣=2H2O
C.该电池工作时负极有CO2生成
D.该电池供应2molH2O,同时转移2mol电子
21.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
A、a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B、外电路电子的流向是从a到b
C、电池工作时,盐桥中的SO42﹣移向甲烧杯
D、b电极上发生还原反应
二、填空题
22.恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________ .
①C(s)的浓度不再改变
②CO2的体积分数不再改变
③气体的质量不再改变
④气体的密度不再改变
⑤单位时间内消耗1molCO2
,
同时生成2molCO
⑥n(CO2):n(CO)=1:2
v正(CO2)=2v逆(CO)
23.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ mol﹣1)的变化:(1)关于该反应的下列说法中,正确的是________ (填字母).
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l
L的密闭容器中,充入l
mol
CO2和4mol
H2
,
一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=________
②下列措施中能使化学平衡向正反应方向移动的是________ (填字母).
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l
molCO2和4molH2
(3)25℃,1.01×105Pa时,16g
液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:________
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:________
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关.
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍.具体反应为:Ni(s)+4CO(g)
Ni(CO)4(g)该正反应的△H________ 0(选填“>”或“=”或“<”).
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g)═CH3CH2OH(g)+H2O(g)△H1又已知:H2O(l)═H2O(g)△H2
CO(g)+H2O(g)═CO2(g)+H2(g)△H3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(l)△H
则:△H与△H1、△H2、△H3之间的关系是:△H=________
一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有________
A.2v(H2)=v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+2H2(g)═CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol
H2
,
在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示.
①合成甲醇的反应为________ (填“放热”或“吸热”)反应.②A、B、C三点的平衡常数KA、KB、KC的大小关系
为________ .
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为________ L.
④如图2中虚线为该反应在使用催化剂条件下关于
起始氢气与CO投料比和CO平衡转化率的关系图.
当其条件完全相同时,用实线画出不使用催化剂情况下C0平衡转化率的示意图.
⑤CO的平衡转化率(a)与温度(T)、压强(p)的关系如
图3所示,实际生产时条件控制在250℃、1.3x104kPa左右,选择此压强的理由是________ .
25.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:________ .
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________ .
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=﹣90.8kJ mol﹣1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=﹣23.5kJ mol﹣1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=﹣41.3kJ mol﹣1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2
(g)的△H=________ ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________ (填字母代号).
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol L﹣1)
0.44
0.6
0.6
①比较此时正、逆反应速率的大小:v正________ v逆
(填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=________ ;该时间内反应速率v(CH3OH)=________ .
26.钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中生锈时主要发生________腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的________极,正极的电极反应为________.
27.如图所示,水槽中试管内有一枚铁钉,放置数天观察:
①铁钉在逐渐生绣.
②若试管内液面上升,发生________腐蚀,正极:________.
③若试管内液面下降,则原溶液呈________性,正极:________.
粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);
在电极d上发生的电极反应式为________.
29.根据教材中的“中和热的测定实验”,所用玻璃仪器除了烧杯、量筒、胶头滴管以外,还需要________.已知:含有10.0g氢氧化钠的稀溶液与足量的稀盐酸反应,放出14.3kJ的热量,则该中和反应的中和热为________.
三、综合题(共1题;共8分)
30.Ⅰ.现将反应2Fe3++2I﹣ 2Fe2++I2设计成如下图所示的原电池
(1)能说明反应达到平衡的标志是________;(填序号)
a.电流计读数为零
b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂﹣饱和KCl溶液,反应过程中的Cl﹣移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为________;
(4)Ⅱ.如下图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.
装置乙中电极F的电极反应式________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为________;
(6)欲用装置丙进行粗铜精炼,电极G应该是________;
(7)装置丁中电极________附近红褐色变深,说明氢氧化铁胶粒带正电荷.
答案解析部分
一、单选题
1、【答案】C
【考点】原电池和电解池的工作原理
【解析】【解答】解:边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,
A.电子从负极锌沿导线流向右侧碳棒,再从左侧碳棒流回正极铜片,故A正确;
B.锌片上失电子发生氧化反应,故B正确;
C.左侧碳棒是电解池阳极,阳极上氯离子放电生成氯气,故C错误;
D.铜电极是正极,正极上铜离子得电子析出铜,故D正确;
故选C.
【分析】右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,再结合原电池和电解池原理解答.
2、【答案】C
【考点】中和热
【解析】【分析】中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水放出大量的热,但放热越多,△H越小,因此答案选C。
【点评】在判断反应热大小时,必须注意的是△H是含有符号的,即放热反应位“-”、吸热反应是“+”,所以放热越多,△H越小,据此可以判断。
3、【答案】C
【考点】金属的电化学腐蚀与防护
【解析】【解答】A项,酸性条件下发生析氢腐蚀,最终能形成铁锈,不正确;B项,氧化剂只有氧气,没有水,不正确;D项,钢铁在潮湿的空气中更易发生电化学腐蚀,不正确。
【分析】本题考查钢铁的电化腐蚀、电极反应、和吸氧腐蚀等,熟练掌握金属的电化腐蚀是解题的关键 。
4、【答案】B
【考点】反应热和焓变,燃烧热
【解析】【解答】A.产物CO不是稳定氧化物,△H不代表燃烧热,故A错误;B.条件一定,燃烧热为定值,与物质的量无关,故B正确;C.CO的燃烧反应一定是放热反应,故C错误;D.101kPa时,1mol碳完全燃烧生成二氧化碳,所放出的热量为碳的燃烧热,故D错误;所以选B.
【分析】本题考查了燃烧热的概念.表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.
5、【答案】B
【考点】产物的百分含量随浓度、时间的变化曲线
【解析】【解答】A.由图象可知,a、c两点都在等温线上,c的压强大,则a、c两点的反应速率:a<c,故A错误;
B.由图象可知,a点的二氧化氮体积分数高,所以转化率a<b,故B正确;
C.根据平衡常数可知,a、c两点温度相同,c点压强大,则二氧化氮浓度大,因此a、c两点气体的颜色:a浅、c深,故C错误;
D.升高温度,化学平衡向着逆向移动,NO2的体积分数增大,a点到b点二氧化氮体积分数减少,说明是降低了温度,所以不能用加热的方法实现由a点到b点的转变,故D错误;
故选B.
【分析】2NO2(g) N2O4(g)△H=﹣57kJ mol﹣1
,
该反应为放热反应,若升高温度,化学平衡向着逆向移动,混合气体中NO2的体积分数增大;如果增大压强,化学平衡向着正向移动,混合气体中NO2的体积分数减小,然后结合图象来分析解答.
6、【答案】C
【考点】电极反应和电池反应方程式
【解析】【解答】A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电生成PbSO4
,
故负极反应为:Pb﹣2e﹣+SO42﹣═PbSO4
,
故A错误;
B、锌银纽扣电池的正极是Ag2O放电,Ag2O+2e﹣+H2O═2Ag+2OH﹣
,
故B错误;
C、碱性锌锰电池的负极是锌放电,由于是碱性电池,故负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
,
故C正确;
D、碱性氢氧燃料电池的正极上是氧气放电,即氧气得电子,由于是碱性氢氧燃料电池,故正极反应为:O2+4e﹣+2H2O=4OH﹣
,
故D错误.
故选C.
【分析】A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电;
B、锌银纽扣电池的正极是Ag2O;
C、碱性锌锰电池的负极是锌;
D、碱性氢氧燃料电池的正极上是氧气放电.
7、【答案】B
【考点】原电池和电解池的工作原理
【解析】【解答】解:A.由HSO
3
生成S2O
42
,发生还原反应,A应为负极,故A错误;
B.阴极的电极反应式为:2HSO
3
+2H++2e﹣═S2O
42
+2H2O,碱性增强,故B正确;
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO
42
+4H+
,
阴极的电极反应式为:2HSO
3
+2H++2e﹣═S2O
42
+2H2O,离子交换膜应使H+移动,应为阳离子交换膜,故C错误;
D.B为阳极,发生SO2+2H2O﹣2e﹣═SO
42
+4H+
,
故D错误.
故选B.
【分析】依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2﹣2e﹣+2H2O═SO
42
+4H+
,
阳极与电源的正极B相连,A为电源负极,阴极发生还原反应由HSO
3
生成S2O
42
,以此解答该题.
8、【答案】B
【考点】化学平衡的影响因素
【解析】【解答】解:A、图中A、B两点,X的平衡转化率(α)不同,两者为不相同的平衡体系,故A错误;B、增大压强平衡向体积减小的方向移动,即向正反应移动,X的转化率提高,故B正确;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动,故C错误;
D、热化学方程式X(g)+3Y(g) 2Z(g)△H=﹣92.4kJ/mol表示1molX(g)和3molY(g)完全反应生成2molZ(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0molX、3.0molY,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故D错误;
故选B.
【分析】A、由图得出:A、B两点,X的平衡转化率(α)不同;
B、增大压强平衡向体积减小的方向移动;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动;
D、可逆反应反应物不能完全转化,结合热化学方程式的含义解答.
9、【答案】B
【考点】化学平衡建立的过程,物质的量或浓度随时间的变化曲线
【解析】【解答】解:A.图Ⅰ中乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO3的转化率减小,乙的温度较高,故A错误;
B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B正确;
C.平衡体系中
通入惰气,总压增大,分压不变,平衡不变,图Ⅱ表示的是平衡移动的过程,故C错误;
D.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅲ改变条件瞬间,正、逆速率都增大,正反应速率增大较大,平衡向正反应移动,应是增大压强的原因,故D错误;
故选B.
【分析】A.正反应放热,升高温度,反应速率加快,平衡向逆反应方向移动,平衡时二氧化硫的含量减小;
B.加入催化剂,正逆反应速率都增大,但速率相等,平衡不移动;
C.平衡体系中
通入惰气,总压增大,分压不变,平衡不变;
D.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
10、【答案】D
【考点】用化学平衡常数进行计算
【解析】【解答】解:A.升高温度,平衡向吸热方向移动,根据表中数据知,升高温度平衡常数减小,说明平衡逆向移动,则正反应是放热反应,故A错误;
B.化学平衡常数K等于生成物浓度幂之积与反应物幂之积的比(但固体和纯液体除外),所以该反应的化学平衡常数K=
c(C) c(D)c(B)
,故B错误;
C.化学平衡常数只与温度有关,与压强无关,所以他条件不变时,增大体系的压强,化学平衡常数不变,故C错误;
D.可逆反应达到平衡状态时,同一物质的正逆反应速率相等,单位时间内生成B和D的物质的量相等时,同时消耗B和生成B的物质的量相等,则该反应处于平衡状态,故D正确;
故选D.
【分析】A.升高温度,平衡向吸热方向移动;
B.化学平衡常数K等于生成物浓度幂之积与反应物幂之积的比(但固体和纯液体除外);
C.化学平衡常数只与温度有关;
D.可逆反应达到平衡状态时,同一物质的正逆反应速率相等.
11、【答案】D
【考点】原电池和电解池的工作原理,电解质溶液的导电性
【解析】【解答】解:A、NaCl是强电解质,故A错误;
B、NaCl溶液属于混合物,不是电解质,故B错误;
C、NaCl溶液中含有大量的钠离子和氯离子,水电离出少量的氢离子和氢氧根离子,故C错误;
D、NaCl在水溶液中电离出了大量的自由移动的氯离子和钠离子,能使装置构成电解池而产生电流,故D正确.
故选D.
【分析】根据原电池的工作原理和构成条件:电解质溶液必须含有大量自由移动离子,电解质中阴阳离子的定向移动形成电流.
12、【答案】D
【考点】原电池和电解池的工作原理
【解析】【解答】解:A.放电时,Pb极即B极为电池负极,PbO2极即A极为正极,电子流动方向由负极经导线流向正极,即由B经导线流向A,故A错误;B、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb﹣2e﹣+SO42﹣=PbSO4
,
正极上PbO2得电子被还原,电极反应式为PbO2+SO42﹣+2e﹣+4H+═PbSO4+2H2O,故B错误;
C、在充电时,铅蓄电池的负极的逆反应是还原反应,应与充电器电源的负极相连,故C错误;
D、在充电时,阳极上发生氧化反应,和放电时的正极反应互为逆反应,即PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
,
故D正确.
故选D.
【分析】由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb﹣2e﹣+SO42﹣=PbSO4
,
正极上PbO2得电子被还原,电极反应式为PbO2+SO42﹣+2e﹣+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应.
13、【答案】A
【考点】金属腐蚀的化学原理,探究铁的吸氧腐蚀
【解析】【分析】正确答案:A
A.正确,铁作还原剂;
B.不正确,正极发生的反应为:O2+4e-+2H2O=4OH―
;
C.不正确,腐蚀过程中,电子从负极流向正极;
D.不正确,钢柱在空气与水交界处更容易发生吸氧腐蚀,更符合腐蚀所需的条件。
14、【答案】B
【考点】热化学方程式
【解析】【解答】解:A、2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=﹣571.6kJ mol﹣1
,
故A错误;
B、2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=﹣571.6kJ mol﹣1
,
故B正确;
C、物质的状态影响反应热,未注明物质的聚集状态,故C错误;
D、1gH2燃烧生成液态水时放出142.9kJ的热量,△H<0,热化学方程式为H2(g)+=
12
O2(g)=H2O(l)△H=﹣285.8kJ mol﹣1
,
选项中水是气体,则反应放出的热量小于285.8kJ,故D错误.
故选:B.
【分析】根据热化学方程式的书写判断
书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号.(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下.(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,并用“;”隔开.若为吸热反应,△H为“+”;若为放热反应,△H为“﹣”.△H的单位一般为kJ/mol.(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数.(5)△H与热化学方程式中化学式前面的化学计量数成正比.当反应逆向进行时,其反应热与正反应的反应热数值相等,但符号相反.(6)书写燃烧热的热化学方程式时,应以燃烧1mol物质为标准来配平其他物质化学式前面的化学计量数.(7)当两个热化学方程式相加(减)时,反应热同时相加(减),得到一个新的热化学方程式.
15、【答案】B
【考点】化学平衡的影响因素
【解析】【解答】解:A.正反应为吸热反应,升高体系温度,平衡正向移动,K增大,故A错误;
B.化学平衡常数只受温度的影响,与体系的压强无关,故B正确;
C.C为固体,不带入K的表达式中,因此K=
c(CO)c(H2)c(H2O)
,故C错误;
D.固体物质的浓度视为定值,因此增加C(s)的量,平衡不移动,故D错误;
故选B.
【分析】A.正反应为吸热反应,升高体系温度,平衡正向移动,K增大;
B.平衡常数是温度的函数,与其他条件无关;
C.平衡常数表达式中固体和纯液体不代入表达式中;
D.固体物质的浓度视为定值,因此增加C(s)的量,平衡不移动.
16、【答案】C
【考点】化学电源新型电池
【解析】【解答】解:A.原电池工作时,阳离子向正极移动,则a为负极,故A正确;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B正确;
C.已知电极反应式为C2H5OH+3H2O﹣12e﹣=2CO2+12H+
,
则1mol乙醇被氧化失去12mol电子,故C错误;
D.正极氧气得到电子被还原,电极反应式为4H++O2+4e﹣=2H2O,故D正确;
故选C.
【分析】由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和,电极反应式为C2H5OH+3H2O﹣12e﹣=2CO2+12H+
,
正极氧气得到电子被还原,电极反应式为4H++O2+4e﹣=2H2O,结合电极反应解答该题.
17、【答案】D
【考点】化学电源新型电池
【解析】【解答】解:A.充电时电池反应式为放电电池反应式相反,放电时电池反应式为C6Li+Li1﹣xMO2=C6Li1﹣x+LiMO2
,
则充电时电池反应式为C6Li1﹣x+LiMO2=C6Li+Li1﹣xMO2
,
故A错误;
B.电池反应中,锂、锌、银、铅各失去1
mol
电子,消耗这几种金属的物质的量分别是1mol、0.5mol、1mol、0.5mol,根据m=nM知,消耗其质量分别是7g、32.5g、108g、103.5g,所以消耗Li质量最小,故B错误;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动,所以Li+向正极移动,故C错误;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反,则电极反应式为C6Li1﹣x+xLi++xe﹣═C6Li,故D正确.
故选D.
【分析】A.充电时电池反应式为放电电池反应式相反;
B.根据m=nM计算其质量;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反.
18、【答案】D
【考点】化学电源新型电池
【解析】【解答】解:根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e﹣+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
则a处出来的物质是二氧化碳,
A.氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+4H+═2H2O,故A错误;
B.电池在放电过程中,电极X发生的电极反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
X电极周围溶液的pH减小,故B错误;
C.当该电池向外电路提供2mol电子时消耗O2体积=
2mol4
×22.4mol/L=11.2L,但是没有说明是在标准状况下,所以无法计算体积,故C错误;
D.二甲醚应从b处加入,X电极上二甲醚得电子发生还原反应,所以电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
故D正确;
故选D.
【分析】根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e﹣+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
则a处出来的物质是二氧化碳,据此分析解答.
19、【答案】D
【考点】化学反应速率变化曲线及其应用,物质的量或浓度随时间的变化曲线
【解析】【解答】解:A、由图像可知,反应中M的物质的量逐渐增多,N的物质的量逐渐减少,则在反应中N为反应物,M为生成物,图像中,在相等的时间内消耗的N和M的物质的之比为2:1,所以反应方程式应为:2N
M,故A错误;
B、由图可知t2时,反应没有达到平衡,此时反应继续向正方向移动,正反应速率大于逆反应速率,故B错误;
C、由图可知t3时,反应达到平衡,正逆反应速率相等,故C错误;
D、t1时,N的物质的量为6mol.M的物质的量为3mol,故N的浓度是M浓度的2倍,故D正确.
故选D.
【分析】A、根据图像判断出反应物和生成物,根据物质的量的变化判断计量数之间的关系;
B、根据某一时间反应中各物质的量是否变化判断反应是否达到平衡;
C、根据平衡移动的方向判断正逆反应速率的关系;
D、根据某一时刻反应物和生成物的物质的量多少判断浓度的关系.
20、【答案】C
【考点】原电池和电解池的工作原理
【解析】【解答】解:A.该电池使用的电解质是熔融的碳酸钾,在常温下无法工作,故错误;
B.放电时,负极反应为:2H2﹣4e﹣+2CO32﹣═2CO2+2H2O,故B错误;
C.负极反应为2H2﹣4e﹣+2CO32﹣═2CO2+2H2O,有C02生成,故C正确;
D.由反应可知,生成2molH2O转移4mol电子,则该燃料电池供应2mol水蒸气时转移电子的物质的量为4mol,故D错误;
故选C.
【分析】A.该电池使用的电解质是熔融的碳酸钾,在常温下无法工作;
B.总反应为2H2+O2═2H2O,则负极反应=总反应﹣正极反应式;
C.根据负极的反应式来确定;
D.由反应可知,生成2molH2O转移4mol电子.
21、【答案】A
【考点】原电池和电解池的工作原理
【解析】【解答】解:A、甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4﹣+8H++5e﹣═Mn2++4H2O,故A正确;
B、由上述分析可知,a为正极,电子由负极流向正极,即从b流向a,故B错误;
C、阴离子向负极移动,则盐桥中的SO42﹣移向乙烧杯中,故C错误;
D、b为负极,负极发生氧化反应,故D错误;
故选A.
【分析】由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
二、填空题
22、【答案】②③④
【考点】化学平衡状态的判断
【解析】【解答】①由于C是固体,在反应过程中浓度始终不变,所以C(s)的浓度不再改变不能作为平衡状态的判断标志;
②CO2的体积分数不再改变时,各组分的含量不再改变,反应达到
平衡状态,故可作为平衡状态的判断标志;
③在C(s)+CO2(g) 2CO(g)中,气态物质的质量是不断增大的,当气体质量不变时,说明反应已经达到
平衡状态,故可作为判断标志;
④由于该反应是在恒容条件下进行,气体质量在反应前后不守恒,即密度是不断变化的,故当密度不变是反应就达到了平衡状态;
⑤单位时间内消耗1mol
CO2
,
同时生成2mol
CO都是描述的正反应,没有说明逆反应速率,所以无法判断正逆反应速率是否相等,故无法判断反应是否处于平衡状态;
⑥n(CO2):n(CO)=1:2
时无法判断正逆反应速率是否相等,故也就无法判断反应是否处于平衡状态;
⑦反应处于平衡状态时2v正(CO2)=v逆(CO)v正
,
而当(CO2)=2v逆(CO)时,正反应速率是大于逆反应速率的,故反应未处于平衡状态;
故答案为:②③④.
【分析】根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
23、【答案】C;0.075mol L﹣1 min﹣1;BD;CH3OH(l)+23O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
【考点】焓变和熵变
【解析】【解答】(1)依据反应和图象分析判断:CO2(g)+3H2(g) CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0,
故答案为:C;
(2)在体积为l
L的密闭容器中,充入l
mol
CO2和4mol
H2
,
一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则
①依据化学平衡列式计算为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始量(mol/L)
1
4
0
0
变化量(mol/L)
0.75
2.25
0.75
0.75
平衡量(mol/L)
0.25
1.75
0.75
0.75
CO2的平均反应速率v(CO2)=0.75mol10min=0.075mol L﹣1 min﹣1
;故答案为:0.075
mol L﹣1 min﹣1;
②措施中能使化学平衡向正反应方向移动的是:
A、反应是放热反应,升温平衡逆向进行;故A错误;
B、将CH3OH(g)及时液化抽出,减小生成物的量,平衡正向进行,故B正确;
C、选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D、再充入l
molCO2和4molH2
,
增大压强平衡正向进行,故D正确;
故答案为:BD;
(3)25℃,1.01×105Pa时,16g
液态甲醇物质的量为0.5mol,完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;
故答案为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH3OH+3O2+4KOH→2K2CO3+6H2O;正极反应为O2+2H2O+4e﹣=4OH﹣;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.
【分析】(1)依据反应和图象分析判断:CO2(g)+3H2(g) CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0;
(2)在体积为l
L的密闭容器中,充入l
mol
CO2和4mol
H2
,
一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式计算判断;
②依据化学反应的影响因素和条件逐项分析判断;
A、反应是放热反应,升温平衡逆向进行;
B、将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C、选择高效催化剂只能改变速率,不改变化学平衡;
D、再充入l
molCO2和4molH2
,
增大压强平衡正向进行;
(3)25℃,1.01×105Pa时,16g
液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH3OH+3O2+4KOH→2K2CO3+6H2O;正极反应为O2+2H2O+4e﹣=4OH﹣;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式.
24、【答案】<;△H1﹣2△H3﹣3△H2;A;放热;KA=KB>KC ;2;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
【考点】转化率随温度、压强的变化曲线
【解析】【解答】(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,故该反应正反应为放热反应,即△H<0,故答案为:<;
(2)a、2CO(g)+4H2(g)═CH3CH2OH(g)+H2O(g)△H1
b、H2O(l)═H2O(g)△H2
c、CO(g)+H2O(g)═CO2(g)+H2(g)△H3
依据盖斯定律a﹣c×2﹣3b得到:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l)△H=△H1﹣2△H3﹣3△H2;
故答案为:△H1﹣2△H3﹣3△H2;
(3)A.2v(H2)=v(CO)没有指明正逆反应方向,故A错误;
B.因为CO与CH3OCH3的系数比为2:1,则CO的消耗速率等于CH3OCH3的生成速率,不能说明达到平衡,故B错误
C.因为反应前后气体系数不等,容器内的压强保持不变,说明气体物质的量不变,已达平衡状态,故C正确;
D.因为反应前后质量不变,体积也不变,混合气体的密度从反应开始到平衡一直不变,不能说明达到平衡,故D错误;
E.因为反应前后质量不变,物质的量在变,则混合气体的平均相对分子质量不随时间而变化,能说明达到平衡,故E正确;
故选CE;
(3)①据图象可知,温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;故答案为:放热;
②因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC
,
故答案为:KA=KB>KC;
③T1时,A点对应的α=0.5,据平衡常数表达式可得K=1.因B点与A点温度相同,K不变,
CO(g)+2H2(g) CH3OH(g).
起始(mol)
10
20
0
转化(mol)
8
16
8
平衡(mol)
2
4
8
则K=c(CH3OH)c2(H2)·c(CO)=8V2V×(4V)2=1,解得:V=2L,
故答案为:2;
④使用催化剂,加快反应速率,但是不会引起平衡的移动,当不使用催化剂,起始H2
,
CO投料比和CO平衡转化率的关系示意图如下:,
故答案为:;
⑤实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
【分析】(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,据此判断;
(2)依据热化学方程式和盖斯定律计算得到;
(3)正逆反应速率相等,各物质的浓度不发生变化时表示化学反应处于平衡状态;
(4)根据温度和CO的转化率确定反应热;
②温度不变,化学平衡常数不变,温度升高平衡向吸热的方向移动,平衡常数变化;
③根据CO的转化率求出平衡常数,再根据A、B两点的平衡常数相同求出容器的体积;
④催化剂只改变反应速率不改变平衡移动,据此画图;
⑤实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
25、【答案】C+H2O
CO+H2 ;H2S+Na2CO3=NaHS+NaHCO3;﹣246.4kJ mol﹣1 ;c、e;>;0.04mol L﹣1 ;0.16mol/(L min)
【考点】用盖斯定律进行有关反应热的计算
【解析】【解答】解:(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程:C+H2OCO+H2
,
故答案为:C+H2OCO+H2;
(2)H2S和H2CO3均是二元酸,它们都存在酸式盐NaHS和NaHCO3
,
二者反应的化学方程式为H2S+Na2CO3=NaHS+NaHCO3
,
故答案为:H2S+Na2CO3=NaHS+NaHCO3;
(3)由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=﹣90.8kJ/mol×2﹣23.5kJ/mol﹣41.3kJ/mol=﹣246.4kJ/mol,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,应使平衡向正反应方向移动,可减少CO2的浓度或分离出二甲醚,由于反应放热,升高温度平衡向逆反应方向移动,转化率减小,催化剂不影响平衡移动,而增加
CO的浓度,CO的转化率反而减小,
故答案为:﹣246.4
kJ mol﹣1;c、e;
(4)①该反应的平衡常数表达式为:K=c(CH3OCH3)·c(H2O)c2(CH3OH)
,
将所给浓度带入平衡常数表达式:
0.6×0.60.442=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol L﹣1):0.44
0.6
0.6
转化浓度(mol L﹣1):2x
x
x
平衡浓度(mol L﹣1):0.44﹣2x
0.6+x
0.6+x
K=
(0.6+x)2(0.44-2x)2,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L﹣0.2mol/L×2=0.04mol/L,
起始时在密闭容器中加入CH3OH,
则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,
则10min转化甲醇1.64moL/L﹣0.04moL/L=1.6mol/L,
所以甲醇的反应速率为v(CH3OH)=
1.6mol/L10min=0.16
mol/(L min),
故答案为:0.04
mol L﹣1;
0.16
mol/(L min).
【分析】(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程;
(2)根据酸式盐NaHS和NaHCO3为书写反应的化学方程式;
(3)利用盖斯定律计算;
(4)根据方程式计算平衡常数,然后利用三段式法解答.
26、【答案】吸氧;负;O2+4e﹣+2H2O=4OH﹣
【考点】金属的电化学腐蚀与防护
【解析】【解答】解:钢铁在潮湿的空气中,由于水膜为中性或弱酸性,故发生吸氧腐蚀;在形成的原电池中,由于铁比碳活泼,故铁做负极,负极反应为Fe﹣2e﹣=Fe2+
,
碳做正极,发生反应为:O2+4e﹣+2H2O=4OH﹣;
故答案为:吸氧;负;O2+4e﹣+2H2O=4OH﹣
.
【分析】钢铁在潮湿的空气中,根据水膜为中性或弱酸性来分析发生的腐蚀的类型;在形成的原电池中,由于铁比碳活泼,据此分析正负极;若水膜显酸性,则发生析氢腐蚀,据此分析正负极反应.
27、【答案】吸氧;2H2O+O2+4e﹣=4OH﹣;酸;2H++2e﹣=H2↑
【考点】金属的电化学腐蚀与防护
【解析】【解答】解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,①若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,原溶液呈中性,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+
,
正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e﹣=4OH﹣
,
故答案为:吸氧;2H2O+O2+4e﹣=4OH﹣;②若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+
,
正极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣=H2↑,故答案为:酸;2H++2e﹣=H2↑.
【分析】生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
28、【答案】c;Cu2++2e﹣═Cu
【考点】原电池和电解池的工作原理
【解析】【解答】解:用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极;
该装置中a为原电池的正极,b为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子沉积在阴极上,发生还原反应,即d电极上发生的反应为:Cu2++2e﹣=Cu;
故答案为:c;Cu2++2e﹣═Cu.
【分析】用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极;阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应,据此分析.
29、【答案】温度计和搅拌器;57.2KJ
【考点】有关反应热的计算,反应热和焓变
【解析】【解答】解:中和热的测定实验用到的玻璃仪器有:烧杯、温度计、量筒、搅拌器、胶头滴管,则还需要温度计和搅拌器;中和热是强酸强碱发生反应生成1mol水放出的热量,则含有10.0g氢氧化钠的稀溶液与足量的稀盐酸反应,放出14.3kJ的热量,则该中和反应的中和热为
=57.2KJ,
故答案为:温度计和搅拌器;57.2KJ.
【分析】根据中和热的测定实验用到的仪器知识来回答;根据中和热是强酸强碱发生反应生成1mol水放出的热量计算.
三、综合题
30、【答案】(1)a
(2)乙
(3)甲;2Fe2+﹣2e﹣=2Fe3+
(4)2H++2e﹣=H2↑
(5)1:2
(6)粗铜
(7)Y
【考点】化学平衡状态的判断,设计原电池
【解析】【解答】解:Ⅰ.(1)反应达到平衡时,正逆反应速率相等,没有电子发生转移,此时电流计读数为零,故答案为:a;(2)开始反应时,碘离子被氧化生成碘,乙为原电池负极,又电池工作时,阴离子向负极移动,阳离子向正极移动,则反应过程中的Cl﹣移向乙烧杯,故答案为:乙;(3)反应达到平衡后,向甲中加入适量FeCl2固体,Fe2+浓度增大,平衡逆向移动,则Fe2+失去电子生成Fe3+
,
发生2Fe2+﹣2e﹣=2Fe3+
,
甲为负极,
故答案为:甲;2Fe2+﹣2e﹣=2Fe3+;Ⅱ.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极(4)F为电解池的阴极,电极方程式为2H++2e﹣=H2↑,故答案为:2H++2e﹣=H2↑;(5)甲装置中C电极上氢氧根离子放电生成氧气,E电极上氯离子放电生成氯气,所以(甲)、(乙)装置的C、E电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol氯气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2,故答案为:1:2;(6)精炼粗铜时,粗铜为阳极,纯铜为阴极,G为阳极,应为粗铜,故答案为:粗铜;(7)氢氧化铁胶粒带正电荷,应移向电源的负极,即向Y移动,故答案为:Y.
【分析】Ⅰ.(1)反应达到平衡时,正逆反应速率相等,没有电子发生转移;(2)原电池工作时,阴离子向负极移动,阳离子向正极移动;(3)反应达到平衡后,向甲中加入适量FeCl2固体,Fe2+浓度增大,平衡逆向移动,则Fe2+失去电子生成Fe3+;Ⅱ.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,
甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,以此解答该题.
反应原理——热、电、速综合练习1
一、单选题
1.关于如图装置中的变化叙述错误的是(
)
A.电子从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.锌片上发生氧化反应
C.左侧碳棒上发生:2H2O+O2+4e→4OH﹣
D.铜电极析出铜
2.强酸与强碱的稀溶液发生中和反应的热效应为:
H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L
0.5mol/L的NaOH溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3
,
下列关系正确的是( )
A.△H1>△H2>△H3
B、△H1<△H2<△H3
C、△H1<△H2=△H3
D、△H1=△H2<△H3
3.钢铁生锈过程发生如下反应:①2Fe+O2+2H2O===2Fe(OH)2;②4Fe(OH)2+O2+2H2O===4Fe(OH)3;③2Fe(OH)3===Fe2O3+3H2O。下列说法正确的是( )
A.钢铁在碱性条件下腐蚀生成铁锈,而在酸性条件下不生成铁锈
B.反应①中的氧化剂是氧气和水
C、上述反应表示钢铁发生的是吸氧腐蚀
D、钢铁在潮湿的空气中不能发生电化学腐蚀
4.下列说法正确的是( )
A.CH4(g)+
O2(g)═CO(g)+2H2O(l)△H═﹣a
kJ mol﹣1
,
这里△H代表燃烧热
B.在25℃、101kPa,1mol硫和2mol硫的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2
,
所以CO的燃烧反应一定是吸热反应
D.101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热
5.在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g)△H=﹣57kJ mol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
A.a、c两点的反应速率:a>c
B.a、b两点的转化率:a<b
C.a、c两点气体的颜色:a深,c浅
D.由a点到b点,可以用加热的方法
6.下列原电池对应的电极反应式正确的是( )
A.硫酸铅蓄电池的负极:Pb﹣2e﹣═Pb2+
B.锌银纽扣电池的正极:Ag2O+2e﹣+H2O═2AgOH
C.碱性锌锰电池的负极:Zn﹣2e﹣+2OH﹣═Zn(OH2
D.氢氧碱性燃料电池的正极:2H2O+4e﹣═O2+4H+
7.工业上可利用图所示电解装置吸收和转化SO2(A,B均为惰性电极).下列说法正确的是(
)
A.A电极接电源的正极
B.A极区溶液的碱性逐渐增强
C.本装置中使用的是阴离子交换膜
D.B极的电极反应式为SO2+2e﹣+2H2O═SO42
+4H+
8.在一定条件下,反应X(g)+3Y(g) 2Z(g)△H=﹣92.4
kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是(
)
图中A,B两点,达到相同的平衡体系
B、上述反应在达到平衡后,增大压强,X的转化率提高
C、升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D、将1.0
mol
X、3.0
mol
Y,置于1
L密闭容器中发生反应,放出的热量为92.4
kJ
9.在容积不变的密闭容器中进行反应:2SO2(
g
)+O2(
g) 2SO3(g
);△H<O.如图表示当其它条件不变时,改变某一条件对上述反应的影响,其中分析正确的是(
)
A、图Ⅰ表示温度对化学平衡的影响,且甲的温度较高B、图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C、图Ⅱ表示t0时刻通入氦气对反应速率的影响
D、图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
10.已知反应A(s)+B(g) C(g)+D(g)的化学平衡常数和温度的关系如表:
温度/℃
700
800
830
1
000
1
200
化学平衡常数
1.7
1.1
1.0
0.6
0.4
下列说法正确的是(
)
该反应为吸热反应
B.该反应的化学平衡常数表达式为K=
C.其他条件不变时,增大体系的压强,化学平衡常数减小
D.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
你
11.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是(
)
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl溶液中水电离出大量的离子
D.NaCl在水溶液中电离出了可以自由移动的离子
12.电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣
2PbSO4+2H2O则下列说法正确的是(
)
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
13.钢铁在潮湿的空气中会发生吸氧腐蚀。以下说法中,正确的是(
)
A、负极发生的反应为:Fe-2e-=Fe2+
B、正极发生的反应为:O2+4e-+4H+=2H2O
C、腐蚀过程中,电子从正极流向负极
D、钢柱在水下部分比在空气与水交界处更容易发生吸氧腐蚀
14.1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是(
)
A.2H2(g)+O2(g)=2H2O(l)△H=﹣142.9kJ mol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ mol﹣1
C.2H2+O2=2H2O△H=﹣571.6kJ mol﹣1
D.H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJ mol﹣1
15.对于反应C(s)+H2O(g) CO(g)+H2(g);△H>0,下列有关说法正确的是(
)
A.升高体系温度,平衡常数K减小
B.增大体系压强,平衡常数K不发生变化
C.平衡常数表达式为
K=
D.增加C(s)的量,平衡正向移动
16.2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是(
)
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池工作时,1mol乙醇被还原时就有6mol电子转移
D.电池正极的电极反应为:4H++O2+4e﹣→2H2O
17.锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性.锂离子电池放电时的电极反应式为负极反应:C6Li﹣xe﹣═C6Li1﹣x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料)正极反应:Li1﹣xMO2+xLi++xe﹣═LiMO2(LiMO2表示含锂的过渡金属氧化物)下列有关说法正确的是(
)
A.锂离子电池充电时电池反应为C6Li+Li1﹣xMO2═LiMO2+C6Li1﹣x
B.电池反应中,锂、锌、银、铅各失去1mol电子,金属锂所消耗的质量大
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时阴极反应为C6Li1﹣x+xLi++xe﹣═C6Li
18.绿色电源“二甲醚【(CH3)2O】﹣氧气燃料电池”的工作原理如图所示,下列说法正确的是(
)
A.氧气应从c处通入,电极Y上发生的反应为:O2+4e﹣+2H2O═4OH﹣
B.电池在放电过程中,电极X周围溶液的pH增大
C.当该电池向外电路提供2
mol电子时消耗O2约为11.2L
D.二甲醚应从b处加入,电极X上发生的反应为:(CH3)2O﹣12e﹣+3H2O═2CO2+12H+
19.在一定温度下,容器内某一反应中M,N的物质的量随反应时间变化的曲线如图,下列表述中正确的是(
)
A.反应的化学方程式为:2M N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
20.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾.已知电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e﹣=2CO32﹣
.
下列说法正确的是(
)
A.该电池可在常温或高温时工作,对环境有较强的适应性
B.负极反应为H2+2OH﹣﹣2e﹣=2H2O
C.该电池工作时负极有CO2生成
D.该电池供应2molH2O,同时转移2mol电子
21.某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
A、a电极上发生的反应为:MnO4﹣+8H++5e﹣═Mn2++4H2O
B、外电路电子的流向是从a到b
C、电池工作时,盐桥中的SO42﹣移向甲烧杯
D、b电极上发生还原反应
二、填空题
22.恒温恒容时,某密闭容器中发生反应:C(s)+CO2(g) 2CO(g),下列描述中能说明该反应已达到化学平衡状态的是________ .
①C(s)的浓度不再改变
②CO2的体积分数不再改变
③气体的质量不再改变
④气体的密度不再改变
⑤单位时间内消耗1molCO2
,
同时生成2molCO
⑥n(CO2):n(CO)=1:2
v正(CO2)=2v逆(CO)
23.实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ mol﹣1)的变化:(1)关于该反应的下列说法中,正确的是________ (填字母).
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<0
D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l
L的密闭容器中,充入l
mol
CO2和4mol
H2
,
一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=________
②下列措施中能使化学平衡向正反应方向移动的是________ (填字母).
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l
molCO2和4molH2
(3)25℃,1.01×105Pa时,16g
液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:________
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极的电极反应式是:________
CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关.
(1)人们利用CO能与金属镍反应,生成四羰基镍,然后将四羰基镍分解从而实现镍的提纯,最后可以得到纯度达99.9%的高纯镍.具体反应为:Ni(s)+4CO(g)
Ni(CO)4(g)该正反应的△H________ 0(选填“>”或“=”或“<”).
(2)工业上可利用CO生产乙醇:2CO(g)+4H2(g)═CH3CH2OH(g)+H2O(g)△H1又已知:H2O(l)═H2O(g)△H2
CO(g)+H2O(g)═CO2(g)+H2(g)△H3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(l)△H
则:△H与△H1、△H2、△H3之间的关系是:△H=________
一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:
4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g),下列选项能判断该反应达到平衡状态的依据的有________
A.2v(H2)=v(CO)
B.CO的消耗速率等于CH3OCH3的生成速率
C.容器内的压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)工业可采用CO与H2反应合成再生能源甲醇,反应如下:CO(g)+2H2(g)═CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol
H2
,
在催化剂作用下发生反应生成甲醇.CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示.
①合成甲醇的反应为________ (填“放热”或“吸热”)反应.②A、B、C三点的平衡常数KA、KB、KC的大小关系
为________ .
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为________ L.
④如图2中虚线为该反应在使用催化剂条件下关于
起始氢气与CO投料比和CO平衡转化率的关系图.
当其条件完全相同时,用实线画出不使用催化剂情况下C0平衡转化率的示意图.
⑤CO的平衡转化率(a)与温度(T)、压强(p)的关系如
图3所示,实际生产时条件控制在250℃、1.3x104kPa左右,选择此压强的理由是________ .
25.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:________ .
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________ .
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g);△H=﹣90.8kJ mol﹣1
②2CH3OH(g) CH3OCH3(g)+H2O(g);△H=﹣23.5kJ mol﹣1
③CO(g)+H2O(g) CO2(g)+H2(g);△H=﹣41.3kJ mol﹣1
总反应:3H2(g)+3CO(g) CH3OCH3(g)+CO2
(g)的△H=________ ;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________ (填字母代号).
a.高温高压
b.加入催化剂
c.减少CO2的浓度
d.增加CO的浓度
e.分离出二甲醚
(4)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
CH3OH
CH3OCH3
H2O
浓度/(mol L﹣1)
0.44
0.6
0.6
①比较此时正、逆反应速率的大小:v正________ v逆
(填“>”、“<”或“=”).
②若加入CH3OH后,经10min反应达到平衡,此时c(CH3OH)=________ ;该时间内反应速率v(CH3OH)=________ .
26.钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中生锈时主要发生________腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的________极,正极的电极反应为________.
27.如图所示,水槽中试管内有一枚铁钉,放置数天观察:
①铁钉在逐渐生绣.
②若试管内液面上升,发生________腐蚀,正极:________.
③若试管内液面下降,则原溶液呈________性,正极:________.
粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);
在电极d上发生的电极反应式为________.
29.根据教材中的“中和热的测定实验”,所用玻璃仪器除了烧杯、量筒、胶头滴管以外,还需要________.已知:含有10.0g氢氧化钠的稀溶液与足量的稀盐酸反应,放出14.3kJ的热量,则该中和反应的中和热为________.
三、综合题(共1题;共8分)
30.Ⅰ.现将反应2Fe3++2I﹣ 2Fe2++I2设计成如下图所示的原电池
(1)能说明反应达到平衡的标志是________;(填序号)
a.电流计读数为零
b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大
(2)若盐桥中装有琼脂﹣饱和KCl溶液,反应过程中的Cl﹣移向烧杯________;(填“甲”或“乙”)
(3)反应达到平衡后,向甲中加入适量FeCl2固体,此时________(填“甲”或“乙”)中石墨电极为负极,对应的电极反应方程式为________;
(4)Ⅱ.如下图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.
装置乙中电极F的电极反应式________;
(5)相同条件下,装置甲、乙的C、E电极生成物质的体积之比为________;
(6)欲用装置丙进行粗铜精炼,电极G应该是________;
(7)装置丁中电极________附近红褐色变深,说明氢氧化铁胶粒带正电荷.
答案解析部分
一、单选题
1、【答案】C
【考点】原电池和电解池的工作原理
【解析】【解答】解:边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,
A.电子从负极锌沿导线流向右侧碳棒,再从左侧碳棒流回正极铜片,故A正确;
B.锌片上失电子发生氧化反应,故B正确;
C.左侧碳棒是电解池阳极,阳极上氯离子放电生成氯气,故C错误;
D.铜电极是正极,正极上铜离子得电子析出铜,故D正确;
故选C.
【分析】右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,再结合原电池和电解池原理解答.
2、【答案】C
【考点】中和热
【解析】【分析】中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。由于浓硫酸溶于水放出大量的热,但放热越多,△H越小,因此答案选C。
【点评】在判断反应热大小时,必须注意的是△H是含有符号的,即放热反应位“-”、吸热反应是“+”,所以放热越多,△H越小,据此可以判断。
3、【答案】C
【考点】金属的电化学腐蚀与防护
【解析】【解答】A项,酸性条件下发生析氢腐蚀,最终能形成铁锈,不正确;B项,氧化剂只有氧气,没有水,不正确;D项,钢铁在潮湿的空气中更易发生电化学腐蚀,不正确。
【分析】本题考查钢铁的电化腐蚀、电极反应、和吸氧腐蚀等,熟练掌握金属的电化腐蚀是解题的关键 。
4、【答案】B
【考点】反应热和焓变,燃烧热
【解析】【解答】A.产物CO不是稳定氧化物,△H不代表燃烧热,故A错误;B.条件一定,燃烧热为定值,与物质的量无关,故B正确;C.CO的燃烧反应一定是放热反应,故C错误;D.101kPa时,1mol碳完全燃烧生成二氧化碳,所放出的热量为碳的燃烧热,故D错误;所以选B.
【分析】本题考查了燃烧热的概念.表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.
5、【答案】B
【考点】产物的百分含量随浓度、时间的变化曲线
【解析】【解答】A.由图象可知,a、c两点都在等温线上,c的压强大,则a、c两点的反应速率:a<c,故A错误;
B.由图象可知,a点的二氧化氮体积分数高,所以转化率a<b,故B正确;
C.根据平衡常数可知,a、c两点温度相同,c点压强大,则二氧化氮浓度大,因此a、c两点气体的颜色:a浅、c深,故C错误;
D.升高温度,化学平衡向着逆向移动,NO2的体积分数增大,a点到b点二氧化氮体积分数减少,说明是降低了温度,所以不能用加热的方法实现由a点到b点的转变,故D错误;
故选B.
【分析】2NO2(g) N2O4(g)△H=﹣57kJ mol﹣1
,
该反应为放热反应,若升高温度,化学平衡向着逆向移动,混合气体中NO2的体积分数增大;如果增大压强,化学平衡向着正向移动,混合气体中NO2的体积分数减小,然后结合图象来分析解答.
6、【答案】C
【考点】电极反应和电池反应方程式
【解析】【解答】A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电生成PbSO4
,
故负极反应为:Pb﹣2e﹣+SO42﹣═PbSO4
,
故A错误;
B、锌银纽扣电池的正极是Ag2O放电,Ag2O+2e﹣+H2O═2Ag+2OH﹣
,
故B错误;
C、碱性锌锰电池的负极是锌放电,由于是碱性电池,故负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
,
故C正确;
D、碱性氢氧燃料电池的正极上是氧气放电,即氧气得电子,由于是碱性氢氧燃料电池,故正极反应为:O2+4e﹣+2H2O=4OH﹣
,
故D错误.
故选C.
【分析】A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电;
B、锌银纽扣电池的正极是Ag2O;
C、碱性锌锰电池的负极是锌;
D、碱性氢氧燃料电池的正极上是氧气放电.
7、【答案】B
【考点】原电池和电解池的工作原理
【解析】【解答】解:A.由HSO
3
生成S2O
42
,发生还原反应,A应为负极,故A错误;
B.阴极的电极反应式为:2HSO
3
+2H++2e﹣═S2O
42
+2H2O,碱性增强,故B正确;
C.阳极的电极反应式为:SO2+2H2O﹣2e﹣═SO
42
+4H+
,
阴极的电极反应式为:2HSO
3
+2H++2e﹣═S2O
42
+2H2O,离子交换膜应使H+移动,应为阳离子交换膜,故C错误;
D.B为阳极,发生SO2+2H2O﹣2e﹣═SO
42
+4H+
,
故D错误.
故选B.
【分析】依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2﹣2e﹣+2H2O═SO
42
+4H+
,
阳极与电源的正极B相连,A为电源负极,阴极发生还原反应由HSO
3
生成S2O
42
,以此解答该题.
8、【答案】B
【考点】化学平衡的影响因素
【解析】【解答】解:A、图中A、B两点,X的平衡转化率(α)不同,两者为不相同的平衡体系,故A错误;B、增大压强平衡向体积减小的方向移动,即向正反应移动,X的转化率提高,故B正确;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动,故C错误;
D、热化学方程式X(g)+3Y(g) 2Z(g)△H=﹣92.4kJ/mol表示1molX(g)和3molY(g)完全反应生成2molZ(g),放出的热量为92.4kJ,由于可逆反应反应物不能完全转化,1.0molX、3.0molY,置于1L密闭容器中发生反应,放出的热量小于92.4kJ,故D错误;
故选B.
【分析】A、由图得出:A、B两点,X的平衡转化率(α)不同;
B、增大压强平衡向体积减小的方向移动;
C、升高温度正、逆反应速率都增大,逆反应速率比较正反应速率增大更多,平衡向逆反应方向移动;
D、可逆反应反应物不能完全转化,结合热化学方程式的含义解答.
9、【答案】B
【考点】化学平衡建立的过程,物质的量或浓度随时间的变化曲线
【解析】【解答】解:A.图Ⅰ中乙到达平衡时间较短,乙的温度较高,正反应放热,升高温度,平衡向逆反应方向移动,SO3的转化率减小,乙的温度较高,故A错误;
B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B正确;
C.平衡体系中
通入惰气,总压增大,分压不变,平衡不变,图Ⅱ表示的是平衡移动的过程,故C错误;
D.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅲ改变条件瞬间,正、逆速率都增大,正反应速率增大较大,平衡向正反应移动,应是增大压强的原因,故D错误;
故选B.
【分析】A.正反应放热,升高温度,反应速率加快,平衡向逆反应方向移动,平衡时二氧化硫的含量减小;
B.加入催化剂,正逆反应速率都增大,但速率相等,平衡不移动;
C.平衡体系中
通入惰气,总压增大,分压不变,平衡不变;
D.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
10、【答案】D
【考点】用化学平衡常数进行计算
【解析】【解答】解:A.升高温度,平衡向吸热方向移动,根据表中数据知,升高温度平衡常数减小,说明平衡逆向移动,则正反应是放热反应,故A错误;
B.化学平衡常数K等于生成物浓度幂之积与反应物幂之积的比(但固体和纯液体除外),所以该反应的化学平衡常数K=
c(C) c(D)c(B)
,故B错误;
C.化学平衡常数只与温度有关,与压强无关,所以他条件不变时,增大体系的压强,化学平衡常数不变,故C错误;
D.可逆反应达到平衡状态时,同一物质的正逆反应速率相等,单位时间内生成B和D的物质的量相等时,同时消耗B和生成B的物质的量相等,则该反应处于平衡状态,故D正确;
故选D.
【分析】A.升高温度,平衡向吸热方向移动;
B.化学平衡常数K等于生成物浓度幂之积与反应物幂之积的比(但固体和纯液体除外);
C.化学平衡常数只与温度有关;
D.可逆反应达到平衡状态时,同一物质的正逆反应速率相等.
11、【答案】D
【考点】原电池和电解池的工作原理,电解质溶液的导电性
【解析】【解答】解:A、NaCl是强电解质,故A错误;
B、NaCl溶液属于混合物,不是电解质,故B错误;
C、NaCl溶液中含有大量的钠离子和氯离子,水电离出少量的氢离子和氢氧根离子,故C错误;
D、NaCl在水溶液中电离出了大量的自由移动的氯离子和钠离子,能使装置构成电解池而产生电流,故D正确.
故选D.
【分析】根据原电池的工作原理和构成条件:电解质溶液必须含有大量自由移动离子,电解质中阴阳离子的定向移动形成电流.
12、【答案】D
【考点】原电池和电解池的工作原理
【解析】【解答】解:A.放电时,Pb极即B极为电池负极,PbO2极即A极为正极,电子流动方向由负极经导线流向正极,即由B经导线流向A,故A错误;B、由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb﹣2e﹣+SO42﹣=PbSO4
,
正极上PbO2得电子被还原,电极反应式为PbO2+SO42﹣+2e﹣+4H+═PbSO4+2H2O,故B错误;
C、在充电时,铅蓄电池的负极的逆反应是还原反应,应与充电器电源的负极相连,故C错误;
D、在充电时,阳极上发生氧化反应,和放电时的正极反应互为逆反应,即PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
,
故D正确.
故选D.
【分析】由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb﹣2e﹣+SO42﹣=PbSO4
,
正极上PbO2得电子被还原,电极反应式为PbO2+SO42﹣+2e﹣+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应.
13、【答案】A
【考点】金属腐蚀的化学原理,探究铁的吸氧腐蚀
【解析】【分析】正确答案:A
A.正确,铁作还原剂;
B.不正确,正极发生的反应为:O2+4e-+2H2O=4OH―
;
C.不正确,腐蚀过程中,电子从负极流向正极;
D.不正确,钢柱在空气与水交界处更容易发生吸氧腐蚀,更符合腐蚀所需的条件。
14、【答案】B
【考点】热化学方程式
【解析】【解答】解:A、2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=﹣571.6kJ mol﹣1
,
故A错误;
B、2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=﹣571.6kJ mol﹣1
,
故B正确;
C、物质的状态影响反应热,未注明物质的聚集状态,故C错误;
D、1gH2燃烧生成液态水时放出142.9kJ的热量,△H<0,热化学方程式为H2(g)+=
12
O2(g)=H2O(l)△H=﹣285.8kJ mol﹣1
,
选项中水是气体,则反应放出的热量小于285.8kJ,故D错误.
故选:B.
【分析】根据热化学方程式的书写判断
书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号.(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下.(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,并用“;”隔开.若为吸热反应,△H为“+”;若为放热反应,△H为“﹣”.△H的单位一般为kJ/mol.(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数.(5)△H与热化学方程式中化学式前面的化学计量数成正比.当反应逆向进行时,其反应热与正反应的反应热数值相等,但符号相反.(6)书写燃烧热的热化学方程式时,应以燃烧1mol物质为标准来配平其他物质化学式前面的化学计量数.(7)当两个热化学方程式相加(减)时,反应热同时相加(减),得到一个新的热化学方程式.
15、【答案】B
【考点】化学平衡的影响因素
【解析】【解答】解:A.正反应为吸热反应,升高体系温度,平衡正向移动,K增大,故A错误;
B.化学平衡常数只受温度的影响,与体系的压强无关,故B正确;
C.C为固体,不带入K的表达式中,因此K=
c(CO)c(H2)c(H2O)
,故C错误;
D.固体物质的浓度视为定值,因此增加C(s)的量,平衡不移动,故D错误;
故选B.
【分析】A.正反应为吸热反应,升高体系温度,平衡正向移动,K增大;
B.平衡常数是温度的函数,与其他条件无关;
C.平衡常数表达式中固体和纯液体不代入表达式中;
D.固体物质的浓度视为定值,因此增加C(s)的量,平衡不移动.
16、【答案】C
【考点】化学电源新型电池
【解析】【解答】解:A.原电池工作时,阳离子向正极移动,则a为负极,故A正确;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B正确;
C.已知电极反应式为C2H5OH+3H2O﹣12e﹣=2CO2+12H+
,
则1mol乙醇被氧化失去12mol电子,故C错误;
D.正极氧气得到电子被还原,电极反应式为4H++O2+4e﹣=2H2O,故D正确;
故选C.
【分析】由质子的定向移动方向可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和,电极反应式为C2H5OH+3H2O﹣12e﹣=2CO2+12H+
,
正极氧气得到电子被还原,电极反应式为4H++O2+4e﹣=2H2O,结合电极反应解答该题.
17、【答案】D
【考点】化学电源新型电池
【解析】【解答】解:A.充电时电池反应式为放电电池反应式相反,放电时电池反应式为C6Li+Li1﹣xMO2=C6Li1﹣x+LiMO2
,
则充电时电池反应式为C6Li1﹣x+LiMO2=C6Li+Li1﹣xMO2
,
故A错误;
B.电池反应中,锂、锌、银、铅各失去1
mol
电子,消耗这几种金属的物质的量分别是1mol、0.5mol、1mol、0.5mol,根据m=nM知,消耗其质量分别是7g、32.5g、108g、103.5g,所以消耗Li质量最小,故B错误;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动,所以Li+向正极移动,故C错误;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反,则电极反应式为C6Li1﹣x+xLi++xe﹣═C6Li,故D正确.
故选D.
【分析】A.充电时电池反应式为放电电池反应式相反;
B.根据m=nM计算其质量;
C.放电时,电池内部阳离子向正极移动,阴离子向负极移动;
D.充电时,阴极上得电子发生还原反应,与放电时负极电极反应式相反.
18、【答案】D
【考点】化学电源新型电池
【解析】【解答】解:根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e﹣+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
则a处出来的物质是二氧化碳,
A.氧气应从c处通入,电极Y上发生的反应为O2+4e﹣+4H+═2H2O,故A错误;
B.电池在放电过程中,电极X发生的电极反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
X电极周围溶液的pH减小,故B错误;
C.当该电池向外电路提供2mol电子时消耗O2体积=
2mol4
×22.4mol/L=11.2L,但是没有说明是在标准状况下,所以无法计算体积,故C错误;
D.二甲醚应从b处加入,X电极上二甲醚得电子发生还原反应,所以电极X上发生的反应为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
故D正确;
故选D.
【分析】根据氢离子移动方向知,Y为原电池正极,X为负极,则c处通入的气体是氧气,根据d处生成物知,正极上发生的反应为O2+4e﹣+4H+═2H2O,电解质溶液为酸性溶液,b处通入的物质是二甲醚,X电极反应式为(CH3)2O﹣12e﹣+3H2O=2CO2+12H+
,
则a处出来的物质是二氧化碳,据此分析解答.
19、【答案】D
【考点】化学反应速率变化曲线及其应用,物质的量或浓度随时间的变化曲线
【解析】【解答】解:A、由图像可知,反应中M的物质的量逐渐增多,N的物质的量逐渐减少,则在反应中N为反应物,M为生成物,图像中,在相等的时间内消耗的N和M的物质的之比为2:1,所以反应方程式应为:2N
M,故A错误;
B、由图可知t2时,反应没有达到平衡,此时反应继续向正方向移动,正反应速率大于逆反应速率,故B错误;
C、由图可知t3时,反应达到平衡,正逆反应速率相等,故C错误;
D、t1时,N的物质的量为6mol.M的物质的量为3mol,故N的浓度是M浓度的2倍,故D正确.
故选D.
【分析】A、根据图像判断出反应物和生成物,根据物质的量的变化判断计量数之间的关系;
B、根据某一时间反应中各物质的量是否变化判断反应是否达到平衡;
C、根据平衡移动的方向判断正逆反应速率的关系;
D、根据某一时刻反应物和生成物的物质的量多少判断浓度的关系.
20、【答案】C
【考点】原电池和电解池的工作原理
【解析】【解答】解:A.该电池使用的电解质是熔融的碳酸钾,在常温下无法工作,故错误;
B.放电时,负极反应为:2H2﹣4e﹣+2CO32﹣═2CO2+2H2O,故B错误;
C.负极反应为2H2﹣4e﹣+2CO32﹣═2CO2+2H2O,有C02生成,故C正确;
D.由反应可知,生成2molH2O转移4mol电子,则该燃料电池供应2mol水蒸气时转移电子的物质的量为4mol,故D错误;
故选C.
【分析】A.该电池使用的电解质是熔融的碳酸钾,在常温下无法工作;
B.总反应为2H2+O2═2H2O,则负极反应=总反应﹣正极反应式;
C.根据负极的反应式来确定;
D.由反应可知,生成2molH2O转移4mol电子.
21、【答案】A
【考点】原电池和电解池的工作原理
【解析】【解答】解:A、甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO4﹣+8H++5e﹣═Mn2++4H2O,故A正确;
B、由上述分析可知,a为正极,电子由负极流向正极,即从b流向a,故B错误;
C、阴离子向负极移动,则盐桥中的SO42﹣移向乙烧杯中,故C错误;
D、b为负极,负极发生氧化反应,故D错误;
故选A.
【分析】由2KMnO4+10FeSO4+8H2SO4═2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答.
二、填空题
22、【答案】②③④
【考点】化学平衡状态的判断
【解析】【解答】①由于C是固体,在反应过程中浓度始终不变,所以C(s)的浓度不再改变不能作为平衡状态的判断标志;
②CO2的体积分数不再改变时,各组分的含量不再改变,反应达到
平衡状态,故可作为平衡状态的判断标志;
③在C(s)+CO2(g) 2CO(g)中,气态物质的质量是不断增大的,当气体质量不变时,说明反应已经达到
平衡状态,故可作为判断标志;
④由于该反应是在恒容条件下进行,气体质量在反应前后不守恒,即密度是不断变化的,故当密度不变是反应就达到了平衡状态;
⑤单位时间内消耗1mol
CO2
,
同时生成2mol
CO都是描述的正反应,没有说明逆反应速率,所以无法判断正逆反应速率是否相等,故无法判断反应是否处于平衡状态;
⑥n(CO2):n(CO)=1:2
时无法判断正逆反应速率是否相等,故也就无法判断反应是否处于平衡状态;
⑦反应处于平衡状态时2v正(CO2)=v逆(CO)v正
,
而当(CO2)=2v逆(CO)时,正反应速率是大于逆反应速率的,故反应未处于平衡状态;
故答案为:②③④.
【分析】根据可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断.
23、【答案】C;0.075mol L﹣1 min﹣1;BD;CH3OH(l)+23O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O
【考点】焓变和熵变
【解析】【解答】(1)依据反应和图象分析判断:CO2(g)+3H2(g) CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0,
故答案为:C;
(2)在体积为l
L的密闭容器中,充入l
mol
CO2和4mol
H2
,
一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则
①依据化学平衡列式计算为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始量(mol/L)
1
4
0
0
变化量(mol/L)
0.75
2.25
0.75
0.75
平衡量(mol/L)
0.25
1.75
0.75
0.75
CO2的平均反应速率v(CO2)=0.75mol10min=0.075mol L﹣1 min﹣1
;故答案为:0.075
mol L﹣1 min﹣1;
②措施中能使化学平衡向正反应方向移动的是:
A、反应是放热反应,升温平衡逆向进行;故A错误;
B、将CH3OH(g)及时液化抽出,减小生成物的量,平衡正向进行,故B正确;
C、选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D、再充入l
molCO2和4molH2
,
增大压强平衡正向进行,故D正确;
故答案为:BD;
(3)25℃,1.01×105Pa时,16g
液态甲醇物质的量为0.5mol,完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;
故答案为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH3OH+3O2+4KOH→2K2CO3+6H2O;正极反应为O2+2H2O+4e﹣=4OH﹣;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O,
故答案为:CH3OH﹣6e﹣+8OH﹣=CO32﹣+6H2O.
【分析】(1)依据反应和图象分析判断:CO2(g)+3H2(g) CH3OH(g)+H2O(g),反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0;
(2)在体积为l
L的密闭容器中,充入l
mol
CO2和4mol
H2
,
一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式计算判断;
②依据化学反应的影响因素和条件逐项分析判断;
A、反应是放热反应,升温平衡逆向进行;
B、将CH3OH(g)及时液化抽出,减小生成物的量平衡正向进行;
C、选择高效催化剂只能改变速率,不改变化学平衡;
D、再充入l
molCO2和4molH2
,
增大压强平衡正向进行;
(3)25℃,1.01×105Pa时,16g
液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=﹣726.6
kJ mol﹣1;
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,原电池的负极失电子发生氧化反应,失电子的是甲醇,此电池的负极应加入或通入的物质有甲醇、氢氧化钠、水;负极的电极反应式结合化学方程式为2CH3OH+3O2+4KOH→2K2CO3+6H2O;正极反应为O2+2H2O+4e﹣=4OH﹣;依据电子守恒,用化学方程式减去正极电极反应得到负极电极反应式.
24、【答案】<;△H1﹣2△H3﹣3△H2;A;放热;KA=KB>KC ;2;在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低
【考点】转化率随温度、压强的变化曲线
【解析】【解答】(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,故该反应正反应为放热反应,即△H<0,故答案为:<;
(2)a、2CO(g)+4H2(g)═CH3CH2OH(g)+H2O(g)△H1
b、H2O(l)═H2O(g)△H2
c、CO(g)+H2O(g)═CO2(g)+H2(g)△H3
依据盖斯定律a﹣c×2﹣3b得到:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l)△H=△H1﹣2△H3﹣3△H2;
故答案为:△H1﹣2△H3﹣3△H2;
(3)A.2v(H2)=v(CO)没有指明正逆反应方向,故A错误;
B.因为CO与CH3OCH3的系数比为2:1,则CO的消耗速率等于CH3OCH3的生成速率,不能说明达到平衡,故B错误
C.因为反应前后气体系数不等,容器内的压强保持不变,说明气体物质的量不变,已达平衡状态,故C正确;
D.因为反应前后质量不变,体积也不变,混合气体的密度从反应开始到平衡一直不变,不能说明达到平衡,故D错误;
E.因为反应前后质量不变,物质的量在变,则混合气体的平均相对分子质量不随时间而变化,能说明达到平衡,故E正确;
故选CE;
(3)①据图象可知,温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;故答案为:放热;
②因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC
,
故答案为:KA=KB>KC;
③T1时,A点对应的α=0.5,据平衡常数表达式可得K=1.因B点与A点温度相同,K不变,
CO(g)+2H2(g) CH3OH(g).
起始(mol)
10
20
0
转化(mol)
8
16
8
平衡(mol)
2
4
8
则K=c(CH3OH)c2(H2)·c(CO)=8V2V×(4V)2=1,解得:V=2L,
故答案为:2;
④使用催化剂,加快反应速率,但是不会引起平衡的移动,当不使用催化剂,起始H2
,
CO投料比和CO平衡转化率的关系示意图如下:,
故答案为:;
⑤实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,经济效益低.
【分析】(1)由反应条件可知,低温有利于向正反应进行,高温有利于向逆反应进行,降低温度平衡向放热反应移动,据此判断;
(2)依据热化学方程式和盖斯定律计算得到;
(3)正逆反应速率相等,各物质的浓度不发生变化时表示化学反应处于平衡状态;
(4)根据温度和CO的转化率确定反应热;
②温度不变,化学平衡常数不变,温度升高平衡向吸热的方向移动,平衡常数变化;
③根据CO的转化率求出平衡常数,再根据A、B两点的平衡常数相同求出容器的体积;
④催化剂只改变反应速率不改变平衡移动,据此画图;
⑤实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
25、【答案】C+H2O
CO+H2 ;H2S+Na2CO3=NaHS+NaHCO3;﹣246.4kJ mol﹣1 ;c、e;>;0.04mol L﹣1 ;0.16mol/(L min)
【考点】用盖斯定律进行有关反应热的计算
【解析】【解答】解:(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程:C+H2OCO+H2
,
故答案为:C+H2OCO+H2;
(2)H2S和H2CO3均是二元酸,它们都存在酸式盐NaHS和NaHCO3
,
二者反应的化学方程式为H2S+Na2CO3=NaHS+NaHCO3
,
故答案为:H2S+Na2CO3=NaHS+NaHCO3;
(3)由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=﹣90.8kJ/mol×2﹣23.5kJ/mol﹣41.3kJ/mol=﹣246.4kJ/mol,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,应使平衡向正反应方向移动,可减少CO2的浓度或分离出二甲醚,由于反应放热,升高温度平衡向逆反应方向移动,转化率减小,催化剂不影响平衡移动,而增加
CO的浓度,CO的转化率反而减小,
故答案为:﹣246.4
kJ mol﹣1;c、e;
(4)①该反应的平衡常数表达式为:K=c(CH3OCH3)·c(H2O)c2(CH3OH)
,
将所给浓度带入平衡常数表达式:
0.6×0.60.442=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol L﹣1):0.44
0.6
0.6
转化浓度(mol L﹣1):2x
x
x
平衡浓度(mol L﹣1):0.44﹣2x
0.6+x
0.6+x
K=
(0.6+x)2(0.44-2x)2,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L﹣0.2mol/L×2=0.04mol/L,
起始时在密闭容器中加入CH3OH,
则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,
则10min转化甲醇1.64moL/L﹣0.04moL/L=1.6mol/L,
所以甲醇的反应速率为v(CH3OH)=
1.6mol/L10min=0.16
mol/(L min),
故答案为:0.04
mol L﹣1;
0.16
mol/(L min).
【分析】(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程;
(2)根据酸式盐NaHS和NaHCO3为书写反应的化学方程式;
(3)利用盖斯定律计算;
(4)根据方程式计算平衡常数,然后利用三段式法解答.
26、【答案】吸氧;负;O2+4e﹣+2H2O=4OH﹣
【考点】金属的电化学腐蚀与防护
【解析】【解答】解:钢铁在潮湿的空气中,由于水膜为中性或弱酸性,故发生吸氧腐蚀;在形成的原电池中,由于铁比碳活泼,故铁做负极,负极反应为Fe﹣2e﹣=Fe2+
,
碳做正极,发生反应为:O2+4e﹣+2H2O=4OH﹣;
故答案为:吸氧;负;O2+4e﹣+2H2O=4OH﹣
.
【分析】钢铁在潮湿的空气中,根据水膜为中性或弱酸性来分析发生的腐蚀的类型;在形成的原电池中,由于铁比碳活泼,据此分析正负极;若水膜显酸性,则发生析氢腐蚀,据此分析正负极反应.
27、【答案】吸氧;2H2O+O2+4e﹣=4OH﹣;酸;2H++2e﹣=H2↑
【考点】金属的电化学腐蚀与防护
【解析】【解答】解:生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,①若试管内液面上升,说明试管内气体因和水反应而使其压强减小,发生的是吸氧腐蚀,原溶液呈中性,铁作负极,负极上铁失电子发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+
,
正极上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e﹣=4OH﹣
,
故答案为:吸氧;2H2O+O2+4e﹣=4OH﹣;②若试管内液面下降,说明金属的腐蚀中生成气体导致压强增大,则金属发生的是析氢腐蚀,溶液呈酸性,负极上铁失电子发生氧化反应,电极反应式为:Fe﹣2e﹣=Fe2+
,
正极上氢离子得电子发生还原反应,电极反应式为:2H++2e﹣=H2↑,故答案为:酸;2H++2e﹣=H2↑.
【分析】生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,负极上铁失电子发生氧化反应,正极上氧气得电子和水反应生成氢氧根离子,在酸性条件下,铁发生析氢腐蚀,负极上铁失电子发生氧化反应,正极上氢离子得电子发生还原反应.
28、【答案】c;Cu2++2e﹣═Cu
【考点】原电池和电解池的工作原理
【解析】【解答】解:用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极;
该装置中a为原电池的正极,b为原电池的负极,所以c为电解池的阳极,d为电解池的阴极,电解时,以硫酸铜溶液为电解液,溶液中的Cu2+得到电子沉积在阴极上,发生还原反应,即d电极上发生的反应为:Cu2++2e﹣=Cu;
故答案为:c;Cu2++2e﹣═Cu.
【分析】用电解法进行粗铜提纯时,粗铜应作阳极,精铜作阴极;阳极与电池的正极相连发生氧化反应,阴极与电池的负极相连发生还原反应,据此分析.
29、【答案】温度计和搅拌器;57.2KJ
【考点】有关反应热的计算,反应热和焓变
【解析】【解答】解:中和热的测定实验用到的玻璃仪器有:烧杯、温度计、量筒、搅拌器、胶头滴管,则还需要温度计和搅拌器;中和热是强酸强碱发生反应生成1mol水放出的热量,则含有10.0g氢氧化钠的稀溶液与足量的稀盐酸反应,放出14.3kJ的热量,则该中和反应的中和热为
=57.2KJ,
故答案为:温度计和搅拌器;57.2KJ.
【分析】根据中和热的测定实验用到的仪器知识来回答;根据中和热是强酸强碱发生反应生成1mol水放出的热量计算.
三、综合题
30、【答案】(1)a
(2)乙
(3)甲;2Fe2+﹣2e﹣=2Fe3+
(4)2H++2e﹣=H2↑
(5)1:2
(6)粗铜
(7)Y
【考点】化学平衡状态的判断,设计原电池
【解析】【解答】解:Ⅰ.(1)反应达到平衡时,正逆反应速率相等,没有电子发生转移,此时电流计读数为零,故答案为:a;(2)开始反应时,碘离子被氧化生成碘,乙为原电池负极,又电池工作时,阴离子向负极移动,阳离子向正极移动,则反应过程中的Cl﹣移向乙烧杯,故答案为:乙;(3)反应达到平衡后,向甲中加入适量FeCl2固体,Fe2+浓度增大,平衡逆向移动,则Fe2+失去电子生成Fe3+
,
发生2Fe2+﹣2e﹣=2Fe3+
,
甲为负极,
故答案为:甲;2Fe2+﹣2e﹣=2Fe3+;Ⅱ.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极(4)F为电解池的阴极,电极方程式为2H++2e﹣=H2↑,故答案为:2H++2e﹣=H2↑;(5)甲装置中C电极上氢氧根离子放电生成氧气,E电极上氯离子放电生成氯气,所以(甲)、(乙)装置的C、E电极均有单质生成;生成1mol氧气需要4mol电子,生成1mol氯气时需要2mol电子,所以转移相同物质的量的电子时生成单质的物质的量之比为1:2,故答案为:1:2;(6)精炼粗铜时,粗铜为阳极,纯铜为阴极,G为阳极,应为粗铜,故答案为:粗铜;(7)氢氧化铁胶粒带正电荷,应移向电源的负极,即向Y移动,故答案为:Y.
【分析】Ⅰ.(1)反应达到平衡时,正逆反应速率相等,没有电子发生转移;(2)原电池工作时,阴离子向负极移动,阳离子向正极移动;(3)反应达到平衡后,向甲中加入适量FeCl2固体,Fe2+浓度增大,平衡逆向移动,则Fe2+失去电子生成Fe3+;Ⅱ.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色,说明F极上氢离子放电生成氢气,所以F极是阴极,则电源B极是负极,A极是正极,
甲装置中C电极上氢氧根离子放电生成氧气,D电极上铜离子放电生成铜单质,E电极上氯离子放电生成氯气,F电极上氢离子放电生成氢气,以此解答该题.
