2017-2018年江苏省赣榆县海头高级中学苏教版高中化学必修二课件:3.2.1食品中的有机化合物—乙醇
文档属性
| 名称 | 2017-2018年江苏省赣榆县海头高级中学苏教版高中化学必修二课件:3.2.1食品中的有机化合物—乙醇 |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-16 06:35:46 | ||
图片预览







文档简介
课件27张PPT。乙 醇 第二单元
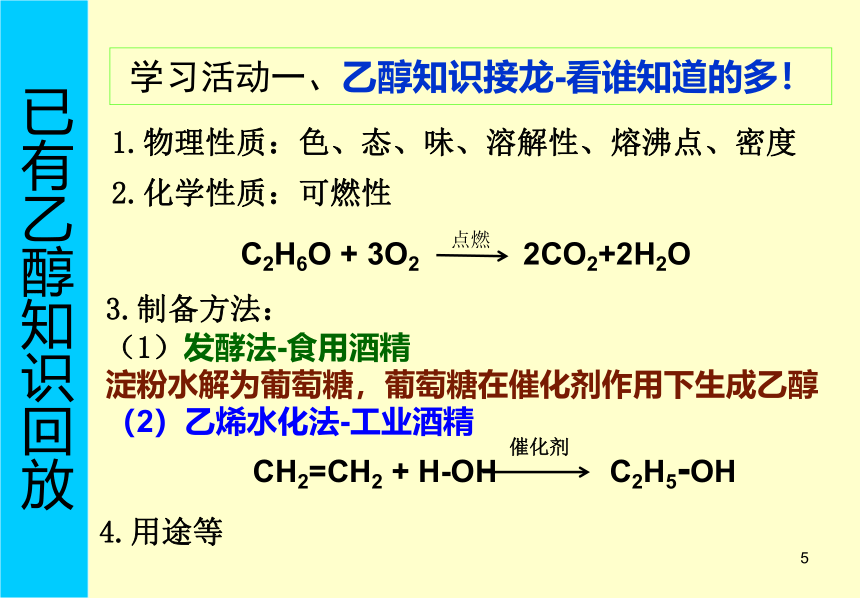
食品中的有机化合物1甲骨文篆书1乙醇在生活中的应用 让我欢喜让我忧!严禁酒驾11.物理性质:色、态、味、溶解性、熔沸点、密度 学习活动一、乙醇知识接龙-看谁知道的多! 已有乙醇知识回放 2.化学性质:可燃性3.制备方法:
(1)发酵法-食用酒精
淀粉水解为葡萄糖,葡萄糖在催化剂作用下生成乙醇
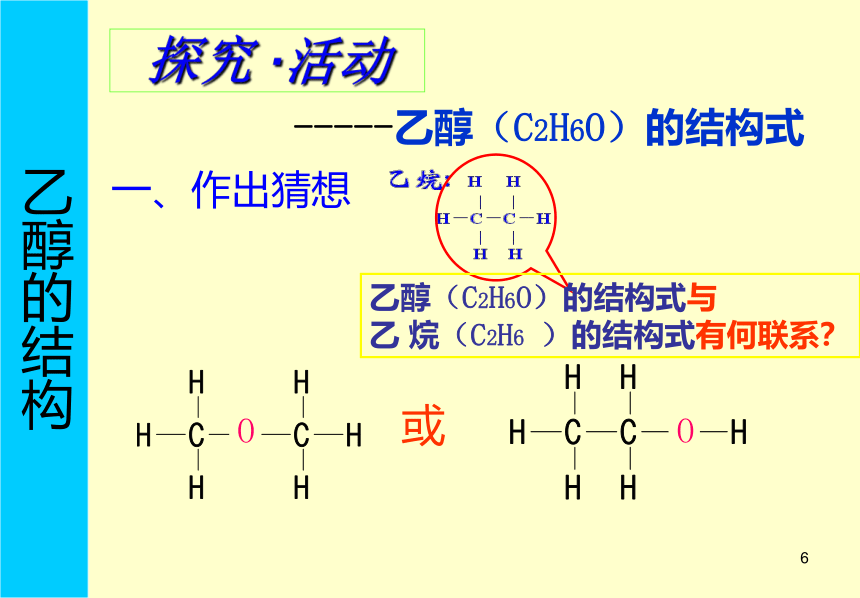
(2)乙烯水化法-工业酒精4.用途等1 或一、作出猜想乙醇的结构 乙醇(C2H6O)的结构式与 乙 烷(C2H6 )的结构式有何联系?探究 ·活动 -----乙醇(C2H6O)的结构式1钠保存在煤油中,而煤油是多种烷烃的混合物,这些烷烃分子中与碳原子相连的氢能否被金属钠置换?二、分析、推理乙醇的结构 钠能否与水反应?反应现象是什么?
这说明水中与氧原子相连的氢能否被金属钠置换?你能否设计一个实验推断出乙醇的结构?1乙醇与钠反应的装置 1乙醇与金属钠反应乙醇能与钠反应,生成氢气 点燃肥皂泡,有爆鸣声 开始时钠沉在试管底部,
有气泡缓慢溢出三、实验乙醇的结构 1乙醇的结构式四、得出结论:乙醇的结构 CH3CH2OH
或C2H5OHC2H6O羟基
写作-OH乙醇的结构 1 H H
│ │
H─C ─C
│ │
H H─ O[问题]?1、 决定乙醇能和钠反应生成氢气。
2、根据实验的剧烈程度,羟基中的H原子的
活泼性强弱:醇 水。乙醇的化学性质1探究 ·活动 ----- 乙醇的催化氧化 (1)点燃酒精灯,拿一根洁净的铜丝在酒精灯的外焰上灼烧。 (2)待铜丝变黑后,把灼热的铜丝放入盛有约2mL乙醇的试管中。 (3)重复操作步骤(1)(2)2-3次,
观察铜丝颜色变化并闻液体的气味。乙醇的化学性质 1实验现象及原因探究1、在酒精灯上加热时铜丝由红色变黑,插入乙醇后铜丝又变红色。2、试管中液体有刺激性气味。观看flash乙醇的化学性质 1乙醇催化氧化的历程 1乙醇催化氧化: 工业上利用此原理生产乙醛C2H6OC2H4O醛基
写作-CHO乙醇的化学性质 11乙醇催化氧化的应用 1乙醇催化氧化成乙醛 乙醇的转化 乙醛被氧化成乙酸 材料:乙醇在体内的转化:1乙醇的应用 1酒精的快速检测橙红绿乙醇的应用 1 1.通过本节课的学习,谈谈你对乙醇有哪些新的认识? 2.乙醇性质与结构的关系概括 整合 11、铜丝在空气中灼烧后,马上放入下列溶液中,充分反应后取出,烘干、冷却、称重,质量不变的是( )
A、稀硫酸 B、酒精 C、NaOH溶液 D、醋B练习 实践 2、酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是: ( )A:浓硫酸C:碱石灰D:无水氯化钙B:NaOH溶液C13、与钠反应时在何处断键( )A: ①4、发生催化氧化反应时在何处断键( )A: ① ④B: ②B: ① ③C: ③C: ② ④D: ④D: ② ④AB 练习 实践 谢谢颜 色:
气 味:
状 态:
密 度:
挥发性:
熔沸点:
溶解性:与水以任意比例互溶
能溶解多种有机物和无机物. 物理性质沸点78.5℃ ,熔点-117.3℃ 乙醇的性质 酒精度46%(V/V)
【 学以致用】
1、 “酒香不怕巷子深”反映乙醇 性质?2、乙醇能萃取碘水中的碘吗?为什么?3、要检验酒精是否有水,可向酒精中加入
____________ 。 挥发性不能。因为乙醇与水互溶。无水硫酸铜4 、如何分离水和酒精?蒸馏加生石灰,再蒸馏
食品中的有机化合物1甲骨文篆书1乙醇在生活中的应用 让我欢喜让我忧!严禁酒驾11.物理性质:色、态、味、溶解性、熔沸点、密度 学习活动一、乙醇知识接龙-看谁知道的多! 已有乙醇知识回放 2.化学性质:可燃性3.制备方法:
(1)发酵法-食用酒精
淀粉水解为葡萄糖,葡萄糖在催化剂作用下生成乙醇
(2)乙烯水化法-工业酒精4.用途等1 或一、作出猜想乙醇的结构 乙醇(C2H6O)的结构式与 乙 烷(C2H6 )的结构式有何联系?探究 ·活动 -----乙醇(C2H6O)的结构式1钠保存在煤油中,而煤油是多种烷烃的混合物,这些烷烃分子中与碳原子相连的氢能否被金属钠置换?二、分析、推理乙醇的结构 钠能否与水反应?反应现象是什么?
这说明水中与氧原子相连的氢能否被金属钠置换?你能否设计一个实验推断出乙醇的结构?1乙醇与钠反应的装置 1乙醇与金属钠反应乙醇能与钠反应,生成氢气 点燃肥皂泡,有爆鸣声 开始时钠沉在试管底部,
有气泡缓慢溢出三、实验乙醇的结构 1乙醇的结构式四、得出结论:乙醇的结构 CH3CH2OH
或C2H5OHC2H6O羟基
写作-OH乙醇的结构 1 H H
│ │
H─C ─C
│ │
H H─ O[问题]?1、 决定乙醇能和钠反应生成氢气。
2、根据实验的剧烈程度,羟基中的H原子的
活泼性强弱:醇 水。乙醇的化学性质1探究 ·活动 ----- 乙醇的催化氧化 (1)点燃酒精灯,拿一根洁净的铜丝在酒精灯的外焰上灼烧。 (2)待铜丝变黑后,把灼热的铜丝放入盛有约2mL乙醇的试管中。 (3)重复操作步骤(1)(2)2-3次,
观察铜丝颜色变化并闻液体的气味。乙醇的化学性质 1实验现象及原因探究1、在酒精灯上加热时铜丝由红色变黑,插入乙醇后铜丝又变红色。2、试管中液体有刺激性气味。观看flash乙醇的化学性质 1乙醇催化氧化的历程 1乙醇催化氧化: 工业上利用此原理生产乙醛C2H6OC2H4O醛基
写作-CHO乙醇的化学性质 11乙醇催化氧化的应用 1乙醇催化氧化成乙醛 乙醇的转化 乙醛被氧化成乙酸 材料:乙醇在体内的转化:1乙醇的应用 1酒精的快速检测橙红绿乙醇的应用 1 1.通过本节课的学习,谈谈你对乙醇有哪些新的认识? 2.乙醇性质与结构的关系概括 整合 11、铜丝在空气中灼烧后,马上放入下列溶液中,充分反应后取出,烘干、冷却、称重,质量不变的是( )
A、稀硫酸 B、酒精 C、NaOH溶液 D、醋B练习 实践 2、酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是: ( )A:浓硫酸C:碱石灰D:无水氯化钙B:NaOH溶液C13、与钠反应时在何处断键( )A: ①4、发生催化氧化反应时在何处断键( )A: ① ④B: ②B: ① ③C: ③C: ② ④D: ④D: ② ④AB 练习 实践 谢谢颜 色:
气 味:
状 态:
密 度:
挥发性:
熔沸点:
溶解性:与水以任意比例互溶
能溶解多种有机物和无机物. 物理性质沸点78.5℃ ,熔点-117.3℃ 乙醇的性质 酒精度46%(V/V)
【 学以致用】
1、 “酒香不怕巷子深”反映乙醇 性质?2、乙醇能萃取碘水中的碘吗?为什么?3、要检验酒精是否有水,可向酒精中加入
____________ 。 挥发性不能。因为乙醇与水互溶。无水硫酸铜4 、如何分离水和酒精?蒸馏加生石灰,再蒸馏
