2017-2018年人教版高三化学选修四1.1反应与能量转化 课件 (共24张PPT)
文档属性
| 名称 | 2017-2018年人教版高三化学选修四1.1反应与能量转化 课件 (共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 322.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-18 09:29:17 | ||
图片预览






文档简介
课件24张PPT。第六章 化学反应中的能量变化 1.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热(燃烧热、中和热)等概念。
3.了解热化学方程式的含义。
4.能用键能、盖斯定律进行反应热的简单计算。
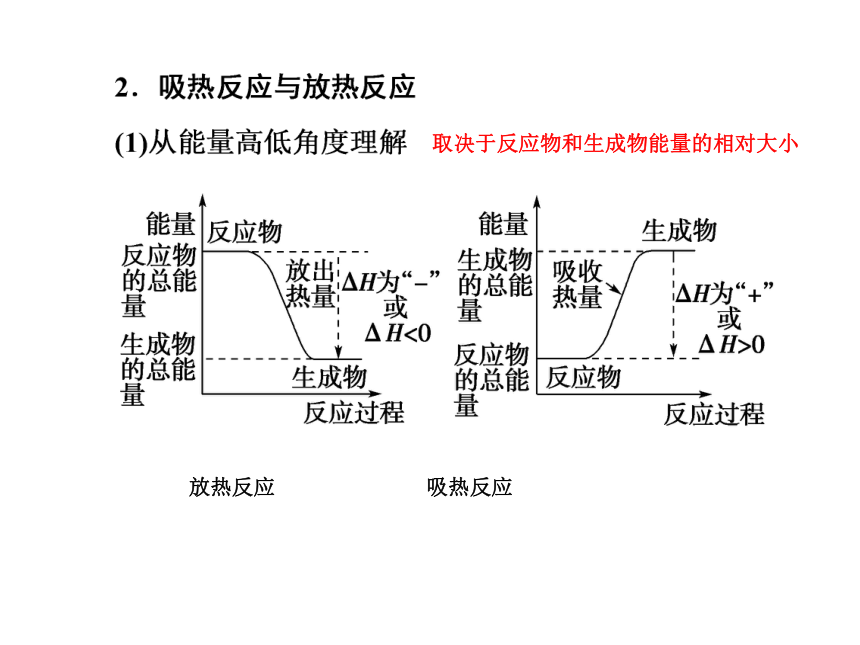
5.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。考纲要求吸收或放出 恒压条件下 kJ/mol 一、焓变 反应热1.反应热和焓变
(1)反应热是化学反应中________________的热量。
(2)焓变是化学反应在____________放出或吸收的热量。
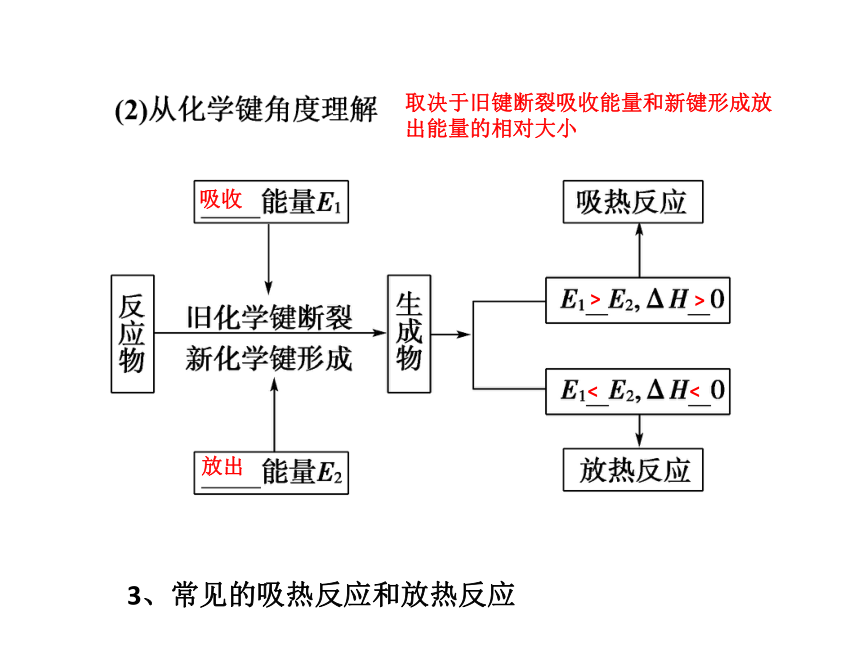
(3)化学反应的反应热用一定条件下的焓变表示,符号为ΔH,单位为______。 放热反应 吸热反应取决于反应物和生成物能量的相对大小吸收放出>><<取决于旧键断裂吸收能量和新键形成放
出能量的相对大小3、常见的吸热反应和放热反应二、重要的反应热-燃烧热1.概念:在101kPa时,1mol物质完全燃烧生成
稳定的氧化物时所放出的热量,叫做
该物质的燃烧热 2.单位:kJ/mol(1)燃烧的物质必须为:1mol
(2)完全燃烧是指物质中下列元素完全转变成对应的物质:C→CO2(g),H→H2O(l),S→SO2(g)等。
(3)燃烧热通常由实验测得3.注意:4.表示的意义: 例如:C的燃烧热为393.5kJ/mol,表示:
在101kPa时1molC完全燃烧放出393.5kJ的热量。
★ 燃烧热是以1mol物质完全燃烧放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1mol物质为标准来配平其余物质的系数。例如:
C8H18(g)+25/2O2(g)= 8CO2(g)十 9H2O(l);
△H=-5518kJ/mol
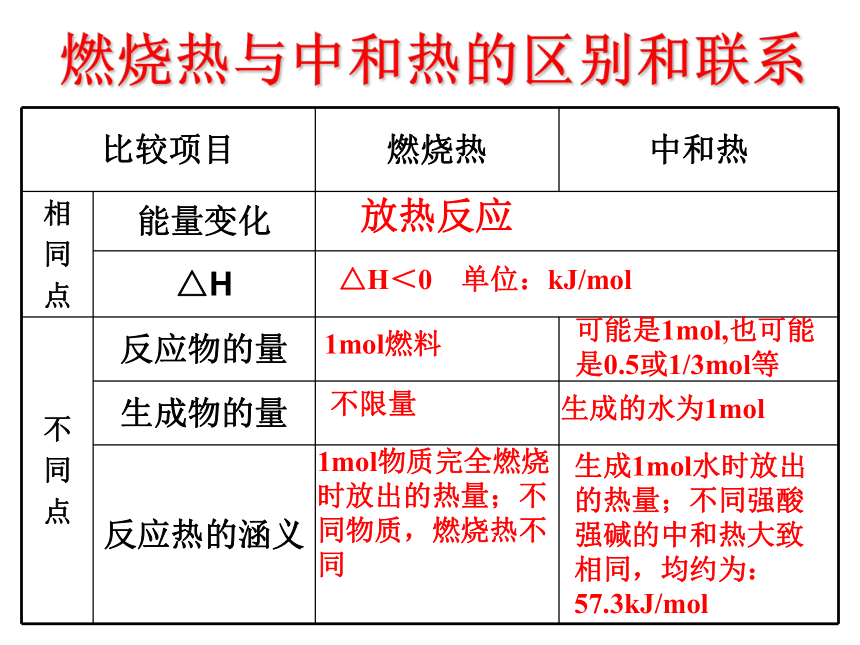
C8H18的燃烧热为5518kJ/mol。二、重要的反应热-中和热在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。1.概念:①条件:②反应物:③生成物及物质的量:④放出的热量:稀溶液强酸与强碱生成1mol的H2O△H=-57.3kJ/mol。2.注意:若用弱酸代替强酸,或用弱 碱代替强碱,因中和过程中弱电解质电离吸热,会使测得中和热的数值偏低。燃烧热与中和热的区别和联系放热反应△H<0 单位:kJ/mol1mol燃料可能是1mol,也可能是0.5或1/3mol等不限量生成的水为1mol1mol物质完全燃烧时放出的热量;不同物质,燃烧热不同生成1mol水时放出的热量;不同强酸强碱的中和热大致相同,均约为:57.3kJ/mol 练习: 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1); ?H=-57.3kJ/mol,向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应?H1,?H2,?H3的关系正确的是( )
A. ?H1>?H2>?H3 B. ?H1 C. ?H2?H3>?H2D三、热化学方程式表明反应所放出或吸收的热量的化学方程式。1.概念: (1) 注明各物质的聚集状态。(气:g,液:l,固:s) (2) △H“-”,为放热反应,△H“+”为吸热反应(3) 需注明反应的温度和压强,若不注明温度和压强,一般指250C ,1.01×105Pa系数只表示物质的量,可以是整数、小数或分数。(5) 系数必须与反应热相对应。3.书写热化学方程式注意事项2.意义:溶液:aq不仅表示化学反应中的物质变化,还表示化学反应中的能量变化。例:2H2(g)+ O2 (g)= 2H2O (l); △H= - 571.6 kJ/mol方法总结关键提醒四、有关热化学方程式的计算和比较1、计算的主要方法:
(2)能量:根据反应物和生成物的总能量计算
ΔH=E生成物-E反应物。
(3)化学键:依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算
ΔH=化学键断裂吸收的能量-化学键形成释放的能量
=反应物的键能之和-生成物的键能之和 (1)根据热化学方程式的计算
反应热与反应物各物质的物质的量成正比。 化学反应不管是一步完成还是分几步完成,其反应热是相同的。即:化学反应的反应热,只与反应的始态(各反应物)和终态(各生成物)有关,而与反应具体进行的途径无关。应用:间接计算一些无法直接测定的反应热 (4)根据盖斯定律计算2、比较的主要方法:
(1)同一反应生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
因为C(g)===C(l) ΔH3<0,
则ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。注意:比较热量不考虑正负号,比较反应热△H要带上正负号比较。eg:在同温同压下,下列各组热化学方程式中 Q2 ﹥Q1的是( )
(A) 2H2(g) + O2(g) == 2H2O(g) ; △H = -Q1 KJ / mol
2H2(g) + O2(g) == 2H2O(l) ; △H = -Q2 KJ / mol
(B) S(g) + O2(g) == SO2(g) ; △H = -Q1 KJ / mol
S(s) + O2(g) == SO2(g) ; △H = -Q2 KJ / mol
(C) C(s) + 1/2O2(g) == CO(g) ; △H = -Q1 KJ / mol
C(s) + O2(g) == CO2(g) ; △H = -Q2 KJ / mol
(D) H2(g) + Cl2(g) === 2HCl(g) ; △H = -Q1 KJ / mol
1/2H2(g) + 1/2Cl2(g) === HCl(g) ; △H = -Q2 KJ / mol AC eg:已知常温常压下,N2(g)和H2(g)反应生成2mol NH3(g),放出92.4kJ热量,在同温同压下向密闭容器中通入1mol N2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.5mol N2和1.5mol H2、1mol NH3,相同温度下达到平衡时放出热量为Q2kJ,则下列叙述正确的是( )
A. Q2 C. Q12.用一个量筒量取50mL0.50mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
3.用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入表格。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
5.重复实验两次,取测量所得数据的平均值作为计算依据。
6.根据实验数据计算中和热 能源的分类 ①从能源的原有形态是否改变的角度分为
自然界现存的一次能源:
由一次能源加工转化而成的二次能源:②从能源能否循环再生角度,可将能源分为可再生能源和不可再生能源。煤、石油是古代动植物经长期地质运动作用形成的,这是不可再生能源;像太阳能、风力、或从绿色植物中制取的酒精等,是可再生能源。煤、石油、天然气、水力、太阳能 如:煤气、液化气、汽油、煤油、酒精、电能等。使用化石燃料的利弊及新能源的开发(1)重要的化石燃料:煤、石油、天然气。
(2)煤作燃料的利弊问题:
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。(3)燃料充分燃烧的条件:①要有足够的空气;(1)木材:可以采用多种形式来灭火;
(2)活泼金属:不能用水、不能用二氧化碳等来灭火;因为水、二氧化碳与活泼金属都会反应,从而加剧燃烧;
(3)带电物质:不能用水,否则易出人命事故;
(4)油料:可以采用切断油源、实物覆盖、隔绝空气、爆炸堵绝等方式来灭火。 ②跟空气有足够大的接触面。灭火的方法
①调整和优化能源结构,降低化石燃料在能源结构中的比率。
②最有希望的新能源是太阳能、燃料电池、风能地热能、海洋能和氢能等。
这些新能源的特点是:
①资源丰富、经济, ②有些可以再生,为再生能源, ③对环境没有污染或污染少。(4)新能源的开发:
2.了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热(燃烧热、中和热)等概念。
3.了解热化学方程式的含义。
4.能用键能、盖斯定律进行反应热的简单计算。
5.了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。考纲要求吸收或放出 恒压条件下 kJ/mol 一、焓变 反应热1.反应热和焓变
(1)反应热是化学反应中________________的热量。
(2)焓变是化学反应在____________放出或吸收的热量。
(3)化学反应的反应热用一定条件下的焓变表示,符号为ΔH,单位为______。 放热反应 吸热反应取决于反应物和生成物能量的相对大小吸收放出>><<取决于旧键断裂吸收能量和新键形成放
出能量的相对大小3、常见的吸热反应和放热反应二、重要的反应热-燃烧热1.概念:在101kPa时,1mol物质完全燃烧生成
稳定的氧化物时所放出的热量,叫做
该物质的燃烧热 2.单位:kJ/mol(1)燃烧的物质必须为:1mol
(2)完全燃烧是指物质中下列元素完全转变成对应的物质:C→CO2(g),H→H2O(l),S→SO2(g)等。
(3)燃烧热通常由实验测得3.注意:4.表示的意义: 例如:C的燃烧热为393.5kJ/mol,表示:
在101kPa时1molC完全燃烧放出393.5kJ的热量。
★ 燃烧热是以1mol物质完全燃烧放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1mol物质为标准来配平其余物质的系数。例如:
C8H18(g)+25/2O2(g)= 8CO2(g)十 9H2O(l);
△H=-5518kJ/mol
C8H18的燃烧热为5518kJ/mol。二、重要的反应热-中和热在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫中和热。1.概念:①条件:②反应物:③生成物及物质的量:④放出的热量:稀溶液强酸与强碱生成1mol的H2O△H=-57.3kJ/mol。2.注意:若用弱酸代替强酸,或用弱 碱代替强碱,因中和过程中弱电解质电离吸热,会使测得中和热的数值偏低。燃烧热与中和热的区别和联系放热反应△H<0 单位:kJ/mol1mol燃料可能是1mol,也可能是0.5或1/3mol等不限量生成的水为1mol1mol物质完全燃烧时放出的热量;不同物质,燃烧热不同生成1mol水时放出的热量;不同强酸强碱的中和热大致相同,均约为:57.3kJ/mol 练习: 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1); ?H=-57.3kJ/mol,向1L0.5mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应?H1,?H2,?H3的关系正确的是( )
A. ?H1>?H2>?H3 B. ?H1 C. ?H2?H3>?H2D三、热化学方程式表明反应所放出或吸收的热量的化学方程式。1.概念: (1) 注明各物质的聚集状态。(气:g,液:l,固:s) (2) △H“-”,为放热反应,△H“+”为吸热反应(3) 需注明反应的温度和压强,若不注明温度和压强,一般指250C ,1.01×105Pa系数只表示物质的量,可以是整数、小数或分数。(5) 系数必须与反应热相对应。3.书写热化学方程式注意事项2.意义:溶液:aq不仅表示化学反应中的物质变化,还表示化学反应中的能量变化。例:2H2(g)+ O2 (g)= 2H2O (l); △H= - 571.6 kJ/mol方法总结关键提醒四、有关热化学方程式的计算和比较1、计算的主要方法:
(2)能量:根据反应物和生成物的总能量计算
ΔH=E生成物-E反应物。
(3)化学键:依据反应物化学键断裂与生成物化学键形成过程中的能量变化计算
ΔH=化学键断裂吸收的能量-化学键形成释放的能量
=反应物的键能之和-生成物的键能之和 (1)根据热化学方程式的计算
反应热与反应物各物质的物质的量成正比。 化学反应不管是一步完成还是分几步完成,其反应热是相同的。即:化学反应的反应热,只与反应的始态(各反应物)和终态(各生成物)有关,而与反应具体进行的途径无关。应用:间接计算一些无法直接测定的反应热 (4)根据盖斯定律计算2、比较的主要方法:
(1)同一反应生成物状态不同时
A(g)+B(g)===C(g) ΔH1<0
A(g)+B(g)===C(l) ΔH2<0
因为C(g)===C(l) ΔH3<0,
则ΔH3=ΔH2-ΔH1,所以ΔH2<ΔH1。注意:比较热量不考虑正负号,比较反应热△H要带上正负号比较。eg:在同温同压下,下列各组热化学方程式中 Q2 ﹥Q1的是( )
(A) 2H2(g) + O2(g) == 2H2O(g) ; △H = -Q1 KJ / mol
2H2(g) + O2(g) == 2H2O(l) ; △H = -Q2 KJ / mol
(B) S(g) + O2(g) == SO2(g) ; △H = -Q1 KJ / mol
S(s) + O2(g) == SO2(g) ; △H = -Q2 KJ / mol
(C) C(s) + 1/2O2(g) == CO(g) ; △H = -Q1 KJ / mol
C(s) + O2(g) == CO2(g) ; △H = -Q2 KJ / mol
(D) H2(g) + Cl2(g) === 2HCl(g) ; △H = -Q1 KJ / mol
1/2H2(g) + 1/2Cl2(g) === HCl(g) ; △H = -Q2 KJ / mol AC eg:已知常温常压下,N2(g)和H2(g)反应生成2mol NH3(g),放出92.4kJ热量,在同温同压下向密闭容器中通入1mol N2和3molH2,达平衡时放出热量为Q1kJ;向另一体积相同的容器中通入0.5mol N2和1.5mol H2、1mol NH3,相同温度下达到平衡时放出热量为Q2kJ,则下列叙述正确的是( )
A. Q2
3.用另一个量筒量取50mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入表格。
4.把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
5.重复实验两次,取测量所得数据的平均值作为计算依据。
6.根据实验数据计算中和热 能源的分类 ①从能源的原有形态是否改变的角度分为
自然界现存的一次能源:
由一次能源加工转化而成的二次能源:②从能源能否循环再生角度,可将能源分为可再生能源和不可再生能源。煤、石油是古代动植物经长期地质运动作用形成的,这是不可再生能源;像太阳能、风力、或从绿色植物中制取的酒精等,是可再生能源。煤、石油、天然气、水力、太阳能 如:煤气、液化气、汽油、煤油、酒精、电能等。使用化石燃料的利弊及新能源的开发(1)重要的化石燃料:煤、石油、天然气。
(2)煤作燃料的利弊问题:
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生SO2等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。(3)燃料充分燃烧的条件:①要有足够的空气;(1)木材:可以采用多种形式来灭火;
(2)活泼金属:不能用水、不能用二氧化碳等来灭火;因为水、二氧化碳与活泼金属都会反应,从而加剧燃烧;
(3)带电物质:不能用水,否则易出人命事故;
(4)油料:可以采用切断油源、实物覆盖、隔绝空气、爆炸堵绝等方式来灭火。 ②跟空气有足够大的接触面。灭火的方法
①调整和优化能源结构,降低化石燃料在能源结构中的比率。
②最有希望的新能源是太阳能、燃料电池、风能地热能、海洋能和氢能等。
这些新能源的特点是:
①资源丰富、经济, ②有些可以再生,为再生能源, ③对环境没有污染或污染少。(4)新能源的开发:
