课题2 酸和碱的中和反应 (共47张PPT)
文档属性
| 名称 | 课题2 酸和碱的中和反应 (共47张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-17 00:00:00 | ||
图片预览






文档简介
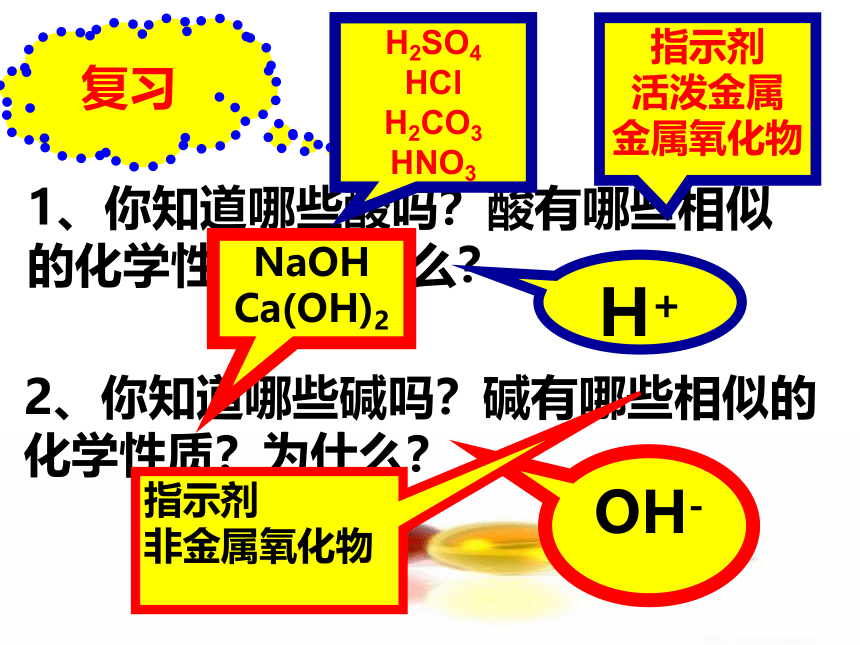
课件47张PPT。第十单元 酸和碱课题2 酸和碱的中和反应复习1、你知道哪些酸吗?酸有哪些相似的化学性质?为什么?2、你知道哪些碱吗?碱有哪些相似的化学性质?为什么?H2SO4
HCl
H2CO3
HNO3指示剂
活泼金属
金属氧化物H+NaOH
Ca(OH)2OH-指示剂
非金属氧化物复习练习:3.在酸中加入锌粒,会看到 这说明了酸能跟 反应。4.往生锈的铁钉中加入酸,看到铁锈会
这说明了酸能跟 反应。有大量的气泡冒出金属溶解 金属氧化物2.酸加入紫色石蕊试液,溶液变 色,加入无色酚酞,溶液 ,这说明了酸能跟 反应。 红不变色酸碱指示剂1.常见的酸有 盐酸(HCl)、硫酸(H2SO4)等碱 (金属离子 + OH- )3.澄清的石灰水中通入CO2,变 说明碱能跟 反应。蓝红酸碱指示剂浑浊非金属氧化物2.在碱中加入紫色石蕊试液变 色,加入无色 酚酞溶液变 色,这说明了碱能跟 反应。 1.常见的碱有 ;
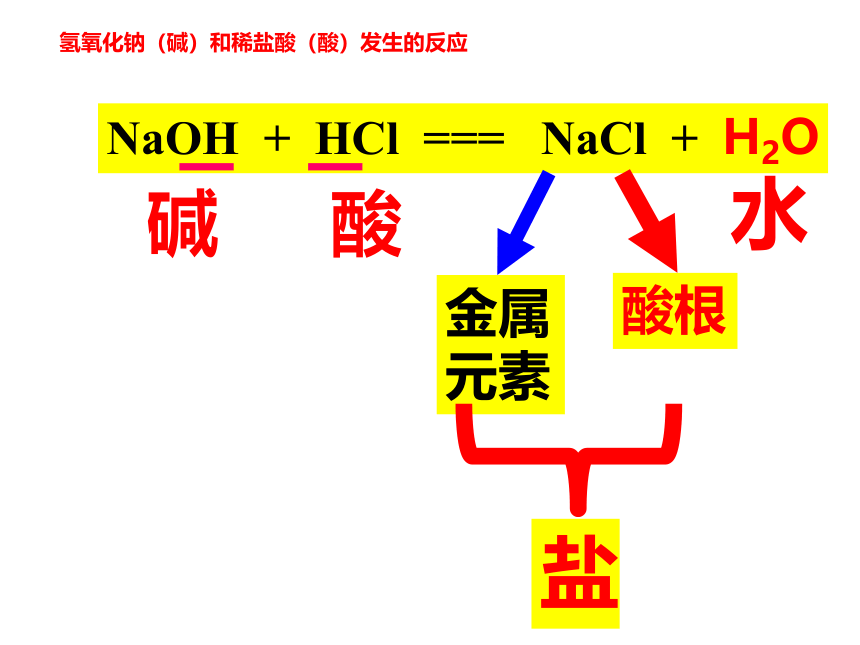
其中比较常见的是 ,它可以用 与水反应直接制得。NaOH、Ca(OH)2等氢氧化钙生石灰想一想 酸和碱混合在一起,会发生化学反应吗?活动与探究:溶液由红色逐渐变为无色讨论1、NaOH与盐酸反应了吗?
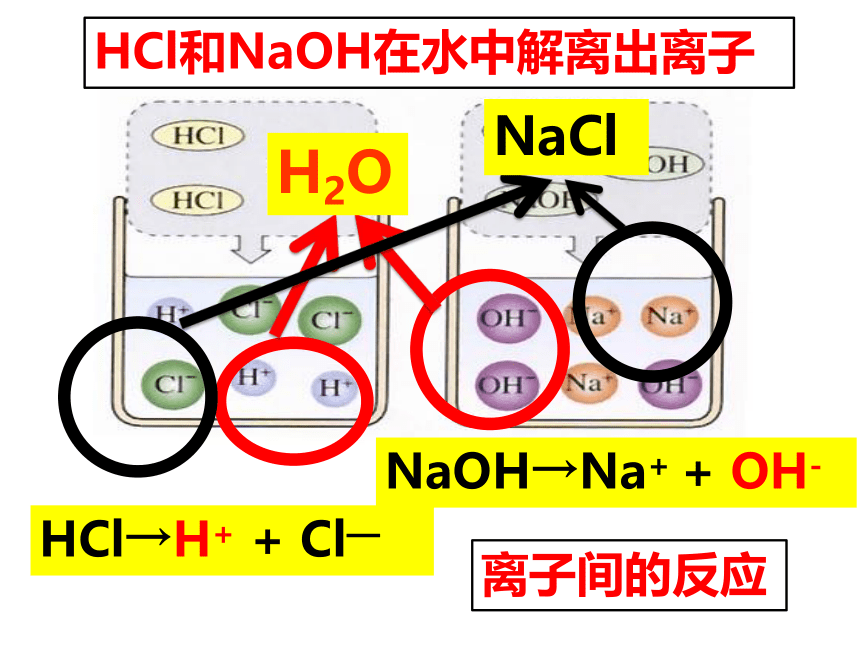
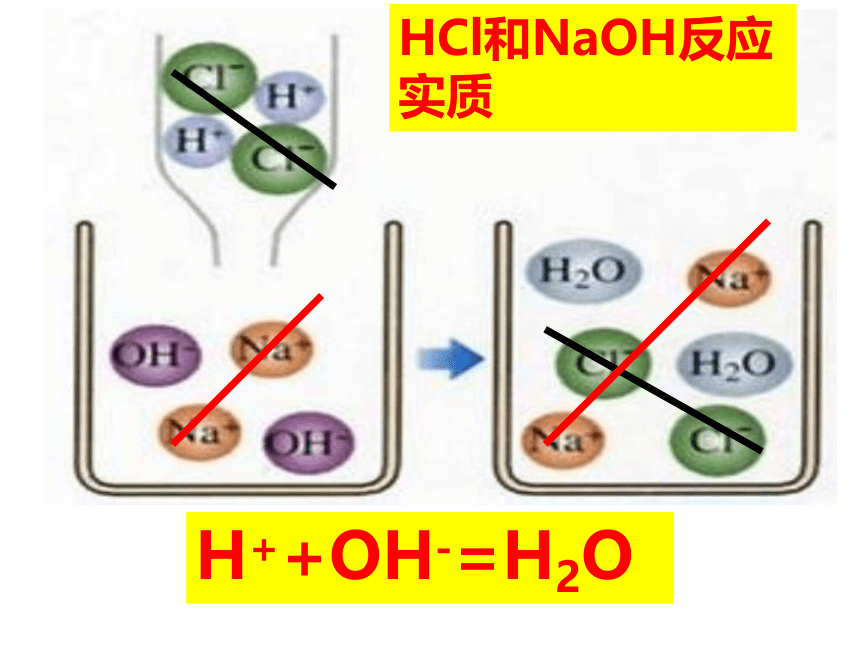
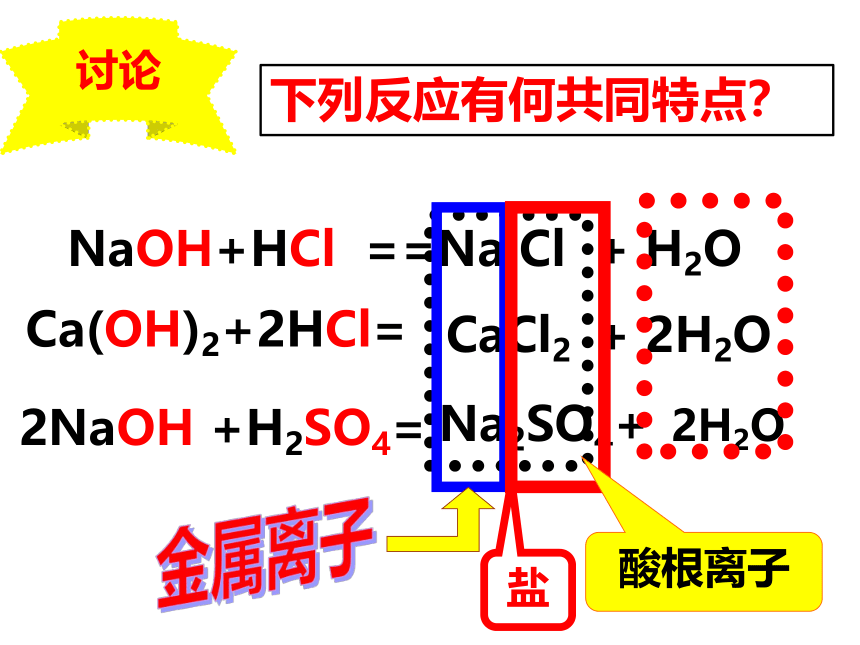
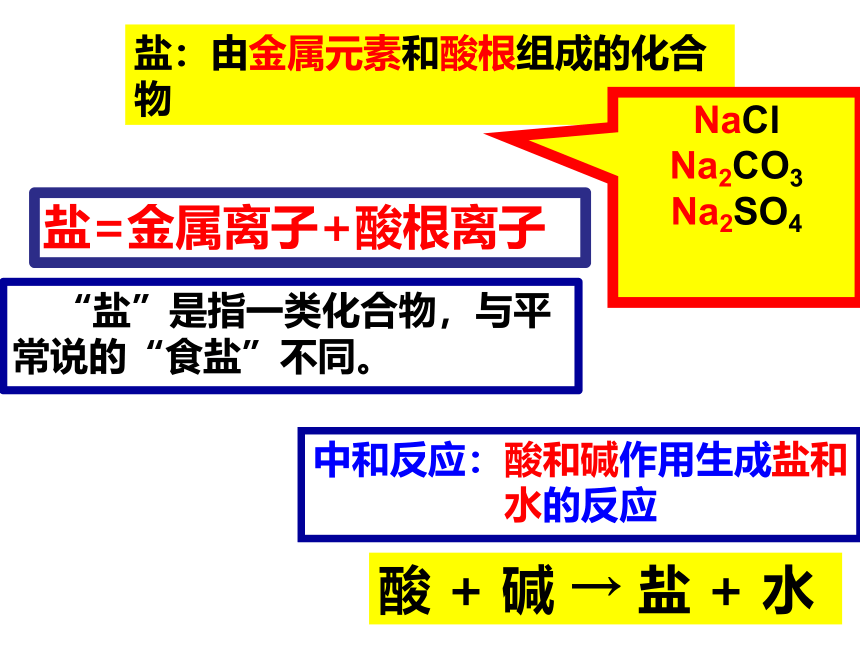
2、它们之间可能会生成什么物质?你能写出该反应的化学方程式吗?发生了反应氢氧化钠(碱)和稀盐酸(酸)发生的反应NaOH + HCl === NaCl + H2O碱酸水HCl→H+ + Cl—NaOH→Na+ + OH-— HCl和NaOH在水中解离出离子离子间的反应H++OH-=H2OHCl和NaOH反应实质讨论下列反应有何共同特点?NaOH+HCl ==Na Cl + H2OCa(OH)2+2HCl=CaCl2 + 2H2O2NaOH +H2SO4=Na2SO4+ 2H2O金属离子酸根离子盐盐:由金属元素和酸根组成的化合物中和反应:酸和碱作用生成盐和水的反应酸 + 碱 → 盐 + 水 “盐”是指一类化合物,与平常说的“食盐”不同。NaCl
Na2CO3
Na2SO4盐=金属离子+酸根离子常见的中和反应 酸 + 碱 = 盐 + 水
HCl + NaOH = NaCl + H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
H2SO4+ 2 NaOH = Na2SO4 + 2H2O
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
HNO3 + NaOH = NaNO3 + H2O反应特征:H+ + OH- = H2O1.下列物质属于盐的是( )
A CaO B Ca(OH)2 C CuSO4 D HCl2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物课堂练习一酸H+ + 酸根离子碱金属离子+ OH-盐金属离子+酸根离子小 结:化合物的分类氧化物金属或非金属元素+氧元素1.下列物质属于盐的是( )
A. CuO B. Cu(OH)2 C. CuSO4
D. HCl2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物课堂练习一1.下列反应,属于中和反应的是( )
A. Zn +2HCl = ZnCl2 + H2
B. CuO + 2HCl =CuCl2 + H2O
C. Ca(OH)2 + H2SO4 = CaSO4 +2H2O
D. CaCO3 + 2HCl =CaCl2 + H2O+CO2
课堂练习二C二、中和反应在实际中的应用●改变土壤的酸碱性●处理工厂的废水●用于医药 ◆中和胃酸◆制成含碱性物质的药水,
防蚊虫叮咬 植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长。应怎样去改变酸性土壤?用熟石灰中和。1、改变土壤的酸碱性
根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利用植物生长。在
酸
性
土
壤
中
加
入
熟
石
灰 某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢? 应在排放前用碱性物质(例如熟石灰)进行中和处理。你能写出化学方程式吗?Ca(OH)2 + H2 SO4 =CaSO4 +2H2O2、处理工厂的废水 2、处理工厂的废水处理工厂的废水污
水
处
理胃乐说明书
[药品名称] 胃乐胶囊
[性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦
[主要成分] 氢氧化铝[Al(OH)3 ]、甘草提取物等
[药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎
[功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心呕吐,气滞引起的胃腕疼痛。
[用法与用量] 口服,一次2~3粒,一日3次,空腹服用
[规格] 0.4g/粒
[贮藏] 密封,置干燥阴凉处
[包装] 20粒/盒
[有效期] 两年胃 乐好药用心制造3、用于医药Al(OH)3盐酸Al(OH)3Al(OH)3 + 3HCl = AlCl3 + 3H2O原理:氢氧化铝能中和胃酸你能写出化学方程式吗?思考:
为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?这是因为蚊虫在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。涂一些含有碱性物质的药水除去酸,就可以减轻痛痒。
小结:酸和碱的化学性质酸有一些相似的化学性质:⑴酸能使酸碱指示剂显示不同的颜色;
⑵酸能与多种活泼金属反应,生成盐和氢气;
⑶酸能与某些金属氧化物反应,生成盐和水。
⑷酸能与碱反应。⑸酸能与某些盐反应。碱有一些相似的化学性质:⑴碱能使酸碱指示剂显示不同的颜色;
⑵碱能与某些非金属氧化物反应,生成盐和水。
⑶碱能与酸反应。
⑷碱能与某些盐反应。 三、溶液酸碱度的表法—pH1. pH的范围通常在0~14之间 溶液的酸碱性:表示溶液是酸性还是碱性的。(用酸碱指示剂检验--同酸碱同变色)溶液的酸碱度:表示溶液酸碱性的强弱程度。 (用pH试纸测定)⑴pH 7,溶液呈中性 。⑶ pH 7,溶液呈碱性,pH值越大,碱性越强。=﹥如NaCl、Na2SO4等溶液如HCl、H2SO4等溶液⑵ pH 7,溶液呈酸性, pH值越小,酸性越强如Ca(OH)2 、NaOH 等溶液 2. 溶液的酸碱性与酸碱度(即pH)的关系:0 7 14中性﹤ [实验] 用pH试纸测定溶液的pH值3. pH的测定——用pH试纸测定 在玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取待测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。测定方法:1、蘸 2、比 3、读数用PH试纸测定一些溶液的PH用pH试纸测pH时,需要注意:1.用玻璃棒蘸取液滴在pH试纸上不能把试纸放入试剂瓶里(防止污染药品)
2.立即读数准确读数(时间一长,pH试纸会变色)
3.取整数值(更符合实际)4. 了解溶液的酸碱度有重要意义: ①化工生产中许多反应必须在一定pH溶液里才能进行; ②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长; ③测定雨水的pH,可以了解空气的污染情况[注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6]; ④测定人体内或排出的液体的pH,可以了解人体的健康状况。5. 人体内的一些液体和排泄物的正常pH范围资料3.由金属离子和酸根离子构成的化合物叫做盐。1.中和反应:中和反应在生活和生产中有广泛的应用:
⑴农业 ⑵工业 ⑶生活 2.溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱度。 pH 在0—14之间。⑵了解溶液酸碱度在实际中有重要的意义农业 、工业 、环境 、生活酸+碱→盐+水①pH 7,溶液呈中性,
②pH 7溶液呈酸性, PH越小,酸性越强,
③pH 7溶液呈碱性, PH越大,碱性越强。⑴溶液的酸碱性与pH的关系:﹥﹤=1. 某溶液pH=0,则该溶液 ( )
(A)呈酸性 (B)呈碱性
(C)呈中性 (D)无法判断酸碱性
2. 人体内一些液体的近似pH值如下:血浆
7.35,胆汁7.1,胰液7.8,胃液0.9,其中一种液体呈酸性,该液体是 ( )
(A)血浆 (B)胆汁 (C)胰液 (D)胃液
3.已知苹果汁的近似pH值为2.9~3.3,在苹果汁
中滴入紫色石蕊试液,显示的颜色是 ( )
(A)无色 (B)红色 (C)蓝色 (D)紫色ADB4、在NaOH溶液中不断地加入水,下列能正确表示溶液的pH值变化的曲线是( )7 7 7 7 A 水 B 水 C 水 D 水PHPHPHPH指导:一看起点
二看趋势
三看终点D5、在NaOH溶液中不断地加入盐酸,下列能正确表示溶液的pH值变化的曲线是( )7 7 7 7 A 水 B 水 C 水 D 水PHPHPHPH1、改变溶液的酸碱度的方法:加水、加酸或碱。2、加水不会改变溶液的酸碱性,只会使酸碱度变弱。C 7.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。无加碱性溶液6、PH不同的下列溶液混合后,溶液可以为中性的是( )
A、2和5 B、0和7 C、1和6 D、3和8D8、把10g质量分数为10%的盐酸和10g质量分数为10%的烧碱溶液混合均匀后,再滴入石蕊试液,则溶液呈 色。 HCl + NaOH =NaCl + H2O36.5 40红10×10%=19.下表列出了家庭中一些物质的pH: ⑴上述物质中能使无色酚酞试液变红的是___________;⑵黄蜂的刺液是碱性的,若你被黄蜂刺了,应用上述物质中的___________ 涂在皮肤上,理由是__________________。酸碱中和肥皂水、牙膏食醋10.下列各pH值表示溶液酸性最强的是( )
(A)pH=14 (B)pH=7
(C)pH=1 (D)pH=0
11. 有一瓶溶液pH值是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈 色,如果要使试管里的溶液pH值降至5,可以的采取 方法. D红色加酸的4.失去标签的三瓶无色液体,分别是稀HCl、
蒸馏水、NaOH溶液,可用 加以区分。蒸馏水稀盐酸NaOH步骤:⑵分别滴加石蕊,振荡。变蓝的是NaOH溶液 变红的是稀盐酸⑴用三支试管,分别取少量三种无色液体。 仍然是紫色是蒸馏水紫色石蕊溶液操作---现象---结论本单元小结一、酸和碱 1.HCl和H2SO4属于酸,酸在水中解离出H+和酸根离子。 2.NaOH和Ca(OH)2属于碱,碱在水中解离出金属离子和OH-。3.酸和碱在生产和生活中有广泛的用途。二、酸和碱的化学性质 1.酸和碱都能与指示剂反应,指示剂遇酸或碱显示不同的颜色。变红变红变蓝不变色2.酸能与多种活泼(H前)金属反应,生成盐和氢气,如:Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Mg+H2SO4=MgSO4+H2↑+23.酸能与某些金属氧化物反应,生成盐和水,如:Fe2O3+ HCl= FeCl3+ H2OFe2O3+ H2SO4=Fe2(SO4)3+ H2O(无色)(硫酸铁,黄色)33263+3+3+3-2-1+3(硫酸亚铁,浅绿色)(氯化亚铁,浅绿色)4.碱能与某些非金属氧化物反应,生成盐和水如:Ca(OH)2+CO2=CaCO3 ↓+ H2O2NaOH+CO2= Na2CO3 + H2O2NaOH+SO3=Na2SO4 + H2O硫酸钠碳酸钠碳酸钙5.酸和碱能发生中和反应,生成盐和水,如:HCl?+?NaOH=?NaCl?+H2OH2SO4+?Ca(OH)2?=?CaSO4?+?2H2O①pH 7,溶液呈中性,
②pH 7溶液呈酸性, PH越小,酸性越强,
③pH 7溶液呈碱性, PH越大,碱性越强。 溶液的酸碱度可用pH表示,范围通常 在0~14之间。用pH试纸可以测定溶液的酸碱度。溶液的酸碱性与pH的关系:三、溶液的酸碱度的表示方法——pH﹥﹤=
HCl
H2CO3
HNO3指示剂
活泼金属
金属氧化物H+NaOH
Ca(OH)2OH-指示剂
非金属氧化物复习练习:3.在酸中加入锌粒,会看到 这说明了酸能跟 反应。4.往生锈的铁钉中加入酸,看到铁锈会
这说明了酸能跟 反应。有大量的气泡冒出金属溶解 金属氧化物2.酸加入紫色石蕊试液,溶液变 色,加入无色酚酞,溶液 ,这说明了酸能跟 反应。 红不变色酸碱指示剂1.常见的酸有 盐酸(HCl)、硫酸(H2SO4)等碱 (金属离子 + OH- )3.澄清的石灰水中通入CO2,变 说明碱能跟 反应。蓝红酸碱指示剂浑浊非金属氧化物2.在碱中加入紫色石蕊试液变 色,加入无色 酚酞溶液变 色,这说明了碱能跟 反应。 1.常见的碱有 ;
其中比较常见的是 ,它可以用 与水反应直接制得。NaOH、Ca(OH)2等氢氧化钙生石灰想一想 酸和碱混合在一起,会发生化学反应吗?活动与探究:溶液由红色逐渐变为无色讨论1、NaOH与盐酸反应了吗?
2、它们之间可能会生成什么物质?你能写出该反应的化学方程式吗?发生了反应氢氧化钠(碱)和稀盐酸(酸)发生的反应NaOH + HCl === NaCl + H2O碱酸水HCl→H+ + Cl—NaOH→Na+ + OH-— HCl和NaOH在水中解离出离子离子间的反应H++OH-=H2OHCl和NaOH反应实质讨论下列反应有何共同特点?NaOH+HCl ==Na Cl + H2OCa(OH)2+2HCl=CaCl2 + 2H2O2NaOH +H2SO4=Na2SO4+ 2H2O金属离子酸根离子盐盐:由金属元素和酸根组成的化合物中和反应:酸和碱作用生成盐和水的反应酸 + 碱 → 盐 + 水 “盐”是指一类化合物,与平常说的“食盐”不同。NaCl
Na2CO3
Na2SO4盐=金属离子+酸根离子常见的中和反应 酸 + 碱 = 盐 + 水
HCl + NaOH = NaCl + H2O
2HCl + Ca(OH)2 = CaCl2 + 2H2O
H2SO4+ 2 NaOH = Na2SO4 + 2H2O
H2SO4+ Ca(OH)2 = CaSO4 + 2H2O
HNO3 + NaOH = NaNO3 + H2O反应特征:H+ + OH- = H2O1.下列物质属于盐的是( )
A CaO B Ca(OH)2 C CuSO4 D HCl2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物课堂练习一酸H+ + 酸根离子碱金属离子+ OH-盐金属离子+酸根离子小 结:化合物的分类氧化物金属或非金属元素+氧元素1.下列物质属于盐的是( )
A. CuO B. Cu(OH)2 C. CuSO4
D. HCl2.填写下表(类别按酸、碱、盐、氧化物填写)CNaOH碱硫酸铜盐H2SO4酸Fe2O3氧化物课堂练习一1.下列反应,属于中和反应的是( )
A. Zn +2HCl = ZnCl2 + H2
B. CuO + 2HCl =CuCl2 + H2O
C. Ca(OH)2 + H2SO4 = CaSO4 +2H2O
D. CaCO3 + 2HCl =CaCl2 + H2O+CO2
课堂练习二C二、中和反应在实际中的应用●改变土壤的酸碱性●处理工厂的废水●用于医药 ◆中和胃酸◆制成含碱性物质的药水,
防蚊虫叮咬 植物需要在一定酸碱性的土壤中生长,但近年来由于不合理使用化肥,或酸雨的形成,破坏土壤的酸碱性,不利于植物的生长。应怎样去改变酸性土壤?用熟石灰中和。1、改变土壤的酸碱性
根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性物质,以调节土壤的酸碱性,利用植物生长。在
酸
性
土
壤
中
加
入
熟
石
灰 某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢? 应在排放前用碱性物质(例如熟石灰)进行中和处理。你能写出化学方程式吗?Ca(OH)2 + H2 SO4 =CaSO4 +2H2O2、处理工厂的废水 2、处理工厂的废水处理工厂的废水污
水
处
理胃乐说明书
[药品名称] 胃乐胶囊
[性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦
[主要成分] 氢氧化铝[Al(OH)3 ]、甘草提取物等
[药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎
[功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心呕吐,气滞引起的胃腕疼痛。
[用法与用量] 口服,一次2~3粒,一日3次,空腹服用
[规格] 0.4g/粒
[贮藏] 密封,置干燥阴凉处
[包装] 20粒/盒
[有效期] 两年胃 乐好药用心制造3、用于医药Al(OH)3盐酸Al(OH)3Al(OH)3 + 3HCl = AlCl3 + 3H2O原理:氢氧化铝能中和胃酸你能写出化学方程式吗?思考:
为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?这是因为蚊虫在人的皮肤内分泌出蚁酸,从而使皮肤肿痛。涂一些含有碱性物质的药水除去酸,就可以减轻痛痒。
小结:酸和碱的化学性质酸有一些相似的化学性质:⑴酸能使酸碱指示剂显示不同的颜色;
⑵酸能与多种活泼金属反应,生成盐和氢气;
⑶酸能与某些金属氧化物反应,生成盐和水。
⑷酸能与碱反应。⑸酸能与某些盐反应。碱有一些相似的化学性质:⑴碱能使酸碱指示剂显示不同的颜色;
⑵碱能与某些非金属氧化物反应,生成盐和水。
⑶碱能与酸反应。
⑷碱能与某些盐反应。 三、溶液酸碱度的表法—pH1. pH的范围通常在0~14之间 溶液的酸碱性:表示溶液是酸性还是碱性的。(用酸碱指示剂检验--同酸碱同变色)溶液的酸碱度:表示溶液酸碱性的强弱程度。 (用pH试纸测定)⑴pH 7,溶液呈中性 。⑶ pH 7,溶液呈碱性,pH值越大,碱性越强。=﹥如NaCl、Na2SO4等溶液如HCl、H2SO4等溶液⑵ pH 7,溶液呈酸性, pH值越小,酸性越强如Ca(OH)2 、NaOH 等溶液 2. 溶液的酸碱性与酸碱度(即pH)的关系:0 7 14中性﹤ [实验] 用pH试纸测定溶液的pH值3. pH的测定——用pH试纸测定 在玻璃片上放一小片pH 试纸,用干净的玻璃棒蘸取待测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。测定方法:1、蘸 2、比 3、读数用PH试纸测定一些溶液的PH用pH试纸测pH时,需要注意:1.用玻璃棒蘸取液滴在pH试纸上不能把试纸放入试剂瓶里(防止污染药品)
2.立即读数准确读数(时间一长,pH试纸会变色)
3.取整数值(更符合实际)4. 了解溶液的酸碱度有重要意义: ①化工生产中许多反应必须在一定pH溶液里才能进行; ②在农业生产中,农作物一般适宜在pH为7或接近7的土壤中生长; ③测定雨水的pH,可以了解空气的污染情况[注:正常雨水(含H2CO3)的pH约为5.6,酸雨的pH小于5.6]; ④测定人体内或排出的液体的pH,可以了解人体的健康状况。5. 人体内的一些液体和排泄物的正常pH范围资料3.由金属离子和酸根离子构成的化合物叫做盐。1.中和反应:中和反应在生活和生产中有广泛的应用:
⑴农业 ⑵工业 ⑶生活 2.溶液的酸碱度可用pH表示,用pH试纸可以测定溶液的酸碱度。 pH 在0—14之间。⑵了解溶液酸碱度在实际中有重要的意义农业 、工业 、环境 、生活酸+碱→盐+水①pH 7,溶液呈中性,
②pH 7溶液呈酸性, PH越小,酸性越强,
③pH 7溶液呈碱性, PH越大,碱性越强。⑴溶液的酸碱性与pH的关系:﹥﹤=1. 某溶液pH=0,则该溶液 ( )
(A)呈酸性 (B)呈碱性
(C)呈中性 (D)无法判断酸碱性
2. 人体内一些液体的近似pH值如下:血浆
7.35,胆汁7.1,胰液7.8,胃液0.9,其中一种液体呈酸性,该液体是 ( )
(A)血浆 (B)胆汁 (C)胰液 (D)胃液
3.已知苹果汁的近似pH值为2.9~3.3,在苹果汁
中滴入紫色石蕊试液,显示的颜色是 ( )
(A)无色 (B)红色 (C)蓝色 (D)紫色ADB4、在NaOH溶液中不断地加入水,下列能正确表示溶液的pH值变化的曲线是( )7 7 7 7 A 水 B 水 C 水 D 水PHPHPHPH指导:一看起点
二看趋势
三看终点D5、在NaOH溶液中不断地加入盐酸,下列能正确表示溶液的pH值变化的曲线是( )7 7 7 7 A 水 B 水 C 水 D 水PHPHPHPH1、改变溶液的酸碱度的方法:加水、加酸或碱。2、加水不会改变溶液的酸碱性,只会使酸碱度变弱。C 7.某工厂排放的废水的pH是4.5,取少量该废水加入试管中,再滴酚酞溶液,溶液呈______色,如果要使试管里溶液的pH升高到=7,可以采用 __________ 的方法。无加碱性溶液6、PH不同的下列溶液混合后,溶液可以为中性的是( )
A、2和5 B、0和7 C、1和6 D、3和8D8、把10g质量分数为10%的盐酸和10g质量分数为10%的烧碱溶液混合均匀后,再滴入石蕊试液,则溶液呈 色。 HCl + NaOH =NaCl + H2O36.5 40红10×10%=19.下表列出了家庭中一些物质的pH: ⑴上述物质中能使无色酚酞试液变红的是___________;⑵黄蜂的刺液是碱性的,若你被黄蜂刺了,应用上述物质中的___________ 涂在皮肤上,理由是__________________。酸碱中和肥皂水、牙膏食醋10.下列各pH值表示溶液酸性最强的是( )
(A)pH=14 (B)pH=7
(C)pH=1 (D)pH=0
11. 有一瓶溶液pH值是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈 色,如果要使试管里的溶液pH值降至5,可以的采取 方法. D红色加酸的4.失去标签的三瓶无色液体,分别是稀HCl、
蒸馏水、NaOH溶液,可用 加以区分。蒸馏水稀盐酸NaOH步骤:⑵分别滴加石蕊,振荡。变蓝的是NaOH溶液 变红的是稀盐酸⑴用三支试管,分别取少量三种无色液体。 仍然是紫色是蒸馏水紫色石蕊溶液操作---现象---结论本单元小结一、酸和碱 1.HCl和H2SO4属于酸,酸在水中解离出H+和酸根离子。 2.NaOH和Ca(OH)2属于碱,碱在水中解离出金属离子和OH-。3.酸和碱在生产和生活中有广泛的用途。二、酸和碱的化学性质 1.酸和碱都能与指示剂反应,指示剂遇酸或碱显示不同的颜色。变红变红变蓝不变色2.酸能与多种活泼(H前)金属反应,生成盐和氢气,如:Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Mg+H2SO4=MgSO4+H2↑+23.酸能与某些金属氧化物反应,生成盐和水,如:Fe2O3+ HCl= FeCl3+ H2OFe2O3+ H2SO4=Fe2(SO4)3+ H2O(无色)(硫酸铁,黄色)33263+3+3+3-2-1+3(硫酸亚铁,浅绿色)(氯化亚铁,浅绿色)4.碱能与某些非金属氧化物反应,生成盐和水如:Ca(OH)2+CO2=CaCO3 ↓+ H2O2NaOH+CO2= Na2CO3 + H2O2NaOH+SO3=Na2SO4 + H2O硫酸钠碳酸钠碳酸钙5.酸和碱能发生中和反应,生成盐和水,如:HCl?+?NaOH=?NaCl?+H2OH2SO4+?Ca(OH)2?=?CaSO4?+?2H2O①pH 7,溶液呈中性,
②pH 7溶液呈酸性, PH越小,酸性越强,
③pH 7溶液呈碱性, PH越大,碱性越强。 溶液的酸碱度可用pH表示,范围通常 在0~14之间。用pH试纸可以测定溶液的酸碱度。溶液的酸碱性与pH的关系:三、溶液的酸碱度的表示方法——pH﹥﹤=
同课章节目录
