2017-2018年高中化学必修二课件化学能与电能
文档属性
| 名称 | 2017-2018年高中化学必修二课件化学能与电能 |  | |
| 格式 | zip | ||
| 文件大小 | 279.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2017-11-20 09:30:00 | ||
图片预览










文档简介
课件60张PPT。化学能与电能 教材P40[实验2-4]②再用导线把锌
片和铜片连接起来,
中间接入一个电流表,
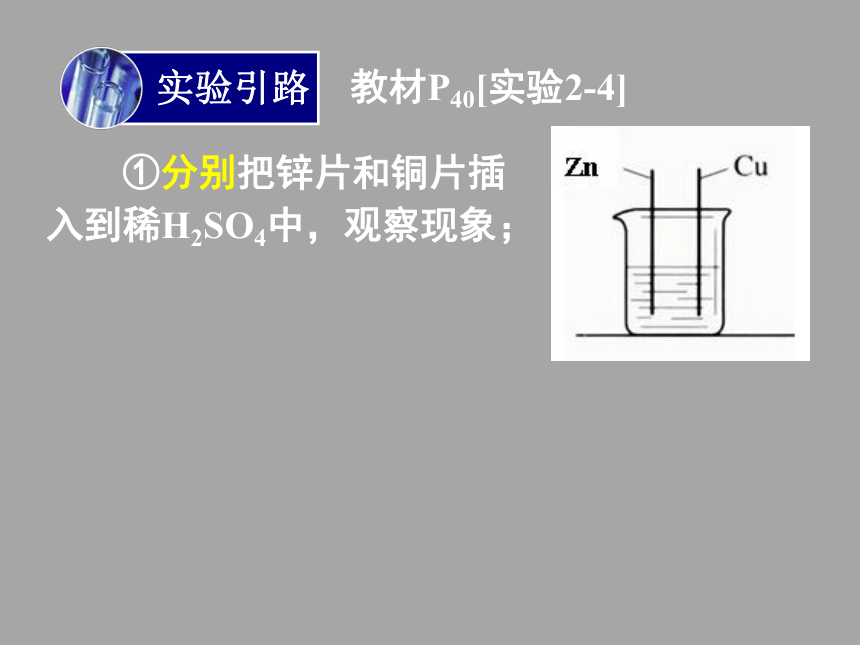
仔细观察现象。①分别把锌片和
铜片插入到稀H2SO4
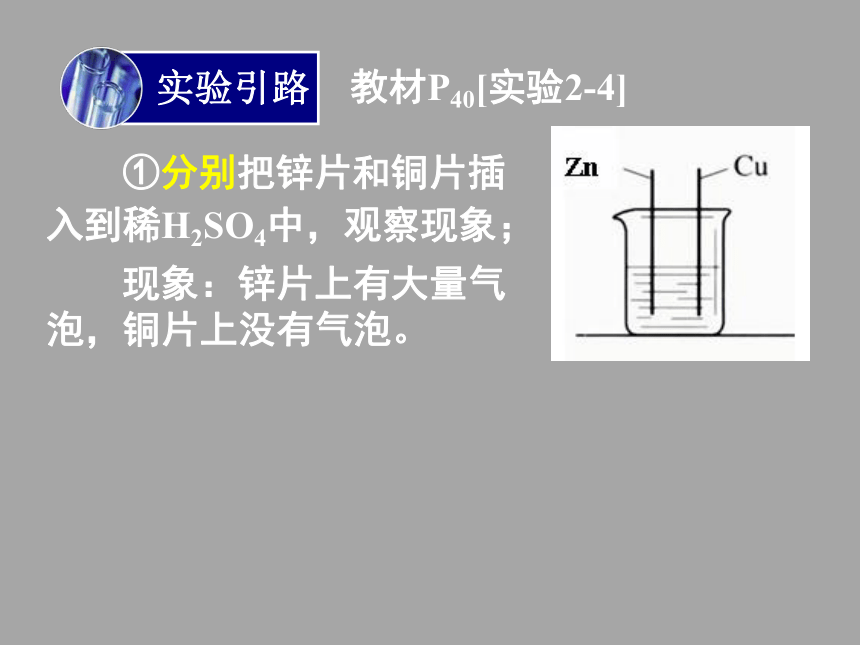
中,观察现象;实验引路 教材P40[实验2-4]①分别把锌片和铜片插
入到稀H2SO4中,观察现象;实验引路 教材P40[实验2-4]①分别把锌片和铜片插
入到稀H2SO4中,观察现象; 现象:锌片上有大量气
泡,铜片上没有气泡。实验引路 教材P40[实验2-4]①分别把锌片和铜片插
入到稀H2SO4中,观察现象; 现象:锌片上有大量气
泡,铜片上没有气泡。Zn + 2H+=== Zn2+ + H2↑ 失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原实验引路 教材P40[实验2-4]②再用导线把锌
片和铜片连接起来,
中间接入一个电流表,
仔细观察现象。实验引路 教材P40[实验2-4]②再用导线把锌
片和铜片连接起来,
中间接入一个电流表,
仔细观察现象。实验引路 现象:锌片不断溶解,铜片上有大量
气泡产生,电流表的指针发生偏转。根据现象推测②:锌电极:Zn-2e-=Zn2+铜电极:2H++2e-=H2↑总反应:Zn+2H+=Zn2++H2↑氧化反应还原反应根据现象推测②:锌电极:Zn-2e-=Zn2+铜电极:2H++2e-=H2↑总反应:Zn+2H+=Zn2++H2↑电子流动方向:负极→外电路→正极氧化反应还原反应根据现象推测②:锌电极:Zn-2e-=Zn2+铜电极:2H++2e-=H2↑总反应:Zn+2H+=Zn2++H2↑电子流动方向:负极→外电路→正极[结论] 导线中有电流通过,化学能转化成了电能。氧化反应还原反应(1)定义:把化学能转变为电能的装置.2.原电池(1)定义:把化学能转变为电能的装置.2.原电池原电池的能量转换效率一般能达到80%以上(1)定义:把化学能转变为电能的装置.2.原电池原电池的能量转换效率一般能达到80%以上
化学反应设计成原电池后反应速率明显加快(2)原电池工作原理①电极名称和电极反应(2)原电池工作原理①电极名称和电极反应(2)原电池工作原理负极(–): 失电子的极;发生氧化反应的极。
(电势较低的一极)①电极名称和电极反应(2)原电池工作原理正极(+): 得电子的极;发生还原反应的极。
(电势较高的一极)
负极(–): 失电子的极;发生氧化反应的极。
(电势较低的一极) ②外电路:自由电子导电。
金属导线将两根电极相连,或两根电极 直接接触。 ②外电路:自由电子导电。
金属导线将两根电极相连,或两根电极 直接接触。电子流向:电子从负极流出,经外电路 流向正极。
电流方向与电子移动方向相反。③内电路:离子导电。 ③内电路:离子导电。 电解质溶液中阴、阳离子迁移方向: 阴离子向负极移动,阳离子向正极移动。③内电路:离子导电。 电解质溶液中阴、阳离子迁移方向: 阴离子向负极移动,阳离子向正极移动。注意: 电解质溶液中有电流,没有电子流动!负极正极电解质溶液e-阴离子还原反应氧化反应阳离子外电路内电路思考 :如何判断原电池正与负极?思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 电子流出的一极—负极 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 电子流出的一极—负极 ④从电极反应本质: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: 原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 电子流出的一极—负极 ④从电极反应本质: 被氧化的一极—负极思考 :如何判断原电池正与负极?在你的实验桌上提供的药品和电极中选择:实验探究b.更换电极材料,看是否有气泡产生,电 流表指针是否偏转?a.更换溶液,有什么现象发生?电流表指 针是否偏转?(3)原电池的形成条件①自发的氧化还原反应②活动性不同的两电极
(金属和金属或金属与碳棒)
注意:燃料电池中可为两惰性电极!
③电解质溶液④形成闭合回路哪个装置可以形成原电池?不能形成原电池的 指出理由。 1.学以致用哪个装置可以形成原电池?不能形成原电池的 指出理由。 E1.学以致用实验探究为什么锌片上也有大量气泡产生?实验探究2.锌和稀硫酸的反应(补充) ①和②哪个试管中产生气泡速率更快?实验探究 ①在一支试管中加适量锌片,然后缓慢加 入约5mL稀硫酸。 ②在另一支试管中加入同样多的锌片,然 后缓慢加入约5mL稀硫酸,再加入10滴 CuSO4的溶液。1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!Zn+2H+=Zn2++H2↑
Zn+Cu2+=Zn2++Cu1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!Zn+2H+=Zn2++H2↑
Zn+Cu2+=Zn2++Cu结论:形成原电池可以加快化学反应速率。由于锌片中有比锌不活泼的金属或非金属 (如碳)等杂质,本身形成了很多微小的原电 池,所以锌片上也有大量气泡产生。1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!Zn+2H+=Zn2++H2↑
Zn+Cu2+=Zn2++Cu结论:形成原电池可以加快化学反应速率。怎样使化学能尽可能多地转化为电能?怎样使化学能尽可能多地转化为电能?①提高电极的纯度;②将产生副反应的电极和电解质溶液隔离。 2.格林太太是位漂亮、乐观、开朗的妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:其中一颗是黄金的——这是她富有的标志;另一颗是不锈钢的——这是一次车祸后留下的痕迹。
令人百思不解的是,自从车祸以后,格林太太经常头痛、夜间失眠、心情烦躁----医生绞尽了脑汁,格林太太的病情仍未好转-----
学完本节内容后,请你为格林太太开一个药方 。学以致用 2.格林太太是位漂亮、乐观、开朗的妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:其中一颗是黄金的——这是她富有的标志;另一颗是不锈钢的——这是一次车祸后留下的痕迹。
令人百思不解的是,自从车祸以后,格林太太经常头痛、夜间失眠、心情烦躁----医生绞尽了脑汁,格林太太的病情仍未好转-----
学完本节内容后,请你为格林太太开一个药方 。由金与铁(钢的主要成分)是活动性不同的两种金属,唾液中含有电解质,故构成了原电池,产生了微小的电流,使得格林太太头痛,因此必须换掉其中一颗假牙。学以致用 3.铁及铁的化合物应用广泛,如 FeCl3 可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ___________
负极反应____________学以致用1.原电池的定义:3.原电池的形成条件:2.原电池的工作原理:本课小结
化学反应设计成原电池后反应速率明显加快(2)原电池工作原理①电极名称和电极反应(2)原电池工作原理①电极名称和电极反应(2)原电池工作原理负极(–): 失电子的极;发生氧化反应的极。
(电势较低的一极)①电极名称和电极反应(2)原电池工作原理正极(+): 得电子的极;发生还原反应的极。
(电势较高的一极)
负极(–): 失电子的极;发生氧化反应的极。
(电势较低的一极) ②外电路:自由电子导电。
金属导线将两根电极相连,或两根电极 直接接触。 ②外电路:自由电子导电。
金属导线将两根电极相连,或两根电极 直接接触。电子流向:电子从负极流出,经外电路 流向正极。
电流方向与电子移动方向相反。③内电路:离子导电。 ③内电路:离子导电。 电解质溶液中阴、阳离子迁移方向: 阴离子向负极移动,阳离子向正极移动。③内电路:离子导电。 电解质溶液中阴、阳离子迁移方向: 阴离子向负极移动,阳离子向正极移动。注意: 电解质溶液中有电流,没有电子流动!负极正极电解质溶液e-阴离子还原反应氧化反应阳离子外电路内电路思考 :如何判断原电池正与负极?思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 电子流出的一极—负极 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 电子流出的一极—负极 ④从电极反应本质: 思考 :如何判断原电池正与负极?原电池“负极”的判断方法: 原电池“负极”的判断方法: ①从电极材料: 相对较活泼金属——负极 ②从电极反应现象: 溶解的一极—负极③从外电路电子流动方向: 电子流出的一极—负极 ④从电极反应本质: 被氧化的一极—负极思考 :如何判断原电池正与负极?在你的实验桌上提供的药品和电极中选择:实验探究b.更换电极材料,看是否有气泡产生,电 流表指针是否偏转?a.更换溶液,有什么现象发生?电流表指 针是否偏转?(3)原电池的形成条件①自发的氧化还原反应②活动性不同的两电极
(金属和金属或金属与碳棒)
注意:燃料电池中可为两惰性电极!
③电解质溶液④形成闭合回路哪个装置可以形成原电池?不能形成原电池的 指出理由。 1.学以致用哪个装置可以形成原电池?不能形成原电池的 指出理由。 E1.学以致用实验探究为什么锌片上也有大量气泡产生?实验探究2.锌和稀硫酸的反应(补充) ①和②哪个试管中产生气泡速率更快?实验探究 ①在一支试管中加适量锌片,然后缓慢加 入约5mL稀硫酸。 ②在另一支试管中加入同样多的锌片,然 后缓慢加入约5mL稀硫酸,再加入10滴 CuSO4的溶液。1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!Zn+2H+=Zn2++H2↑
Zn+Cu2+=Zn2++Cu1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!Zn+2H+=Zn2++H2↑
Zn+Cu2+=Zn2++Cu结论:形成原电池可以加快化学反应速率。由于锌片中有比锌不活泼的金属或非金属 (如碳)等杂质,本身形成了很多微小的原电 池,所以锌片上也有大量气泡产生。1.锌粒溶解,产生大量气泡。2.用硫酸铜溶液处理过的锌粒反应速率更快!Zn+2H+=Zn2++H2↑
Zn+Cu2+=Zn2++Cu结论:形成原电池可以加快化学反应速率。怎样使化学能尽可能多地转化为电能?怎样使化学能尽可能多地转化为电能?①提高电极的纯度;②将产生副反应的电极和电解质溶液隔离。 2.格林太太是位漂亮、乐观、开朗的妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:其中一颗是黄金的——这是她富有的标志;另一颗是不锈钢的——这是一次车祸后留下的痕迹。
令人百思不解的是,自从车祸以后,格林太太经常头痛、夜间失眠、心情烦躁----医生绞尽了脑汁,格林太太的病情仍未好转-----
学完本节内容后,请你为格林太太开一个药方 。学以致用 2.格林太太是位漂亮、乐观、开朗的妇女,当她开怀大笑的时候,人们可以发现她一口整齐洁白的牙齿中镶有两颗假牙:其中一颗是黄金的——这是她富有的标志;另一颗是不锈钢的——这是一次车祸后留下的痕迹。
令人百思不解的是,自从车祸以后,格林太太经常头痛、夜间失眠、心情烦躁----医生绞尽了脑汁,格林太太的病情仍未好转-----
学完本节内容后,请你为格林太太开一个药方 。由金与铁(钢的主要成分)是活动性不同的两种金属,唾液中含有电解质,故构成了原电池,产生了微小的电流,使得格林太太头痛,因此必须换掉其中一颗假牙。学以致用 3.铁及铁的化合物应用广泛,如 FeCl3 可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ___________
负极反应____________学以致用1.原电池的定义:3.原电池的形成条件:2.原电池的工作原理:本课小结
